나노 입자 추적 분석의 2018 지침 세포 밖 소포 연구에 대한 최소한의 정보를 충족하기위한 재현성 향상
Summary
나노입자 추적 분석(NTA)은 세포밖 소포를 특성화하기 위해 널리 사용되는 방법이다. 이 백서에서는 NTA 실험 파라미터 및 제어와 실험실 간 재현성을 위해 MISEV2018 및 EV-TRACK이 제안한 지침을 보완하는 데 필요한 샘플 및 희석제의 균일한 분석 및 특성화 방법을 강조합니다.
Abstract
나노입자 추적 분석(NTA)은 2006년부터 세포밖 소포(EV) 연구에 사용되는 여러 특성화 방법 중 하나였습니다. 많은 사람들은 NTA 기기와 소프트웨어 패키지를 최소한의 교육만으로 쉽게 활용할 수 있으며 크기 교정이 사내에서 가능하다고 생각합니다. NTA 획득 및 소프트웨어 분석이 모두 EV 특성화를 구성하므로 세포 밖 소포 연구를위한 최소 정보 2018 (MISEV2018)에서 다룹니다. 또한, EV 실험의 견고성을 향상시키기 위해 EV (EV-TRACK)의 투명한보고 및 중앙 집중화 지식에 의해 모니터링되었습니다 (예 : 통제되지 않은 요인으로 인한 실험 변동 최소화).
방법 및 제어에 대한보고를 장려하려는 노력에도 불구하고 많은 출판 된 연구 논문은 원래의 NTA 관찰을 재현하는 데 필요한 중요한 설정을보고하지 못합니다. 음성 대조군 또는 희석제의 NTA 특성화를보고하는 논문은 거의 없으며, 인산염 완충 식염수 또는 초순수 증류수와 같은 상업적으로 이용 가능한 제품이 미립자가 없다고 분명히 가정합니다. 마찬가지로, 긍정적 인 통제 또는 크기 표준은 입자 크기를 확인하기 위해 연구자에 의해보고되는 경우는 거의 없습니다. Stokes-Einstein 방정식은 입자 변위를 결정하기 위해 샘플 점도와 온도 변수를 통합합니다. 따라서 전체 샘플 비디오 수집 동안 안정적인 레이저 챔버 온도를 보고하는 것은 정확한 복제를 위한 필수적인 제어 측정입니다. 샘플 또는 희석제의 여과는 또한 일상적으로 보고되지 않으며, 만약 그렇다면, 필터의 특이성(제조자, 막 물질, 기공 크기) 및 저장 조건은 거의 포함되지 않는다. 국제 세포밖 소포 학회 (ISEV)의 허용 가능한 실험 세부 사항에 대한 최소한의 표준에는 EV의 특성화를위한 잘 문서화 된 NTA 프로토콜이 포함되어야합니다. 다음 실험은 NTA 분석 프로토콜이 개별 연구자에 의해 수립되어야 한다는 증거를 제공하며, 단일 소포 특성화에 대한 MISEV2018 요구 사항을 충족하기 위한 옵션 중 하나로 NTA 특성화를 사용하는 출판물 방법에 포함되어야 한다는 증거를 제공합니다.
Introduction
EV 및 기타 나노미터 크기의 입자에 대한 정확하고 반복 가능한 분석은 연구 및 산업 전반에 걸쳐 수많은 과제를 제시합니다. EV 연구의 복제는 부분적으로 데이터 수집과 관련된 필요한 매개 변수를보고하는 데 균일 성이 없기 때문에 어려웠습니다. 이러한 결함을 해결하기 위해 ISEV는 EV 연구원을위한 생화학적, 생물 물리학 적 및 기능적 표준의 최소 세트로 산업 지침을 제안하고 일반적으로 MISEV20141이라고하는 입장 성명서로 발표했습니다. EV 연구의 속도가 빨라지면서 업데이트 된 지침이 필요했으며 “MISEV2018 : ISEV의 입장 진술”은 MISEV2014 지침2를 확장했습니다. MISEV2018 논문에는 테이블, 제안된 프로토콜의 개요 및 특정 EV 관련 특성을 문서화하기 위해 따라야 할 단계가 포함되어 있습니다. 실험의 해석 및 복제를 용이하게하기위한 추가 조치로서 EV-TRACK은 EV 생물학 및 발표 된 결과에 사용 된 방법론에 대한보다 투명한보고를 가능하게하는 크라우드 소싱 지식 기반 (http://evtrack.org)으로 개발되었습니다3. 표준화 된 방법보고에 대한 이러한 권장 사항에도 불구하고이 분야는 게시 된 결과를 복제하고 확인하는 것과 관련하여 계속 어려움을 겪고 있습니다.
이 논문은 국립 보건원 (National Institutes of Health)과 국립 과학 재단 (National Science Foundation)의 품질 평가 도구 노력에 부합하여 ISEV가 실험실간에 결과를 복제하는 목적으로 데이터 평가 도구를 적용 할 수 있도록 방법과 세부 사항에 대한 표준화 된보고가 필요하다고 제안합니다. 보고된 세포 공급원, 세포 배양 절차 및 EV 분리 방법은 EV 집단의 특성을 정의하는 중요한 요소이다. NTA 기기 중에는 검출 설정, 담체 유체의 굴절률, 다분산성에 기여하는 이종 입자 집단, 표준화 된 보고 요구 사항 부족, 관찰자 내 및 관찰자 간 측정 결과 부재와 같은 요인으로 인해 실험실 간의 NTA 비교가 어렵거나 불가능 해집니다.
2006 년부터 사용중인 NTA는 현재 EV 연구원의 약 80 %가 사용하는 나노 입자 크기 및 농도 측정을위한 인기있는 방법입니다4. MISEV2018 지침에는 두 가지 형태의 단일 베시클 분석이 필요하며 그 중 NTA는 인기있는 옵션 중 하나입니다. NTA는 광범위한 접근성, 샘플 당 저렴한 비용 및 간단한 창립 이론 (Stokes-Einstein 방정식)으로 인해 EV 특성화에 계속 공통적으로 사용되고 있습니다. NTA에 의한 EV 평가는 레이저 광 산란 및 브라운 운동 분석을 사용하여 입자 크기 분포 및 농도 추정치를 생성하며, EV의 굴절률에 의해 결정된 검출의 하한을 갖는다. 알려진 점도 및 온도의 유체 샘플을 사용할 때, EV의 궤적은 두 차원에서 평균 제곱 변위를 결정하기 위해 추적됩니다. 이것은 입자 확산 계수가 계산되고 변형된 스토크스-아인슈타인 방정식 5,6,7에 의해 구체 등가 유체역학 직경으로 변환될 수 있게 한다. NTA의 입자-입자간 분석은 다른 특성화 방법들보다 EV들의 이질적인 집단에서 응집체 또는 더 큰 입자들에 의한 간섭이 적다7. 몇 개의 더 큰 입자가 사이징 정확도에 미치는 영향은 거의 없지만, 미세한 양의 크고 높은 광산란 입자가 존재하면 소프트웨어 EV 검출 및 추적 감소로 인해 더 작은 입자의 검출이 현저하게 감소합니다8. 측정 기술로서, NTA는 일반적으로 더 큰 입자 또는 입자의 응집체에 편향되지 않는 것으로 간주되지만 개별 입자 분석(9)을 통해 다중 크기 집단을 해결할 수 있다. 입자에 의한 광산란의 사용으로 인해 NTA 분석의 한계 중 하나는 EV와 비교하여 유사한 굴절 및 크기 특성을 가진 먼지, 플라스틱 또는 분말과 같은 미립자가 이러한 특성화 방법으로 실제 EV와 구별 될 수 없다는 것입니다.
NanoSight LM10 (나노 입자 크기 분석기) 및 LM14 (레이저 모듈)는 2006 년부터 판매되었으며이 기기의 새로운 모델이 개발되었지만이 특정 모델은 많은 핵심 시설에서 발견되며 신뢰할 수있는 작업으로 간주됩니다. 크기와 농도의 고해상도 측정을 위해 NTA 설정을 적절하게 최적화하려면 교육이 필요합니다. 최적의 비디오 녹화에 필요한 두 가지 중요한 설정은 (1) 카메라 레벨과 (2) 감지 임계값입니다. 이는 작업자가 샘플의 특성에 따라 설정해야 합니다. NTA 분석의 주요 제약 조건 중 하나는 107 ~ 10 9 입자 / mL 사이의 샘플 농도를 권장하는 것이며,이 샘플 희석을 달성하기 위해서는10이 필요할 수 있습니다. 인산염 완충 식염수, 0.15M 식염수 또는 초순수와 같은 희석에 사용되는 용액은 크기가 220μm 미만인 입자가 거의 없어 NTA 측정에 영향을 줄 수 있습니다. 희석에 사용되는 용액의 NTA 특성화는 분석되는 나노입자 샘플과 동일한 카메라 레벨 및 검출 임계값에서 수행되어야 한다. EV 샘플 희석에 사용되는 희석제에 존재하는 나노입자의 크기 및 농도는 EV의 NTA 분석을 포함하는 간행물에 거의 포함되지 않는다.
이 프로토콜은 선택된 카메라 레벨, 검출 임계값 및 샘플의 기계적 필터링을 사용하여 평가된 합성 EV 유사 리포좀의 NTA 분석을 사용하여 NTA 데이터 세트에 대한 카메라 레벨, 검출 임계값 또는 샘플 여과의 체계적인 영향을 분석합니다. 리포솜은 보충 파일 S1에 기재된 바와 같이 합성되었다. 합성 리포좀은 4°C에서 보관시 크기 균일성, 물리적 특성 및 안정성 때문에 본 실험에 사용되었다. EV의 실제 샘플이 사용될 수 있었지만, 저장 중 EV의 이질성과 안정성은이 연구와 해석을 복잡하게 만들 수 있습니다. (A) 리포솜과 (B) EV의 NTA 보고서의 유사성은 이 논문에서 리포솜에 대해 밝혀진 체계적인 효과가 EV 특성화에도 적용될 가능성이 높다는 것을 나타낸다(그림 1). 이러한 결과는 중요한 소프트웨어 설정에 대한 완전한 보고와 희석제, 희석 및 여과와 같은 샘플 처리에 대한 설명이 NTA 데이터의 재현성에 영향을 미친다는 개념을 지원합니다.
이 논문의 목적은 NTA 설정(온도, 카메라 레벨 및 검출 임계값)과 샘플 준비에 따라 수집된 결과가 변경된다는 것을 입증하는 것입니다: 체계적이고 크기 및 농도의 유의한 차이가 얻어졌다. NTA는 MISEV2018 특성화 사양을 충족하는 데 널리 사용되는 옵션 중 하나이므로 이러한 결과는 재현성을 보장하기 위해 샘플 준비 및 NTA 설정을 보고하는 것이 중요하다는 것을 보여줍니다.
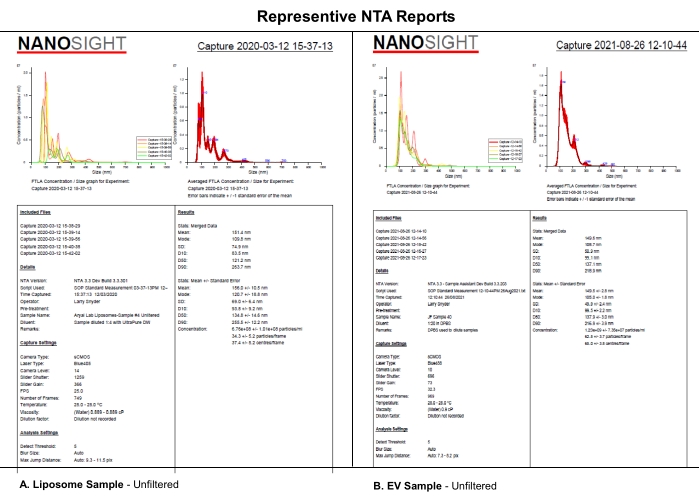
그림 1: 리포좀과 EV를 비교하기 위한 대표적인 NTA 보고서. (A) 리포솜: 2020년 3월 12일 NTA에 특징지어지는 여과되지 않은 샘플. (B) EVs: 2021년 8월 26일에 NTA에 특징지어지는 여과되지 않은 샘플. 약어: NTA = 나노입자 추적 분석; EVs = 세포밖 소포. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Protocol
Representative Results
Discussion
나노입자(11)의 크기 및 농도를 추정하기 위해 이용가능한 몇 가지 방법이 있다. 여기에는 동적 광 산란 (DLS), 원심 침강 및 단일 입자 레벨 분석 – 전자 현미경, NTA, 원자력 현미경 및 조정 가능한 저항 펄스 감지를 포함하여 집단으로부터 크기 추정치를 생성하는 앙상블 방법이 포함됩니다. 이 중 DLS와 NTA는 이상적인 매질에서의 브라운 운동을 기반으로 한 비파괴 크기 및 농도 측?…
Divulgaciones
The authors have nothing to disclose.
Acknowledgements
이 연구는 캔자스 주에서 중서부 비교 줄기 세포 생물학 연구소 (MICSCB), 존슨 암 연구 센터 (Johnson Cancer Research Center)에서 MLW 및 NIH R21AG066488에서 LKC로 지원되었습니다. OLS는 MICSCB로부터 GRA 지원을 받았습니다. 저자는이 프로젝트에 사용 된 리포솜을 제공 한 Santosh Aryal 박사와 Weiss 및 Christenson 연구소의 회원들에게 도움이되는 대화와 피드백을 제공합니다. 홍 박사 그는 기술 지원에 감사드립니다. MLW는 Betti Goren Weiss에게 그녀의 지원과 조언에 감사드립니다.
Materials
| Automatic Pipetter | |||
| Centrifuge Tubes, Conical, Nunc 15 mL | Thermo Sci. | 339650 | |
| Kimwipes | |||
| Lens Cleaner | |||
| Lens Paper | |||
| NanoSight LM-10 | Malvern Panalytical | ||
| NanoSight LM-14 Laser Module | Malvern Panalytical | ||
| Nanosight NTA Software Ver. 3.2 | Malvern Panalytical | ||
| Paper Towels | |||
| Pipette Tips, 1-200 µL, Filtered, Sterile, Low Binding | BioExpress | P -3243-200X | |
| Pipette Tips, 50-1,000 µL, Filtered, Sterile | BioExpress | P-3243-1250 | |
| Saline, Dulbecco's Phosphate Buffered (No Ca or Mg) | Gibco | 14190-144 | |
| Standards, Latex Transfer- 100 nm (3 mL) | Malvern | NTA4088 | |
| Standards, Latex Transfer- 50 nm (3 mL) | Malvern | NTA4087 | |
| Syringe Filter, 33 mm, .22 µm, MCE, Sterile | Fisher brand | 09-720-004 | |
| Syringe, TB, 1 mL, slip tip | Becton Dickinson | 309659 | |
| Waste fluid container |
Referencias
- Lotvall, J., et al. Minimal experimental requirements for definition of extracellular vesicles and their functions: a position statement from the International Society for Extracellular Vesicles. Journal of Extracellular Vesicles. 3 (1), (2014).
- Thery, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Consortium, E. -. T., et al. EV-TRACK: transparent reporting and centralizing knowledge in extracellular vesicle research. Nature Methods. 14 (3), 228-232 (2017).
- Gardiner, C., et al. Techniques used for the isolation and characterization of extracellular vesicles: results of a worldwide survey. Journal of Extracellular Vesicles. 5, 32945 (2016).
- Maas, S. L., et al. Possibilities and limitations of current technologies for quantification of biological extracellular vesicles and synthetic mimics. Journal of Controlled Release. 200, 87-96 (2015).
- Danaei, M., et al. Impact of particle size and polydispersity index on the clinical applications of lipidic nanocarrier systems. Pharmaceutics. 10 (2), 57 (2018).
- Kestens, V., Bozatzidis, V., De Temmerman, P. J., Ramaye, Y., Roebben, G. Validation of a particle tracking analysis method for the size determination of nano- and microparticles. Journal of Nanoparticle Research. 19 (8), 271 (2017).
- Filipe, V., Hawe, A., Jiskoot, W. Critical evaluation of nanoparticle tracking analysis (NTA) by NanoSight for the measurement of nanoparticles and protein aggregates. Pharmaceutical Research. 27 (5), 796-810 (2010).
- Hole, P., et al. Interlaboratory comparison of size measurements on nanoparticles using nanoparticle tracking analysis (NTA). Journal of Nanoparticle Research. 15 (12), 2101 (2013).
- Malvern analytical Ltd. . NanoSight LM10 Operating Manual-P550H. , (2013).
- Kim, A., Ng, W. B., Bernt, W., Cho, N. J. Validation of size estimation of nanoparticle tracking analysis on polydisperse macromolecule assembly. Scientific Reports. 9 (1), 2639 (2019).
- Gollwitzer, C., et al. A comparison of techniques for size measurement of nanoparticles in cell culture medium. Analytical Methods. 8 (26), 5272-5282 (2016).
- vander Pol, E., et al. Particle size distribution of exosomes and microvesicles determined by transmission electron microscopy, flow cytometry, nanoparticle tracking analysis, and resistive pulse sensing. Journal of Thrombosis and Haemostasis. 12 (7), 1182-1192 (2014).

