Modellierung der Hirnmetastasierung durch Injektion von Krebszellen in die innere Halsschlagader
Summary
Hirnmetastasen sind eine Ursache für schwere Morbidität und Mortalität bei Krebspatienten. Die meisten Hirnmetastasen-Mausmodelle werden durch systemische Metastasen kompliziert, die die Analyse der Mortalität und der therapeutischen Interventionsergebnisse verwirren. Hier wird ein Protokoll für die interne Karotisinjektion von Krebszellen vorgestellt, das konsistente intrakranielle Tumoren mit minimalen systemischen Tumoren erzeugt.
Abstract
Hirnmetastasen sind eine Ursache für schwere Morbidität und Mortalität bei Krebspatienten. Kritische Aspekte metastasierender Erkrankungen, wie die komplexe neuronale Mikroumgebung und die Stromazellinteraktion, können mit In-vitro-Assays nicht vollständig repliziert werden. Daher sind Tiermodelle entscheidend für die Untersuchung und das Verständnis der Auswirkungen therapeutischer Interventionen. Die meisten Xenografting-Methoden für Hirntumore erzeugen jedoch keine konsistenten Hirnmetastasen in Bezug auf den Zeitrahmen und die Tumorlast. Hirnmetastasenmodelle, die durch intrakardiale Injektion von Krebszellen generiert werden, können zu einer unbeabsichtigten extrakraniellen Tumorlast führen und zu nicht-hirnmetastasierender Morbidität und Mortalität führen. Obwohl die intrakranielle Injektion von Krebszellen die extrakranielle Tumorbildung einschränken kann, hat sie mehrere Vorbehalte, wie die injizierten Zellen bilden häufig eine einzelne Tumormasse an der Injektionsstelle, eine hohe leptomeningeale Beteiligung und eine Schädigung des Hirngefäßsystems während der Nadelpenetration. Dieses Protokoll beschreibt ein Mausmodell der Hirnmetastasierung, die durch Injektion der inneren Halsschlagader erzeugt wird. Diese Methode erzeugt intrakranielle Tumoren konsequent ohne Beteiligung anderer Organe, was die Beurteilung von Therapeutika für Hirnmetastasen ermöglicht.
Introduction
Hirnmetastasen sind eine weit verbreitete Malignität, die mit einer sehr schlechten Prognose einhergeht 1,2. Der Behandlungsstandard für Patienten mit Hirnmetastasen ist multimodal und besteht aus Neurochirurgie, Ganzhirnstrahlentherapie und/oder stereotaktischer Radiochirurgie, abhängig vom allgemeinen Gesundheitszustand der Patienten, der extrakraniellen Krankheitslast und der Anzahl und Lage der Tumoren im Gehirn 3,4. Patienten mit bis zu drei intrakraniellen Läsionen kommen für eine chirurgische Resektion oder stereotaktische Radiochirurgie in Frage, während eine Ganzhirnstrahlentherapie für Patienten mit mehreren Läsionen empfohlen wird, um das Risiko einer chirurgischen Infektion und eines Ödems zu vermeiden5. Die Ganzhirn-Strahlentherapie kann jedoch strahlenempfindliche Hirnstrukturen schädigen und zu einer schlechten Lebensqualität beitragen6.
Die systemische Therapie ist ein nicht-invasiver alternativer und logischer Ansatz zur Behandlung von Patienten mit multiplen Läsionen7. Es wird jedoch aufgrund der seit langem bestehenden Vorstellung, dass systemische Therapien eine schlechte Wirksamkeit haben, weniger berücksichtigt, da die passive Verabreichung von Zytostatika über den Blutkreislauf keine therapeutischen Werte im Gehirn ohne das Risiko einer unsicheren Toxizität erreichen kann8. Dieses Paradigma beginnt sich mit der kürzlich von der US-amerikanischen Food and Drug Administration (FDA) zugelassenen systemischen Therapie (Tucatinib mit Trastuzumab und Capecitabin indiziert für metastasierende HER2+-Brustkrebs-Hirnmetastasen)9,10,11,12 und der Aktualisierung der Behandlungsleitlinien zu ändern, um systemische Therapieoptionen für Hirnmetastasenpatientinnen einzubeziehen13,14.
In diesem Zusammenhang können Entwicklungen auf dem Gebiet der molekularen zielgerichteten Therapie, Immuntherapie und alternativer Wirkstoffabgabesysteme, wie z. B. eines gezielten Nano-Wirkstoffträgers, möglicherweise die Herausforderungen der Behandlung von Hirnmetastasen überwinden15,16,17,18. Darüber hinaus werden chemische und mechanische Ansätze zur Verbesserung der Wirkstoffabgabe durch Permeabilisierung der Hirntumorschranke untersucht19,20. Um solche Ansätze zu untersuchen und zu optimieren, ist es entscheidend, präklinische Modelle zu verwenden, die nicht nur die komplexe Physiologie der Hirnmetastasierung widerspiegeln, sondern auch eine objektive Analyse der intrakraniellen Arzneimittelreaktion ermöglichen.
Im Großen und Ganzen umfassen die aktuellen Ansätze zur Modellierung der Hirnmetastasierung in vivo die intrakardiale (linke Ventrikel), intravenöse (normalerweise Schwanzvene), intrakranielle oder intracarotis (gemeinsame Halsschlagader) Injektion von Krebszellen bei Mäusen 21,22,23,24,25,26,27 . Neben Tumortransplantationsstrategien sind gentechnisch veränderte Mausmodelle, bei denen die Tumorbildung durch die Entfernung von Tumorsuppressorgenen oder die Aktivierung von Onkogenen ausgelöst wird, für die Tumormodellierung nützlich. Es wird jedoch nur berichtet, dass nur wenige gentechnisch veränderte Mausmodelle sekundäre Tumore produzieren und noch weniger, die zuverlässig Hirnmetastasen produzieren28,29,30.
Engraftment-Methoden wie intrakardiale (linker Ventrikel) und intravenöse (meist Schwanzvene) Injektion ahmen die systemische Verbreitung von Krebs nach. Diese Modelle erzeugen typischerweise Läsionen in mehreren Organen (z. B. Gehirn, Lunge, Leber, Nieren, Milz), abhängig vom Kapillarbett, das die meisten Tumorzellen während ihres Kreislaufdurchgangs einfängt31. Inkonsistente Raten der Hirntransplantation erfordern jedoch mehr Tiere, um die Stichprobengröße für die gewünschte statistische Aussagekraft zu erreichen. Die Anzahl der Tumorzellen, die sich schließlich über diese intrakardialen und intravenösen Injektionsverfahren im Gehirn etablieren, ist variabel. Daher kann die Tumorlast der Hirnmetastasierung zwischen den Tieren variieren, und der Unterschied in der Progression kann die Standardisierung des experimentellen Zeitplans und die Interpretation der Ergebnisse zu einer Herausforderung machen. Die extrakranielle Tumorlast kann zu einer Mortalität ohne Hirnmetastasen führen, wodurch diese Modelle für die Bewertung der intrakraniellen Wirksamkeit ungeeignet sind. Gehirntropische Zelllinien wurden unter Verwendung künstlicher klonaler Selektionsprozesse etabliert, um die extrakranielle Etablierung zu reduzieren, aber die Aufnahmeraten waren inkonsistent, und der klonale Selektionsprozess kann die Heterogenität reduzieren, die normalerweise in menschlichen Tumoren gefunden wird32.
Gehirnspezifische Engraftment-Methoden wie die intrakranielle und intrakarotis-Injektion ermöglichen eine konsistentere und effizientere Hirnmetastasenmodellierung. Bei der intrakraniellen Methode33 werden typischerweise Krebszellen in die frontale Großhirnrinde injiziert, wodurch ein schnelles und reproduzierbares Tumorwachstum mit geringer systemischer Beteiligung erzeugt wird. Während das Verfahren bei niedriger Mortalität gut vertragen wird33, besteht der Vorbehalt darin, dass es sich um einen relativ groben Ansatz handelt, der schnell einen (lokalisierten) Bolus von Zellen im Gehirn einführt und keine frühe Hirnmetastasenpathogenese modelliert. Die Nadel schädigt das Gefäßsystem des Hirngewebes, was dann eine lokalisierte Entzündung verursacht 5,34. Erfahrungsgemäß besteht die Tendenz, dass Tumorzellen während der Entfernung der Nadel zum Reflux injizieren, was zu einer leptomeningealen Beteiligung führt. Alternativ bringt die intracarotis Methode Zellen in die gemeinsame Halsschlagader mit der Mikrovaskulatur des Gehirns als erstes Kapillarbett, das angetroffen wird, wodurch das Überleben im Kreislauf, die Extravasation und die Kolonisation modelliertwerden 24. In Übereinstimmung mit anderen25 ergab unsere Erfahrung mit dieser Methode, dass es aufgrund der unbeabsichtigten Abgabe von Krebszellen über die äußere Halsschlagader zu Kapillarbetten in diesen Geweben zu Gesichtstumoren kommen kann (unveröffentlichte Daten). Es ist möglich, Gesichtstumoren vorzubeugen, indem zuerst die äußere Halsschlagader vor der gemeinsamen Injektion der Halsschlagader ligiert wird (Abbildung 1). Im Rest des Artikels wird diese Methode als “Injektion der inneren Halsschlagader” bezeichnet. Erfahrungsgemäß erzeugt die Injektionsmethode der inneren Halsschlagader konsequent Hirnmetastasen mit sehr wenigen systemischen Ereignissen und war erfolgreich bei der Erzeugung von Hirnmetastasenmodellen verschiedener primärer Krebsarten (z. B. Melanom-, Brust- und Lungenkrebs) (Abbildung 1). Die Nachteile sind, dass es technisch anspruchsvoll, zeitaufwendig, invasiv ist und eine sorgfältige Optimierung der Zellzahlen und einen Überwachungszeitplan erfordert. Zusammenfassend lässt sich sagen, dass sowohl die intrakraniellen als auch die internen Karotis-Injektionsmethoden Mausmodelle hervorbringen, die sich für die Bewertung der therapeutischen Auswirkungen auf den Überlebensvorteil von Hirntumoren eignen.
Dieses Protokoll beschreibt die interne Karotis-Injektionsmethode, um ein Mausmodell der Hirnmetastasierung fast ohne systemische Beteiligung zu erstellen und daher für die präklinische Bewertung der Arzneimittelverteilung und Wirksamkeit experimenteller Therapeutika geeignet zu sein.
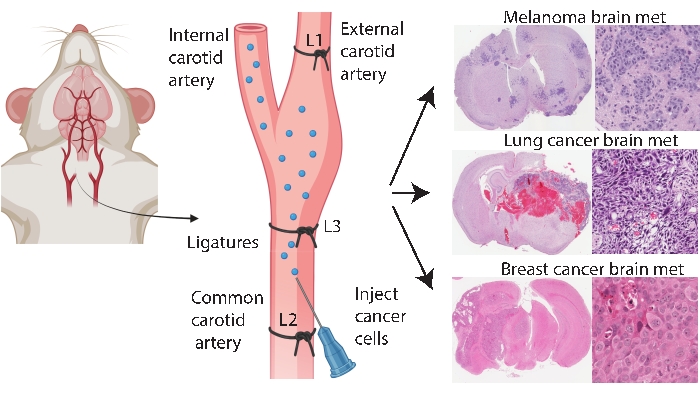
Abbildung 1: Schematische Darstellung des Injektionsprotokolls für die interne Halsschlagader für Hirnmetastasen. Die Injektion der internen Halsschlagader mit einer Ligatur der äußeren Halsschlagader kann zuverlässig ein Hirnmetastasenmodell aus verschiedenen primären Krebsarten erzeugen. In diesem Protokoll werden drei Ligaturen auf die Halsschlagader gelegt (in der Abbildung als L1-L3 annotiert). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Protocol
Representative Results
Discussion
Hirnmetastasierung ist ein komplexer Prozess von Krebszellen, die sich von ihrem primären Ort zum Gehirn ausbreiten. Es stehen verschiedene Tiermodelle zur Verfügung, die bestimmte Stadien dieses mehrstufigen Prozesses widerspiegeln, und es gibt physiologische und praktische Überlegungen zur Gestaltung präklinischer Metastasenstudien41,42. Die meisten veröffentlichten Studien, die den Einsatz von Nanomedizin zur Behandlung von Hirnmetastasen untersuchen, hab…
Divulgaciones
The authors have nothing to disclose.
Acknowledgements
Diese Forschung wurde vom Australian National Health and Medical Research Council (NHMRC), Fördernummer APP1162560, finanziert. ML wurde durch ein UQ-Postgraduierten-Forschungsstipendium finanziert. Wir möchten uns bei allen bedanken, die bei der Tierhaltung und in vivo Bildgebung der Tiere geholfen haben. Wir danken dem Royal Brisbane and Women’s Hospital für die Spende von Zirkonium-Aliquots für diese Studie.
Materials
| 100µm cell strainer | Corning | CLS431752 | |
| 30G Microlance needle | BD | 23748 | |
| 31G Ultra-Fine II insulin syringe | BD | 326103 | |
| Angled forceps | Proscitech | T67A-SS | Fine pointed, angled without serrations, 18mm tip, length 128 mm |
| Animal heat mat | |||
| Antibiotic and antimycotic | ThermoFisher Scientific | 15240062 | |
| Autoclave bags | |||
| BT-474 (HTB-20) breast cancer cell line | ATCC | HTB-20 | |
| Buprenorphine (TEMGESIC) | |||
| Countess cell counter | ThermoFisher Scientific | C10227 | |
| Diet-76A | ClearH2O | 72-07-5022 | |
| Dissection microscope | |||
| Ear puncher | |||
| Electric clippers | |||
| Fine angled forceps | Proscitech | DEF11063-07 | Angled 45°, Tip smooth, Tip width: 0.4 mm, Tip dimension: 0.4 x 0.3 mm, length 9cm |
| Fine tubing for cannula, Tubing OD (in) 1/32, Tubing ID (in) 1/100in | Cole Parmer | EW-06419-00 | |
| Foetal bovine serum | ThermoFisher Scientific | 26140079 | |
| Hank's Balanced Salt Solution without calcium and magnesium | ThermoFisher Scientific | 14170120 | |
| Hydrogel | ClearH2O | 70-01-5022 | |
| Isoflurane | |||
| Kimwipes Low lint disposable wipers | Kimberly Clark- Kimwipes | Z188964 | |
| Mashed mouse chow | |||
| Meloxicam (METACAM) | |||
| Nose cone | Fashioned out of a microfuge tube | ||
| PAA ocular lubricant (Carbomer 2mg/g) | Bausch and lomb | ||
| Povidone-iodine solution | Betadine | 2505692 | |
| PPE (glove, mask, gown, hairnet) | |||
| Retractors | Kent Scientific | SURGI-5001 | |
| RPMI 1640 Media | ThermoFisher Scientific | 11875093 | |
| Silk suture 13mm 5-0, P3, 45cm | Ethicon | JJ-640G | |
| Sterile normal saline | ThermoFisher Scientific | TM4469 | |
| Sticky tape | |||
| Surgical board | A chopping board wrapped with autoclavable bag. | ||
| Surgical scissors | Proscitech | T104 | Tip Dimensions (LxD): 38x7mm, Length 115mm |
| Suture forcep/ Curved Brophy forceps | Proscitech | T113C | Curved, Rounded narrow 2 mm tip, with serrations, length 165 mm |
| Suture needle holder (Olsen Hegar needle holder) | Proscitech | TC1322-180 | length 190 mm, ratchet clamp |
| Syringe driver with foot pedal/ UMP3 Ultra micro pump | World Precision Instruments | UMP3-3 | |
| T75 tissue culture flask | ThermoFisher Scientific | 156499 | |
| Thread | |||
| Trigene II surface disinfectant | Ceva | ||
| Trypan Blue and Cell Counting Chamber Slides | ThermoFisher Scientific | C10228 | |
| TrypLE Express dissociating medium | ThermoFisher Scientific | 12605010 |
Referencias
- Nayak, L., Lee, E. Q., Wen, P. Y. Epidemiology of brain metastases. Current Oncology Reports. 14 (1), 48-54 (2012).
- . Australian Institute of Health and Welfare. Cancer in Australia. , (2017).
- Maher, E. A., Mietz, J., Arteaga, C. L., DePinho, R. A., Mohla, S. Brain metastasis: opportunities in basic and translational research. Investigación sobre el cáncer. 69 (15), 6015-6020 (2009).
- Lin, N. U. Breast cancer brain metastases: new directions in systemic therapy. Ecancermedicalscience. 7, (2013).
- Zimmer, A. S., Van Swearingen, A. E. D., Anders, C. K. HER2-positive breast cancer brain metastasis: A new and exciting landscape. Cancer Reports. 5 (4), (2020).
- Brown, P. D., et al. Postoperative stereotactic radiosurgery compared with whole brain radiotherapy for resected metastatic brain disease (NCCTG N107C/CEC·3): a multicentre, randomised, controlled, phase 3 trial. Lancet Oncology. 18 (8), 1049-1060 (2017).
- Murrell, J., Board, R. The use of systemic therapies for the treatment of brain metastases in metastatic melanoma: Opportunities and unanswered questions. Cancer Treatment Reviews. 39 (8), 833-838 (2013).
- Stemmler, H. J., et al. Ratio of trastuzumab levels in serum and cerebrospinal fluid is altered in HER2-positive breast cancer patients with brain metastases and impairment of blood-brain barrier. Anticancer Drugs. 18 (1), 23-28 (2007).
- Venur, V. A., Leone, J. P. Targeted therapies for brain metastases from breast cancer. International Journal of Molecular Sciences. 17 (9), 1543 (2016).
- Murthy, R., et al. Tucatinib with capecitabine and trastuzumab in advanced HER2-positive metastatic breast cancer with and without brain metastases: a non-randomised, open-label, phase 1b study. The Lancet Oncology. 19 (7), 880-888 (2018).
- Murthy, R. K., et al. trastuzumab, and capecitabine for HER2-positive metastatic breast cancer. New England Journal of Medicine. 382 (7), 597-609 (2019).
- Shah, M., et al. FDA approval summary: Tucatinib for the treatment of patients with advanced or metastatic HER2-positive breast cancer. Clinical Cancer Research. 27 (5), 1220-1226 (2021).
- Vogelbaum, M. A., et al. Treatment for brain metastases: ASCO-SNO-ASTRO guideline. Journal of Clinical Oncology. 40 (5), 492-516 (2021).
- Ramakrishna, N., et al. Management of advanced human epidermal growth factor receptor 2-positive breast cancer and brain metastases: ASCO guideline update. Journal of Clinical Oncology. 10, (2022).
- Li, J., et al. A multifunctional polymeric nanotheranostic system delivers doxorubicin and imaging agents across the blood-brain barrier targeting brain metastases of breast cancer. ACS Nano. 8 (10), 9925-9940 (2014).
- Mittapalli, R. K., et al. Paclitaxel-hyaluronic nanoconjugates prolong overall survival in a preclinical brain metastases of breast cancer model. Molecular Cancer Therapeutics. 12 (11), 2389-2399 (2013).
- Hamilton, A. M., et al. Nanoparticles coated with the tumor-penetrating peptide iRGD reduce experimental breast cancer metastasis in the brain. Journal of Molecular Medicine. 93 (9), 991-1001 (2015).
- Patil, R., et al. MRI virtual biopsy and treatment of brain metastatic tumors with targeted nanobioconjugates: nanoclinic in the brain. ACS Nano. 9 (5), 5594-5608 (2015).
- Brighi, C., et al. MR-guided focused ultrasound increases antibody delivery to non-enhancing high-grade glioma. Neuro-Oncology Advances. 2 (1), (2020).
- Inamura, T., Black, K. L. Bradykinin selectively opens blood-tumor barrier in experimental brain tumors. Journal of Cerebral Blood Flow & Metabolism. 14 (5), 862-870 (1994).
- Priego, N., et al. Abstract 2746: Stat3 labels a subpopulation of reactive astrocytes required for brain metastasis. Investigación sobre el cáncer. 79, 2746 (2019).
- Wyatt, E. A., Davis, M. E. Method of establishing breast cancer brain metastases affects brain uptake and efficacy of targeted, therapeutic nanoparticles. Bioengineering & Translational Medicine. 4 (1), 30-37 (2018).
- Nakayama, J., et al. The in vivo selection method in breast cancer metastasis. International Journal of Molecular Sciences. 22 (4), 1886 (2021).
- Zhang, C., Lowery, F. J., Yu, D. Intracarotid cancer cell injection to produce mouse models of brain metastasis. Journal of Visualized Experiments. 120, 55085 (2017).
- Liu, Z., et al. Improving orthotopic mouse models of patient-derived breast cancer brain metastases by a modified intracarotid injection method. Scientific Reports. 9 (1), 622 (2019).
- Bos, P. D., et al. Genes that mediate breast cancer metastasis to the brain. Nature. 459, 1005-1009 (2009).
- Hu, X., Villodre, E. S., Woodward, W. A., Debeb, B. G. Modeling brain metastasis via tail-vein injection of inflammatory breast cancer cells. Journal of Visualized Experiments. 168, (2021).
- Cho, J. H., et al. AKT1 activation promotes development of melanoma metastases. Cell Reports. 13 (5), 898-905 (2015).
- Meuwissen, R., et al. Induction of small cell lung cancer by somatic inactivation of both Trp53 and Rb1 in a conditional mouse model. Cancer Cell. 4 (3), 181-189 (2003).
- Kato, M., et al. Transgenic mouse model for skin malignant melanoma. Oncogene. 17 (14), 1885-1888 (1998).
- Khanna, C., Hunter, K. Modeling metastasis in vivo. Carcinogenesis. 26 (3), 513-523 (2005).
- Sulaiman, A., Wang, L. Bridging the divide: preclinical research discrepancies between triple-negative breast cancer cell lines and patient tumors. Oncotarget. 8 (68), 113269-113281 (2017).
- Pierce, A. M., Keating, A. K. Creating anatomically accurate and reproducible intracranial xenografts of human brain tumors. Journal of Visualized Experiments. 91, 52017 (2014).
- Geisler, J. A., et al. Modeling brain metastases through intracranial injection and magnetic resonance imaging. Journal of Visualized Experiments. 160, (2020).
- Reid, Y., Storts, D., Riss, T., Minor, L., et al. . in Assay Guidance Manual. eds Markossian, S. et al.) Eli Lilly & Company and the National Center for Advancing Translational Sciences. , (2004).
- Janowicz, P. W., et al. Understanding nanomedicine treatment in an aggressive spontaneous brain cancer model at the stage of early blood brain barrier disruption. Biomaterials. , 283 (2022).
- Houston, Z. H., et al. Understanding the Uptake of Nanomedicines at Different Stages of Brain Cancer Using a Modular Nanocarrier Platform and Precision Bispecific Antibodies. ACS Cent Sci. 6 (5), 727-738 (2020).
- Matsumura, Y., Maeda, H. A new concept for macromolecular therapeutics in cancer chemotherapy: mechanism of tumoritropic accumulation of proteins and the antitumor agent smancs. Investigación sobre el cáncer. 46, 6387-6392 (1986).
- Clemons, T. D., et al. Distinction between active and passive targeting of nanoparticles dictate their overall therapeutic efficacy. Langmuir. 34 (50), 15343-15349 (2018).
- Wu, J., et al. Transcardiac perfusion of the mouse for brain tissue dissection and fixation. Bio-Protocol. 11 (5), (2021).
- Masmudi-Martín, M., et al. Brain metastasis models: What should we aim to achieve better treatments. Advanced Drug Delivery Reviews. 169 (20), 79-99 (2021).
- Carney, C. P., et al. Harnessing nanomedicine for enhanced immunotherapy for breast cancer brain metastases. Drug Delivery and Translational Research. 11 (6), 2344-2370 (2021).
- Hamilton, A. M., et al. Nanoparticles coated with the tumor-penetrating peptide iRGD reduce experimental breast cancer metastasis in the brain. Journal of Molecular Medicine. 93 (9), 991-1001 (2015).
- Bao, Y., et al. Synergistic chemotherapy for breast cancer and breast cancer brain metastases via paclitaxel-loaded oleanolic acid nanoparticles. Molecular Pharmaceutics. 17 (4), 1343-1351 (2020).
- Kotb, S., et al. Gadolinium-based nanoparticles and radiation therapy for multiple brain melanoma metastases: Proof of concept before phase I trial. Theranostics. 6 (3), 418-427 (2016).
- Zhang, T., et al. Multitargeted nanoparticles deliver synergistic drugs across the blood-brain barrier to brain metastases of triple negative breast cancer cells and tumor-associated macrophages. Advanced Healthcare Materials. 8 (18), 1900543 (2019).
- He, C., et al. Blood-brain barrier-penetrating amphiphilic polymer nanoparticles deliver docetaxel for the treatment of brain metastases of triple negative breast cancer. Journal of Controlled Release. 246, 98-109 (2017).
- Wang, X., et al. Enhanced anti-brain metastasis from non-small cell lung cancer of osimertinib and doxorubicin co-delivery targeted nanocarrier. International Journal of Nanomedicine. 15, 5491-5501 (2020).
- Gries, M., et al. Multiscale selectivity and in vivo biodistribution of NRP-1-targeted theranostic AGuIX nanoparticles for PDT of glioblastoma. International Journal of Nanomedicine. 15, 8739-8758 (2020).

