Modelado de metástasis cerebrales mediante inyección de células cancerosas en la arteria carótida interna
Summary
La metástasis cerebral es una causa de morbilidad y mortalidad graves en pacientes con cáncer. La mayoría de los modelos de ratón con metástasis cerebral se complican con metástasis sistémicas que confunden el análisis de la mortalidad y los resultados de la intervención terapéutica. Aquí se presenta un protocolo para la inyección carótida interna de células cancerosas que produce tumores intracraneales consistentes con tumores sistémicos mínimos.
Abstract
La metástasis cerebral es una causa de morbilidad y mortalidad graves en pacientes con cáncer. Los aspectos críticos de las enfermedades metastásicas, como el microambiente neural complejo y la interacción de las células del estroma, no pueden replicarse completamente con ensayos in vitro ; Por lo tanto, los modelos animales son críticos para investigar y comprender los efectos de la intervención terapéutica. Sin embargo, la mayoría de los métodos de xenoinjerto de tumores cerebrales no producen metástasis cerebrales consistentes en términos del marco de tiempo y la carga tumoral. Los modelos de metástasis cerebral generados por la inyección intracardíaca de células cancerosas pueden dar lugar a una carga tumoral extracraneal no intencional y dar lugar a morbilidad y mortalidad metastásicas no cerebrales. Aunque la inyección intracraneal de células cancerosas puede limitar la formación de tumores extracraneales, tiene varias advertencias, como que las células inyectadas con frecuencia forman una masa tumoral singular en el sitio de inyección, alta afectación leptomeníngea y daño a la vasculatura cerebral durante la penetración de la aguja. Este protocolo describe un modelo de ratón de metástasis cerebral generada por inyección de arteria carótida interna. Este método produce tumores intracraneales de forma consistente sin la participación de otros órganos, lo que permite la evaluación de agentes terapéuticos para la metástasis cerebral.
Introduction
La metástasis cerebral es una neoplasia maligna prevalente asociada a un pronóstico muy precario 1,2. El estándar de atención para los pacientes con metástasis cerebral es multimodal, consistiendo en neurocirugía, radioterapia cerebral completa y/o radiocirugía estereotáctica dependiendo del estado general de salud de los pacientes, la carga de enfermedad extracraneal y el número y localización de tumores en el cerebro 3,4. Los pacientes con hasta tres lesiones intracraneales son elegibles para resección quirúrgica o radiocirugía estereotáctica, mientras que la radioterapia de todo el cerebro se recomienda para pacientes con lesiones múltiples para evitar el riesgo de infección relacionada con la cirugía y edema5. Sin embargo, la radioterapia cerebral completa puede infligir daño a las estructuras cerebrales radiosensibles, contribuyendo a una mala calidad de vida6.
La terapia sistémica es una alternativa no invasiva y un abordaje lógico para tratar a los pacientes con lesiones múltiples7. Sin embargo, es menos considerado debido a la noción de larga data de que las terapias sistémicas tienen poca eficacia, ya que la administración pasiva de fármacos citotóxicos a través del torrente sanguíneo no puede alcanzar niveles terapéuticos en el cerebro sin el riesgo de toxicidad insegura8. Este paradigma está empezando a cambiar con la terapia sistémica recientemente aprobada por la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) (tucatinib con trastuzumab y capecitabina indicada para la metástasis cerebral metastásica del cáncer de mama HER2+)9,10,11,12 y la actualización en las guías de tratamiento para incluir la consideración de opciones de terapia sistémica para pacientes con metástasis cerebral13,14.
En este contexto, los desarrollos en el campo de la terapia molecular dirigida, la inmunoterapia y los sistemas alternativos de administración de fármacos, como un portador de nanofármacos dirigido, pueden superar potencialmente los desafíos del tratamiento de metástasis cerebral15,16,17,18. Además, también se están investigando enfoques químicos y mecánicos para mejorar la administración de fármacos a través de la permeabilización de la barrera cerebro-tumor19,20. Para estudiar y optimizar tales enfoques para que sean adecuados para su propósito, es crucial utilizar modelos preclínicos que no solo reflejen la compleja fisiología de la metástasis cerebral, sino que también permitan un análisis objetivo de la respuesta intracraneal al fármaco.
En términos generales, los enfoques actuales para modelar la metástasis cerebral in vivo implican la inyección intracardíaca (ventrículo izquierdo), intravenosa (generalmente vena de la cola), intracraneal o intracarotídea (arteria carótida común) de células cancerosas en ratones 21,22,23,24,25,26,27 . Además de las estrategias de injerto tumoral, los modelos de ratón genéticamente modificados donde la formación de tumores se desencadena por la eliminación de genes supresores de tumores o la activación de oncogenes son útiles para el modelado tumoral. Sin embargo, solo unos pocos modelos de ratones genéticamente modificados producen tumores secundarios y aún menos que producen metástasis cerebrales de manera confiable28,29,30.
Los métodos de injerto como la inyección intracardíaca (ventrículo izquierdo) e intravenosa (generalmente vena de la cola) imitan la diseminación sistémica del cáncer. Estos modelos típicamente producen lesiones en múltiples órganos (por ejemplo, cerebro, pulmones, hígado, riñones, bazo) dependiendo del lecho capilar que atrapa la mayoría de las células tumorales durante su “primer paso” circulatorio31. Sin embargo, las tasas inconsistentes de injerto cerebral requerirán más animales para lograr el tamaño de muestra para el poder estadístico deseado. El número de células tumorales que eventualmente se establecen en el cerebro a través de estos métodos de inyección intracardíaca e intravenosa es variable. Por lo tanto, la carga tumoral de metástasis cerebral puede variar entre animales y la diferencia en la progresión puede hacer que la estandarización de la línea de tiempo experimental y la interpretación de los resultados sea un desafío. La carga tumoral extracraneal puede conducir a una mortalidad por metástasis no cerebral, lo que hace que estos modelos no sean adecuados para evaluar la eficacia intracraneal. Las líneas celulares cerebro-trópico se han establecido utilizando procesos de selección clonal artificial para reducir el establecimiento extracraneal, pero las tasas de toma han sido inconsistentes, y el proceso de selección clonal puede reducir la heterogeneidad que normalmente se encuentra en los tumores humanos32.
Los métodos de injerto específicos del cerebro, como la inyección intracraneal e intracarotídea, permiten un modelado de metástasis cerebrales más consistente y eficiente. En el método intracraneal33, las células cancerosas se inyectan típicamente en la corteza cerebral frontal, lo que genera un crecimiento tumoral rápido y reproducible con baja afectación sistémica. Si bien el procedimiento es bien tolerado con baja mortalidad33, las advertencias son que es un enfoque relativamente crudo que introduce rápidamente un bolo (localizado) de células en el cerebro y no modela la patogénesis temprana de la metástasis cerebral. La aguja daña la vasculatura del tejido cerebral, lo que luego causa inflamación localizada 5,34. Por experiencia, hay una tendencia a que la inyección de células tumorales fluya durante la extracción de la aguja, lo que lleva a la afectación leptomeníngea. Alternativamente, el método intracarotídeo entrega células en la arteria carótida común con microvasculatura cerebral como el primer lecho capilar que se encontró, modelando la supervivencia en circulación, extravasación y colonización24. De acuerdo con otros25, nuestra experiencia con este método encontró que puede resultar en tumores faciales debido a la entrega no intencional de células cancerosas a través de la arteria carótida externa a los lechos capilares en estos tejidos (datos no publicados). Es posible prevenir los tumores faciales ligando primero la arteria carótida externa antes de la inyección de la arteria carótida común (Figura 1). En el resto del artículo, este método se conoce como la “inyección de la arteria carótida interna”. Por experiencia, el método de inyección de la arteria carótida interna genera consistentemente metástasis cerebrales con muy pocos eventos sistémicos y ha tenido éxito en la generación de modelos de metástasis cerebral de diferentes cánceres primarios (por ejemplo, melanoma, cáncer de mama y de pulmón) (Figura 1). Las desventajas son que es técnicamente desafiante, requiere mucho tiempo, es invasivo y requiere una optimización cuidadosa del número de células y una línea de tiempo de monitoreo. En resumen, los métodos de inyección intracraneal y de la arteria carótida interna producen modelos de ratón adecuados para evaluar el impacto terapéutico en el beneficio de supervivencia relacionado con el tumor cerebral.
Este protocolo describe el método de inyección de la arteria carótida interna para producir un modelo de ratón de metástasis cerebral casi sin afectación sistémica y, por lo tanto, adecuado para la evaluación preclínica de la distribución del fármaco y la eficacia de la terapéutica experimental.
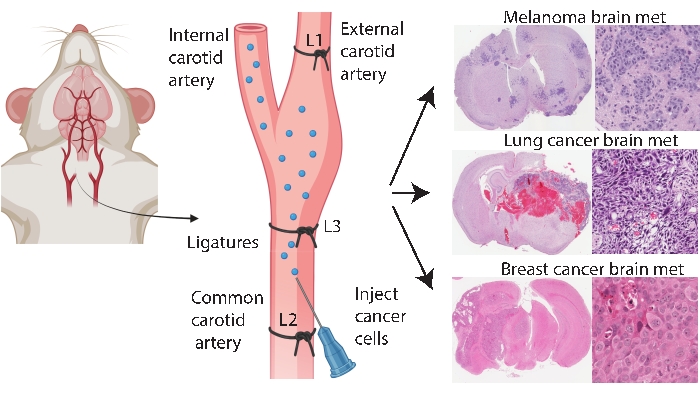
Figura 1: Representación esquemática del protocolo de inyección de la arteria carótida interna para metástasis cerebral. La inyección de la arteria carótida interna con ligadura de la arteria carótida externa puede producir de manera confiable un modelo de metástasis cerebral de varios cánceres primarios. En este protocolo, se colocan tres ligaduras en la arteria carótida (anotadas como L1-L3 en la figura). Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
La metástasis cerebral es un proceso complejo de células cancerosas que se propagan desde su sitio primario hasta el cerebro. Existen diferentes modelos animales que reflejan ciertas etapas de este proceso de múltiples pasos y existen consideraciones fisiológicas y prácticas para diseñar estudios de metástasis preclínicas41,42. La mayoría de los estudios publicados que investigan el uso de la nanomedicina para el tratamiento de la metástasis cerebral ha…
Divulgaciones
The authors have nothing to disclose.
Acknowledgements
Esta investigación fue financiada por el Consejo Nacional Australiano de Salud e Investigación Médica (NHMRC), número de subvención APP1162560. ML fue financiado por una beca de investigación de posgrado de la UQ. Nos gustaría agradecer a todos los que ayudaron con la cría de animales y las imágenes in vivo de los animales. Agradecemos al Royal Brisbane and Women’s Hospital por donar alícuotas de circonio para este estudio.
Materials
| 100µm cell strainer | Corning | CLS431752 | |
| 30G Microlance needle | BD | 23748 | |
| 31G Ultra-Fine II insulin syringe | BD | 326103 | |
| Angled forceps | Proscitech | T67A-SS | Fine pointed, angled without serrations, 18mm tip, length 128 mm |
| Animal heat mat | |||
| Antibiotic and antimycotic | ThermoFisher Scientific | 15240062 | |
| Autoclave bags | |||
| BT-474 (HTB-20) breast cancer cell line | ATCC | HTB-20 | |
| Buprenorphine (TEMGESIC) | |||
| Countess cell counter | ThermoFisher Scientific | C10227 | |
| Diet-76A | ClearH2O | 72-07-5022 | |
| Dissection microscope | |||
| Ear puncher | |||
| Electric clippers | |||
| Fine angled forceps | Proscitech | DEF11063-07 | Angled 45°, Tip smooth, Tip width: 0.4 mm, Tip dimension: 0.4 x 0.3 mm, length 9cm |
| Fine tubing for cannula, Tubing OD (in) 1/32, Tubing ID (in) 1/100in | Cole Parmer | EW-06419-00 | |
| Foetal bovine serum | ThermoFisher Scientific | 26140079 | |
| Hank's Balanced Salt Solution without calcium and magnesium | ThermoFisher Scientific | 14170120 | |
| Hydrogel | ClearH2O | 70-01-5022 | |
| Isoflurane | |||
| Kimwipes Low lint disposable wipers | Kimberly Clark- Kimwipes | Z188964 | |
| Mashed mouse chow | |||
| Meloxicam (METACAM) | |||
| Nose cone | Fashioned out of a microfuge tube | ||
| PAA ocular lubricant (Carbomer 2mg/g) | Bausch and lomb | ||
| Povidone-iodine solution | Betadine | 2505692 | |
| PPE (glove, mask, gown, hairnet) | |||
| Retractors | Kent Scientific | SURGI-5001 | |
| RPMI 1640 Media | ThermoFisher Scientific | 11875093 | |
| Silk suture 13mm 5-0, P3, 45cm | Ethicon | JJ-640G | |
| Sterile normal saline | ThermoFisher Scientific | TM4469 | |
| Sticky tape | |||
| Surgical board | A chopping board wrapped with autoclavable bag. | ||
| Surgical scissors | Proscitech | T104 | Tip Dimensions (LxD): 38x7mm, Length 115mm |
| Suture forcep/ Curved Brophy forceps | Proscitech | T113C | Curved, Rounded narrow 2 mm tip, with serrations, length 165 mm |
| Suture needle holder (Olsen Hegar needle holder) | Proscitech | TC1322-180 | length 190 mm, ratchet clamp |
| Syringe driver with foot pedal/ UMP3 Ultra micro pump | World Precision Instruments | UMP3-3 | |
| T75 tissue culture flask | ThermoFisher Scientific | 156499 | |
| Thread | |||
| Trigene II surface disinfectant | Ceva | ||
| Trypan Blue and Cell Counting Chamber Slides | ThermoFisher Scientific | C10228 | |
| TrypLE Express dissociating medium | ThermoFisher Scientific | 12605010 |
Referencias
- Nayak, L., Lee, E. Q., Wen, P. Y. Epidemiology of brain metastases. Current Oncology Reports. 14 (1), 48-54 (2012).
- . Australian Institute of Health and Welfare. Cancer in Australia. , (2017).
- Maher, E. A., Mietz, J., Arteaga, C. L., DePinho, R. A., Mohla, S. Brain metastasis: opportunities in basic and translational research. Investigación sobre el cáncer. 69 (15), 6015-6020 (2009).
- Lin, N. U. Breast cancer brain metastases: new directions in systemic therapy. Ecancermedicalscience. 7, (2013).
- Zimmer, A. S., Van Swearingen, A. E. D., Anders, C. K. HER2-positive breast cancer brain metastasis: A new and exciting landscape. Cancer Reports. 5 (4), (2020).
- Brown, P. D., et al. Postoperative stereotactic radiosurgery compared with whole brain radiotherapy for resected metastatic brain disease (NCCTG N107C/CEC·3): a multicentre, randomised, controlled, phase 3 trial. Lancet Oncology. 18 (8), 1049-1060 (2017).
- Murrell, J., Board, R. The use of systemic therapies for the treatment of brain metastases in metastatic melanoma: Opportunities and unanswered questions. Cancer Treatment Reviews. 39 (8), 833-838 (2013).
- Stemmler, H. J., et al. Ratio of trastuzumab levels in serum and cerebrospinal fluid is altered in HER2-positive breast cancer patients with brain metastases and impairment of blood-brain barrier. Anticancer Drugs. 18 (1), 23-28 (2007).
- Venur, V. A., Leone, J. P. Targeted therapies for brain metastases from breast cancer. International Journal of Molecular Sciences. 17 (9), 1543 (2016).
- Murthy, R., et al. Tucatinib with capecitabine and trastuzumab in advanced HER2-positive metastatic breast cancer with and without brain metastases: a non-randomised, open-label, phase 1b study. The Lancet Oncology. 19 (7), 880-888 (2018).
- Murthy, R. K., et al. trastuzumab, and capecitabine for HER2-positive metastatic breast cancer. New England Journal of Medicine. 382 (7), 597-609 (2019).
- Shah, M., et al. FDA approval summary: Tucatinib for the treatment of patients with advanced or metastatic HER2-positive breast cancer. Clinical Cancer Research. 27 (5), 1220-1226 (2021).
- Vogelbaum, M. A., et al. Treatment for brain metastases: ASCO-SNO-ASTRO guideline. Journal of Clinical Oncology. 40 (5), 492-516 (2021).
- Ramakrishna, N., et al. Management of advanced human epidermal growth factor receptor 2-positive breast cancer and brain metastases: ASCO guideline update. Journal of Clinical Oncology. 10, (2022).
- Li, J., et al. A multifunctional polymeric nanotheranostic system delivers doxorubicin and imaging agents across the blood-brain barrier targeting brain metastases of breast cancer. ACS Nano. 8 (10), 9925-9940 (2014).
- Mittapalli, R. K., et al. Paclitaxel-hyaluronic nanoconjugates prolong overall survival in a preclinical brain metastases of breast cancer model. Molecular Cancer Therapeutics. 12 (11), 2389-2399 (2013).
- Hamilton, A. M., et al. Nanoparticles coated with the tumor-penetrating peptide iRGD reduce experimental breast cancer metastasis in the brain. Journal of Molecular Medicine. 93 (9), 991-1001 (2015).
- Patil, R., et al. MRI virtual biopsy and treatment of brain metastatic tumors with targeted nanobioconjugates: nanoclinic in the brain. ACS Nano. 9 (5), 5594-5608 (2015).
- Brighi, C., et al. MR-guided focused ultrasound increases antibody delivery to non-enhancing high-grade glioma. Neuro-Oncology Advances. 2 (1), (2020).
- Inamura, T., Black, K. L. Bradykinin selectively opens blood-tumor barrier in experimental brain tumors. Journal of Cerebral Blood Flow & Metabolism. 14 (5), 862-870 (1994).
- Priego, N., et al. Abstract 2746: Stat3 labels a subpopulation of reactive astrocytes required for brain metastasis. Investigación sobre el cáncer. 79, 2746 (2019).
- Wyatt, E. A., Davis, M. E. Method of establishing breast cancer brain metastases affects brain uptake and efficacy of targeted, therapeutic nanoparticles. Bioengineering & Translational Medicine. 4 (1), 30-37 (2018).
- Nakayama, J., et al. The in vivo selection method in breast cancer metastasis. International Journal of Molecular Sciences. 22 (4), 1886 (2021).
- Zhang, C., Lowery, F. J., Yu, D. Intracarotid cancer cell injection to produce mouse models of brain metastasis. Journal of Visualized Experiments. 120, 55085 (2017).
- Liu, Z., et al. Improving orthotopic mouse models of patient-derived breast cancer brain metastases by a modified intracarotid injection method. Scientific Reports. 9 (1), 622 (2019).
- Bos, P. D., et al. Genes that mediate breast cancer metastasis to the brain. Nature. 459, 1005-1009 (2009).
- Hu, X., Villodre, E. S., Woodward, W. A., Debeb, B. G. Modeling brain metastasis via tail-vein injection of inflammatory breast cancer cells. Journal of Visualized Experiments. 168, (2021).
- Cho, J. H., et al. AKT1 activation promotes development of melanoma metastases. Cell Reports. 13 (5), 898-905 (2015).
- Meuwissen, R., et al. Induction of small cell lung cancer by somatic inactivation of both Trp53 and Rb1 in a conditional mouse model. Cancer Cell. 4 (3), 181-189 (2003).
- Kato, M., et al. Transgenic mouse model for skin malignant melanoma. Oncogene. 17 (14), 1885-1888 (1998).
- Khanna, C., Hunter, K. Modeling metastasis in vivo. Carcinogenesis. 26 (3), 513-523 (2005).
- Sulaiman, A., Wang, L. Bridging the divide: preclinical research discrepancies between triple-negative breast cancer cell lines and patient tumors. Oncotarget. 8 (68), 113269-113281 (2017).
- Pierce, A. M., Keating, A. K. Creating anatomically accurate and reproducible intracranial xenografts of human brain tumors. Journal of Visualized Experiments. 91, 52017 (2014).
- Geisler, J. A., et al. Modeling brain metastases through intracranial injection and magnetic resonance imaging. Journal of Visualized Experiments. 160, (2020).
- Reid, Y., Storts, D., Riss, T., Minor, L., et al. . in Assay Guidance Manual. eds Markossian, S. et al.) Eli Lilly & Company and the National Center for Advancing Translational Sciences. , (2004).
- Janowicz, P. W., et al. Understanding nanomedicine treatment in an aggressive spontaneous brain cancer model at the stage of early blood brain barrier disruption. Biomaterials. , 283 (2022).
- Houston, Z. H., et al. Understanding the Uptake of Nanomedicines at Different Stages of Brain Cancer Using a Modular Nanocarrier Platform and Precision Bispecific Antibodies. ACS Cent Sci. 6 (5), 727-738 (2020).
- Matsumura, Y., Maeda, H. A new concept for macromolecular therapeutics in cancer chemotherapy: mechanism of tumoritropic accumulation of proteins and the antitumor agent smancs. Investigación sobre el cáncer. 46, 6387-6392 (1986).
- Clemons, T. D., et al. Distinction between active and passive targeting of nanoparticles dictate their overall therapeutic efficacy. Langmuir. 34 (50), 15343-15349 (2018).
- Wu, J., et al. Transcardiac perfusion of the mouse for brain tissue dissection and fixation. Bio-Protocol. 11 (5), (2021).
- Masmudi-Martín, M., et al. Brain metastasis models: What should we aim to achieve better treatments. Advanced Drug Delivery Reviews. 169 (20), 79-99 (2021).
- Carney, C. P., et al. Harnessing nanomedicine for enhanced immunotherapy for breast cancer brain metastases. Drug Delivery and Translational Research. 11 (6), 2344-2370 (2021).
- Hamilton, A. M., et al. Nanoparticles coated with the tumor-penetrating peptide iRGD reduce experimental breast cancer metastasis in the brain. Journal of Molecular Medicine. 93 (9), 991-1001 (2015).
- Bao, Y., et al. Synergistic chemotherapy for breast cancer and breast cancer brain metastases via paclitaxel-loaded oleanolic acid nanoparticles. Molecular Pharmaceutics. 17 (4), 1343-1351 (2020).
- Kotb, S., et al. Gadolinium-based nanoparticles and radiation therapy for multiple brain melanoma metastases: Proof of concept before phase I trial. Theranostics. 6 (3), 418-427 (2016).
- Zhang, T., et al. Multitargeted nanoparticles deliver synergistic drugs across the blood-brain barrier to brain metastases of triple negative breast cancer cells and tumor-associated macrophages. Advanced Healthcare Materials. 8 (18), 1900543 (2019).
- He, C., et al. Blood-brain barrier-penetrating amphiphilic polymer nanoparticles deliver docetaxel for the treatment of brain metastases of triple negative breast cancer. Journal of Controlled Release. 246, 98-109 (2017).
- Wang, X., et al. Enhanced anti-brain metastasis from non-small cell lung cancer of osimertinib and doxorubicin co-delivery targeted nanocarrier. International Journal of Nanomedicine. 15, 5491-5501 (2020).
- Gries, M., et al. Multiscale selectivity and in vivo biodistribution of NRP-1-targeted theranostic AGuIX nanoparticles for PDT of glioblastoma. International Journal of Nanomedicine. 15, 8739-8758 (2020).

