Bepaling van de Zeta Potentiële via nanodeeltjes Translocation Snelheden door een Tunable Nanopore: Met behulp van DNA-gemodificeerde deeltjes als een voorbeeld
Summary
Hier gebruiken we een polyurethaan afstembare nanopore geïntegreerd in een weerstandsbelasting puls detectie techniek nanodeeltjes oppervlaktechemie gekenmerkt via de meting van het translocatie snelheden, die kunnen worden gebruikt om het zeta potentieel van individuele nanodeeltjes bepalen.
Abstract
Nanopore technologieën, gezamenlijk bekend als resistieve pulssensoren (RPS), worden gebruikt voor het detecteren, kwantificeren en karakteriseren van eiwitten, moleculen en nanodeeltjes. Afstembare resistieve pulse sensing (TRPS) is een relatief recente aanpassing RPT dat een afstembare porie die kunnen worden gewijzigd in real time opgenomen. We gebruiken hier TRPS de translocatie tijden van DNA-gemodificeerde nanodeeltjes bewaken zijn bij het doorkruisen de afstembare porie membraan als functie van de DNA-concentratie en de structuur (dat wil zeggen enkelstrengs aan dubbelstrengs DNA).
TRPS is gebaseerd op twee Ag / AgCl-elektroden gescheiden door een elastomeer membraan porie dat een stabiele ionenstroom op een aangelegd elektrisch veld bepaalt. In tegenstelling tot diverse optische gebaseerde deeltjes karakterisering technologieën, kunnen TRPS individuele deeltjes te karakteriseren onder een steekproef bevolking, waardoor voor multimodaal monsters worden geanalyseerd met gemak. Hier tonen we zetapotentiaal metingendeeltje via translocatie snelheden van bekende standaarden en toepassen op analyt translocatie maal monster, hetgeen resulteert in de meting van de zeta-potentiaal van deze analyten.
Te verschaffen, om gemiddelde zeta potentiaal waarden worden de monsters allemaal gemeten onder toepassing van een deeltje per deeltje perspectief vertoont meer informatie over een bepaald monster door monster populatieverdelingen bijvoorbeeld. Van een dergelijke, deze methode toont potentieel binnen sensing toepassingen zowel medische en milieugebied voor.
Introduction
Gefunctionaliseerde nanodeeltjes worden steeds populairder als biosensoren zowel medische en milieu velden. Het vermogen om een nanodeeltje de oppervlaktechemie te veranderen, met DNA, bijvoorbeeld, is nuttig voor gerichte geneesmiddelafgiftesystemen 1 en controle DNA-eiwit interacties 2-4 blijkt. Een steeds vaker voorkomende nanodeeltjes pand wordt gebruikt in bioassays en in de levering van geneesmiddelen is superparamagnetisme 5. Superparamagnetische deeltjes (POD) zijn zeer bruikbaar bij het identificeren en verwijderen van specifieke analyten uit complexe mengsels en kan dit met de eenvoudige bediening van een enkele magneet. De verwijderde de analyt gebonden deeltjes kunnen worden gekarakteriseerd en geanalyseerd geschikt voor het doel.
Vorige methoden voor de detectie en karakterisering van nanodeeltjes omvatten optische technieken zoals dynamische lichtverstrooiing (DLS), alias fotoncorrelatiespectroscopie. Hoewel een high throughput techniek DLS beperkt tot zijnde een gemiddelde gebaseerde techniek en bij de analyse van multimodale monsters zonder toevoeging van gespecialiseerde software, zal de grotere deeltjes een meer dominante signaal te produceren, waardoor sommige van de kleinere deeltjes volledig onopgemerkt 6,7. Particle-by-deeltjes karakterisering technieken zijn daarom veel gunstiger voor nanodeeltjes en gefunctionaliseerde nanodeeltjes te analyseren.
RPS gebaseerde technologieën zijn gebaseerd op het aanleggen van een elektrisch veld aan een monster en controle op de transportmechanisme van de deeltjes door een synthetisch of biologisch nanopore. Een relatief recente nanodeeltjes detectie en typering techniek op basis van RPS is instelbaar resistieve pulse sensing (TRPS) 8-16. TRPS Twee-elektrodensysteem gescheiden door een elastomeer, afstembare membraan poriën. Afstembaar porie werkwijze maakt analyten verschillende vorm 17 en afmetingen te meten via de transpoort mechanismen door de porie. Afstembare poriën zijn eerder gebruikt voor de detectie van kleine deeltjes (70-95 nm diameter) produceren vergelijkbare resultaten met andere technieken zoals transmissie elektronen spectroscopie (TEM) 10. Wanneer een elektrisch veld wordt toegepast, wordt een ionenstroom waargenomen en als deeltjes / moleculen door de poriën passeren, zij tijdelijk de poriën blokkeren, waardoor een verlaging van de stroom die kan worden gedefinieerd als een "blokkade event. Elke blokkade gebeurtenis representeert een enkel deeltje zodat elk deeltje in een monster afzonderlijk kenmerk kan worden gebaseerd op de blokkade magnitude, Δ 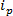 En volle breedte half maximum, FWHM, evenals andere eigenschappen blokkade. Het analyseren van individuele deeltjes als ze door een nanogaatje passeren is voordelig voor multimodaal monsters als TRPS succesvol en effectief een bereik kan onderscheiden van deeltjesgrootte AmonGST een enkel monster. Tunable resistieve pulse sensing voltooit maat 10, zetapotentiaal 12,18 en concentratie 15 metingen tegelijk in een enkele run en kan dus nog differentiëren monsters van soortgelijke, zo niet dezelfde grootte van hun oppervlakte lading 19; een voordeel ten opzichte van alternatieve dimensionering technieken.
En volle breedte half maximum, FWHM, evenals andere eigenschappen blokkade. Het analyseren van individuele deeltjes als ze door een nanogaatje passeren is voordelig voor multimodaal monsters als TRPS succesvol en effectief een bereik kan onderscheiden van deeltjesgrootte AmonGST een enkel monster. Tunable resistieve pulse sensing voltooit maat 10, zetapotentiaal 12,18 en concentratie 15 metingen tegelijk in een enkele run en kan dus nog differentiëren monsters van soortgelijke, zo niet dezelfde grootte van hun oppervlakte lading 19; een voordeel ten opzichte van alternatieve dimensionering technieken.
Zeta potentieel wordt gedefinieerd als de elektrostatische potentiaal op het vlak van afschuiving 20, en wordt berekend uit deeltjessnelheden mocht steken een porie 19. Zeta potentiaal metingen van afzonderlijke geeft dus inzicht in de mechanismen translocatie en het gedrag van nanodeeltjes systemen in oplossing waardevolle informatie voor de toekomst van nanodeeltjes test ontwerpen voor verschillende toepassingen. Deeltje per deeltje analyse van dergelijke aard maakt ook de verspreiding en verspreiding van zeta potentiaal waarden bij een steekproef worden onderzocht, waardoor meer informatie on reactiekinetiek (enkelstrengs aan dubbelstrengs DNA, bijvoorbeeld) en deeltjes stabiliteiten in oplossing te bereiken.
We beschrijven een techniek die detecteert en kenmerkend zowel ongemodificeerde en gemodificeerde DNA-SPP oppervlakken. De hierin beschreven protocol is toepasbaar op een reeks van anorganische en biologische nanodeeltjes, maar we tonen de procedure via DNA-gemodificeerde oppervlakken vanwege hun breed toepassingsgebied. De techniek kan de gebruiker onderscheid tussen enkelstrengs en dubbelstrengs DNA doelen op een nanodeeltje oppervlak, gebaseerd op deeltjes translocatie snelheden door een poriënsysteem en zo hun zeta potentieel.
Protocol
Representative Results
Discussion
De berekening van de zeta potentiaal gebruikt kalibratie gebaseerde methode gerelateerd werk door Arjmandi et al. 21. De duur van de translocatie deeltjes zijn bij het doorkruisen een nanopore wordt gemeten als een functie van aangelegde spanning, met een gemiddelde elektrisch veld en deeltjessnelheden op het geheel van een regelmatige conische porie. De elektroforetische mobiliteit is de afgeleide van 1 / T (waarin T de duur blokkade) ten opzichte van spanning, vermenigvuldigd met het kwadraat…
Divulgations
The authors have nothing to disclose.
Acknowledgements
De auteurs danken Izon Science Ltd voor hun steun. Het werk werd gesteund door de Europese Commissie voor onderzoek (PCIG11-GA-2012-321836 Nano4Bio).
Materials
| Phosphate buffered Saline (PBS) | Sigma Aldrich, UK | P4417 | 1 tablet dissolved in 200 mL deionised water to make buffer solution. |
| Tween-20 | Sigma Aldrich, UK | P1379 | 0.05% (v/v) in PBS buffer as a surfactant |
| Carboxyl polystyrene nanoparticles | Bangs Laboratories, US | CPC200 | Nominal diamter of 220 nm, raw concentration of 1E12 particles/mL, specific surface charge of 86 µeq/g (equivalent to a surface charge density of 3.2E19 C/nm^2. |
| Streptavidin coated nanoparticles | Ademtech, France | 3121 | Batch had binding capacity of 4352 pmol/mg (188 nM theoretical DNA binding capacity) at a raw concentration of 1.1E11 particles/mL. |
| Biotinylated oligonucleotides | Sigma Aldrich, UK | VC00001 | Supplier spec: Reverse Phase 1 purification (0.05 Scale); Biotin modification at 3' end; Lyophilised powders reconstituted to 100 µM using deionised water, and diluted as required. Sequences: CP 5'ATGGTTAAACCTCAC TACGCGTGGC[Btn]3' |
| Standard olignonucleotides | Sigma Aldrich, UK | VC00001 | Supplier spec: Reverse Phase 1 purification (0.05 Scale); Lyophilised powders reconstituted to 100 µM using deionised water, and diluted as required. Sequences of DNA targets: Fully complementary – 5'GCCACGCGTAGTGAGGTTTAACCAT3', Middle binding – 5'GTAGTGAGGT3', End binding – 5'GTTTAACCAT3', Partially complementary overhanging – 5'GTGAGGTTTAACCAT TTTTTTTTTTTTTTT3'. |
| Izon qNano | Izon Science, NZ | Inherent pressure on system of 47 Pa, | |
| Izon Variable Pressure Module (VPM) | Izon Science, NZ | Each 'cm' of pressure is equivalent to approximately 1000 Pa. | |
| Polyurethane nanopore membranes | Izon Science, NZ | NP150 | Analyte size range 60-480 nm, pore diameter of calculated to be 799 nm at a 45 mm stretch. |
| Magrack 6 | GE Healthcare, UK | 28-9489-64 | |
| Sonic Bath | Fisher Scientific, UK | 10692353 | 80 Watts |
| Vortexer | IKA, Germany | 0003365000 | |
| Rotary Wheel | Labnet International, US | H5500-230 V |
References
- Alexander, C. M., Maye, M. M., Dabrowiak, J. C. DNA-capped nanoparticles designed for doxorubicin drug delivery. Chem Commun. 47 (12), 3418-3420 (2011).
- Billinge, E. R., Platt, M. Aptamer based dispersion assay using tunable resistive pulse sensing (TRPS). Anal Methods. 7 (20), 8534-8538 (2015).
- Bulyk, M. L. Protein Binding Microarrays for the Characterization of Protein-DNA Interactions. Adv Biochem Eng Biotechnol. 104, 65-85 (2007).
- Platt, M., Rowe, W., Knowles, J., Day, P. J., Kell, D. B. Analysis of aptamer sequence activity relationships. Integr Biol. 1 (1), 116-122 (2009).
- Ruiz-Hernández, E., Baeza, A., Vallet-Regí, M. Smart Drug Delivery through DNA/Magnetic Nanoparticle Gates. ACS Nano. 5 (2), 1259-1266 (2011).
- Murdock, R. C., Braydich-stolle, L., Schrand, A. M., Schlager, J. J., Hussain, S. M. Characterization of Nanomaterial Dispersion in Solution Prior to In Vitro Exposure Using Dynamic Light Scattering Technique. Toxicol Sci. 101 (2), 239-253 (2008).
- Hupfield, S., Holsaeter, A. M., Skar, M., Frantzen, C. B., Brandl, M. Liposome size analysis by dynamic/static light scattering upon size exclusion-/field flow fractionation. J Nanosci Nanotechnol. 6 (7), 3025-3031 (2006).
- Roberts, G. S., et al. Tunable pores for measuring concentrations of synthetic and biological nanoparticle dispersions. Biosens Bioelectron. 31 (1), 17-25 (2012).
- Roberts, G. S., Kozak, D., Anderson, W., Broom, M. F., Vogel, R., Trau, M. Tunable nano/micropores for particle detection and discrimination: scanning ion occlusion spectroscopy. Small. 6 (23), 2653-2658 (2010).
- Vogel, R., et al. Quantitative sizing of nano/microparticles with a tunable elastomeric pore sensor. Anal Chem. 83 (9), 3499-3506 (2011).
- Booth, M. A., Vogel, R., Curran, J. M., Harbison, S., Travas-Sejdic, J. Detection of target-probe oligonucleotide hybridization using synthetic nanopore resistive pulse sensing. Biosens Bioelectron. 45, 136-140 (2013).
- Kozak, D., Anderson, W., Vogel, R., Chen, S. Simultaneous size and ζ-potential measurements of individual nanoparticles in dispersion using size-tunable pore sensors. ACS Nano. 6 (8), 6990-6997 (2012).
- Kozak, D., Anderson, W., Vogel, R., Trau, M. Advances in Resistive Pulse Sensors: Devices bridging the void between molecular and microscopic detection. Nano Today. 6 (5), 531-545 (2011).
- Weatherall, E., Willmott, G. R. Applications of tunable resistive pulse sensing. Analyst. 140, 3318-3334 (2015).
- Willmott, G. R., et al. Use of tunable nanopore blockade rates to investigate colloidal dispersions. J Phys Condens Matter. 22 (45), 454116 (2010).
- Blundell, E. L. C. J., Mayne, L. J., Billinge, E. R., Platt, M. Emergence of tunable resistive pulse sensing as a biosensor. Anal Methods. 7, 7055-7066 (2015).
- Platt, M., Willmott, G. R., Lee, G. U. Resistive Pulse Sensing of Analyte-Induced Multicomponent Rod Aggregation Using Tunable Pores. Small. 8 (15), 2436-2444 (2012).
- Vogel, R., Anderson, W., Eldridge, J., Glossop, B., Willmott, G. A variable pressure method for characterizing nanoparticle surface charge using pore sensors. Anal Chem. 84 (7), 3125-3131 (2012).
- Blundell, E. L. C. J., Vogel, R., Platt, M. Particle-by-Particle Charge Analysis of DNA-Modified Nanoparticles Using Tunable Resistive Pulse Sensing. Langmuir. 32 (4), (2016).
- Hunter, R. J. . Zeta Potential in Colloid Science: Principles and Applications. , (1981).
- Arjmandi, N., Van Roy, W., Lagae, L., Borghs, G. Measuring the electric charge and zeta potential of nanometer-sized objects using pyramidal-shaped nanopores. Anal Chem. 84 (20), 8490-8496 (2012).
- Bacri, L., et al. Dynamics of colloids in single solid-state nanopores. J Phys Chem B. 115 (12), 2890-2898 (2011).
- Cabello-Aguilar, S., et al. Dynamics of polymer nanoparticles through a single artificial nanopore with a high-aspect-ratio. Soft Matter. 10 (42), 8413-8419 (2014).
- Billinge, E. R., Muzard, J., Platt, M. Tunable resistive pulse sensing as a tool to monitor analyte induced particle aggregation. Nanomater Nanosci. 1 (1), 11 (2013).
- Li, J., Fan, C., Pei, H., Shi, J., Huang, Q. Smart Drug Delivery Nanocarriers with Self-Assembled DNA Nanostructures. Adv Mater. 25 (32), 4386-4396 (2013).
- Billinge, E. R., Broom, M., Platt, M. Monitoring aptamer-protein interactions using tunable resistive pulse sensing. Anal Chem. 86 (2), 1030-1037 (2014).
- Gold, L., et al. Aptamer-Based Multiplexed Proteomic Technology for Biomarker Discovery. PLoS One. 5 (12), e15004 (2010).
- Park, S. -. J., Taton, T. A., Mirkin, C. A. Array-Based Electrical Detection of DNA with Nanoparticle Probes. Science. 295 (5559), 1503-1506 (2002).

