hypergepolariseerde<sup> 13</sup> C Metabolic magnetische resonantie spectroscopie en beeldvorming
Summary
Dynamic nuclear polarization with subsequent sample dissolution has enabled real-time studies of metabolism in biological systems. Hyperpolarized [1-13C]pyruvate was used to study lactate dehydrogenase activity in a prostate carcinoma cell line in vitro.
Abstract
In de afgelopen decennia, nieuwe methoden voor tumor staging, restaging, de behandeling respons monitoring, en herhaling detectie van een verscheidenheid van kanker naar voren zijn gekomen in samenwerking met de positron emissie tomografie state-of-the-art met 18 F-fluorodeoxyglucose ([18 F ] -FDG PET). 13 C spectroscopische magnetische resonantie imaging (13 CMRSI) een minimaal invasieve imaging methode die de controle van metabolisme in vivo en in real time mogelijk maakt. Zoals met elk ander procédé gebaseerd op 13C kernmagnetische resonantie (NMR), is de uitdaging lage thermische polarisatie en een daaropvolgende lage signaal-ruisverhouding als gevolg van de relatief lage gyromagnetische verhouding van 13 C en een lage natuurlijke overvloed in biologische monsters. Door het overwinnen van deze beperkingen is dynamische nucleaire polarisatie (DNP) gevolgd monster dissolutie kort ingeschakeld gebruikte NMR en magnetische resonantie imaging (MRI) systemen meten, Studie, en het belangrijkste metabole routes in verschillende biologische systemen. Een bijzonder interessante en veelbelovende molecule gebruikt 13 CMRSI is [1- 13 C] pyruvaat, die in de afgelopen tien jaar, is op grote schaal meer recent toegepast voor in vitro, preklinische en klinische studies naar het cellulaire energiemetabolisme onderzoeken bij kanker en andere ziekten. In dit artikel schetsen we de techniek van ontbinding DNP gebruik van een 3,35 T preklinische DNP hyper- en demonstreren het gebruik ervan in in vitro studies. Een soortgelijk protocol voor hyperpolarisatie worden toegepast voor het grootste deel in vivo studies ook. Hiervoor gebruikten we lactaat dehydrogenase (LDH) gekatalyseerde en de metabolische omzetting van [1- 13 C] pyruvaat om [1- 13 C] lactaat in een prostaatcarcinoom cellijn, PC3, in vitro gebruik 13 CMRSI.
Introduction
Momenteel is de meest gebruikte werkwijze voor klinische stagering, restaging behandeling aanspreekbewaking en herhaling detectie van diverse kankers [18 F] -FDG PET. 1 Echter, onlangs, een aantal nieuwe en alternatieve benaderingen naar voren zijn gekomen. Een van die methodes is 13 CMRSI. Deze techniek houdt de invoering van de 13 C-molecuul in een biologisch monster, gevolgd door minimaal invasieve MRI om het metabolisme te beoordelen in vitro of in vivo in real time. Toch is de grootste uitdaging van 13 CMRSI, vergeleken met andere methoden zoals [18 F] -FDG PET of computertomografie, is de lage signaal-ruisverhouding.
Het NMR-signaal is recht evenredig met de mate van polarisatie, een verhouding van de spin ½ kernen verschil populatie in twee energietoestanden de totale populatie (Figuur 1A). De polarisatie is een product van the gyromagnetische verhouding (γ) van de kernen en het aangelegde magnetische veldsterkte over de temperatuur. Een typische polarisatie van 1 H kernen in de orde van 0,001% tot 0,005% in 3 T, dat een relatief slechte signaal-ruisverhouding geeft. De huidige state-of-the-art MRI is een succesvolle beeldvormingstechniek is alleen door de grote dichtheid van 1 H in biologische monsters en de hoge gyromagnetische verhouding van 1 H (y 1H = 42,576 MHz / T). Echter, het waarnemen andere kernen, zoals koolstof, is veeleisender. De enige stabiele, magnetisch actieve kool isotoop 13 C, vertegenwoordigt slechts 1,1% van alle koolstofatomen. Bovendien, de gyromagnetische verhouding van 13 C (13C γ = 10,705 MHz / T) vier maal lager dan die van 1H, wat leidt tot een lagere detectie-efficiëntie. Samengevat, de lage 13 dichtheid en lage C γ 13C veroorzaken thermische 13 C gemeten tot 0,0176% van de gevoeligheid van een 1 bereikenH-NMR meting in vivo.
Dynamic Nuclear Polarisatie
Werkwijze voor de relatief lage sensitiviteit van 13 C gemeten overwinnen is DNP. Het werd oorspronkelijk beschreven metalen in 1953 van Albert W. Overhauser. In zijn artikel, verklaarde hij: "Het is aangetoond dat als de electron spin resonantie van de geleidingselektronen verzadigd, de kernen worden gepolariseerd in dezelfde mate ze zouden zijn als de gyromagnetische verhouding waren die van het electron spin." 2 later dat jaar, Carver en Slichter experimenteel bevestigd Overhauser hypothese 3. In 1958, Abragam en Proctor beschreef dit effect voor elektronen in vloeistoffen en noemde het de "vaste-effect." Bij temperaturen onder 4 K, electron spin polarisatie bereikt bijna 100% en meer dan drie ordes van grootte hoger dan de kern-spin polarisatie (Figuur 1B) 4. Thij treedt op omdat de gyromagnetische verhouding van het elektron (e γ = 28024,944 MHz / T) is drie ordes van grootte hoger dan de nucleaire gyromagnetische verhouding. De zwakke wisselwerking tussen elektronen en kernen, zoals het Overhauser effect, het vaste zin crosseffect en de thermische mengwerking kan de overdracht van polarisatie van elektronspins naar kernspins via microgolfbestraling met een frequentie nabij de overeenkomstige elektron paramagnetische resonantie (EPR) frequentie 5,6. DNP theorie is verder ontwikkeld om meer elektronen en thermische mengen omvatten. Niettemin, tot op heden geen uniforme kwantitatieve theoretische beschrijving van DNP is gepubliceerd 7,8.
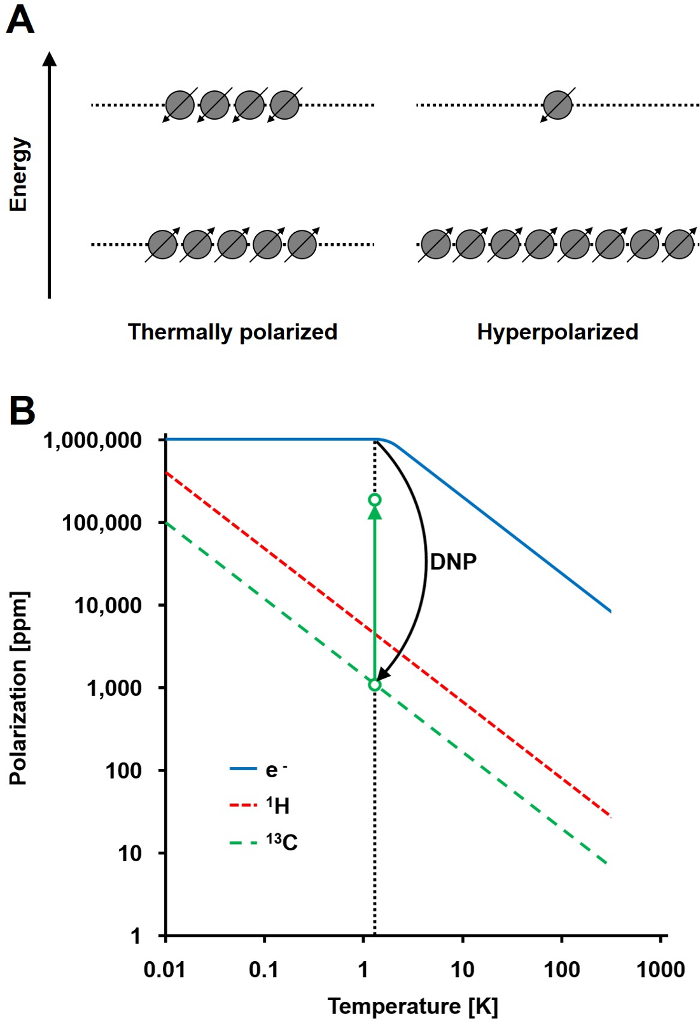
Figuur 1: Het begrijpen van Dynamic Nuclear Polarisatie en hyperpolarisatie. A) Een schematische vergelijking van de spin bevolkingin het thermisch evenwicht polarisatietoestand en het hypergepolariseerde toestand. B) De polarisatie is afhankelijk van de temperatuur. De polarisatie van een elektron (e -) bereikt 100% onder 1,4 K. De DNP voor de overdracht van de polarisatie van de e naar de 13 C kernen, die de polarisatie tot 10 5 voudig verhoogt. Klik hier om een grotere versie van deze figuur te bekijken.
DNP introduceren in studies van biologische systemen gebruik 13 C NMR had daaropvolgende snelle dissolutie monster te ontwikkelen. 50 jaar na Overhauser hypothese, Jan H. Ardenkjaer-Larsen et al. loste het technisch uitdagende kwestie van het brengen van het hypergepolariseerde bevroren monster in vloeibare toestand met een minimaal verlies hyperpolarisatie 6. Ontbinding DNP opende een nieuw onderzoeksgebied genaamd 13 CMRSIk, het verstrekken van een nieuwe methode om te onderzoeken en te karakteriseren verschillende ziektebeelden 9,10. Zo stabiel dragers van een ongepaard elektron, een trityl groep tris (8-carboxy-2,2,6,6-tetra (hydroxyethyl) benzo [1,2-4,5] -bis- (1,3) -dithiole-4-yl) -methyl natriumzout (OX063) of (2,2,6,6-tetramethylpiperidine-1-yl) oxyl (TEMPO) wordt meestal gebruikt. Deze zijn gemengd met de gewenste 13-gelabeld molecuul en blootgesteld aan bestraling met microgolven met een frequentie nabij de overeenkomstige EPR frequentie. Met deze techniek kan de polarisatie van 13 C kernen worden verhoogd tot 37% 11. Dit resulteert in een 10-voudige 5 verhoging polarisatie ten opzichte van de thermisch evenwicht polarisatie 11,12. Echter, zodra de microgolfstraling wordt gestopt en / of de 13 C-molecuul naar de vloeibare toestand, de polarisatie vervalt onder longitudinale relaxatietijd (T1) van de 13 C kern die is gepolariseerd. Dus deuitvinding van de snelle ontbinding technieken of elke latere techniek het verkorten van de tijd voordat de experimentele meting (dwz injectie) is cruciaal voor biologische toepassingen 13.
Er zijn drie belangrijke eisen waaraan de kandidaat molecuul moet voldoen voor een succesvolle 13 CMRSI studies. Ten eerste, de 13 C kern plaats moet een voldoende lange t 1 (> 10 s) hebben. De keuze van de 13 C-label is cruciaal. De beste kandidaat kernen zijn koolstoffen zonder direct contact met 1 H-kernen via een obligatie. Het moet ook snel worden gemetaboliseerd binnen 2-3 T 1 keer, wat resulteert in een stroomafwaarts metaboliet met een significant verschillende chemische verschuiving van de oorspronkelijke stof. Het monstermengsel moeten ook een amorf glas als in vaste toestand, zodat de ruimtelijke verdeling vermindert de afstand tussen het elektron en 13 C, waardoor de transfer polarisatie. Indien de kandidaat molecuul amorf glas niet van nature vormt, moet goed oplosbaar in een glassing middel, zoals glycerol of dimethylsulfoxide 14 worden. Deze eisen leiden tot een relatief klein aantal kandidaat moleculen. Maar zelfs na de succesvolle ontdekking van een geschikt molecuul, het ontwikkelen van een werkende protocol voor hyperpolarisatie kan technisch uitdagend 9,14,15 zijn.
De laatste jaren hebben verschillende substraten succes gepolariseerd zijn, zoals [1- 13 C] pyruvaat 12,16 – 36, [2- 13 C] pyruvaat 37 [1- 13 C] ethyl pyruvaat 38 [1- 13 C ] 39 lactaat, [1- 13 C] fumaraat 40-43, 13 C-bicarbonaat 36,44,45, [1- 13 C] natriumacetaat 43,46 – 49, 13 C-ureum 6,36,50,51 , [5- 13 C] glutamine 15,52,53, [1- 13 C] glutamaat 53,54 [1- 13 C] 2-oxoglutaraat 55 [1- 13 C] alanine en anderen 14,56. Een bijzonder interessante en meest gebruikte substraat voor hyperpolarisatie is [1- 13 C] pyruvaat. Het wordt veel gebruikt in preklinische studies om de cellulaire energie-metabolisme in verschillende ziekten 14,17,22 te onderzoeken. [1- 13 C] pyruvaat voldoet aan alle eisen voor een succesvolle hyperpolarisatie, met inbegrip van een relatief lange T 1 en snel transport over de celmembraan alvorens vervolgens wordt gemetaboliseerd. Preklinische studies met [1- 13 C] pyruvaat worden momenteel vertaald in de kliniek 57.
Stofwisseling van pyruvaat
Het is bekend dat er een rechtstreeks verband tussen mutaties in DNA en veranderingen in hun metabole routes kanker cellen. Reeds in de jaren 1920, Otto Warburg Discovuitgegaan dat er een verhoogd metabolisme van glucose en de productie van lactaat in tumoren in vergelijking met gezond weefsel 58-60. Vervolgens verschillende afwisselingen in andere metabole routes, zoals de pentose-fosfaat route, de citroenzuurcyclus, oxidatieve fosforylering en de synthese van nucleotiden en lipiden, zijn beschreven.
Pyruvaat is het eindproduct van glycolyse. In de tumor ondergaat anaërobe glycolyse gekatalyseerd door LDH 61 en reageert met de gereduceerde vorm van het co-enzym nicotinamide adenine dinucleotide (NADH), waardoor lactaat en de geoxideerde vorm van co-enzym (NAD +). Alternatief pyruvaat ondergaat transamineringsreaktie reactie met glutamaat alanine te vormen, gekatalyseerd door alanine transaminase (ALT). Beide reacties zijn gemakkelijk omkeerbaar. Pyruvaat ondergaat gekatalyseerd door decarboxylering pyruvaat dehydrogenase (PDH) kooldioxide en acetyl-CoA, representing een irreversibele reactie bij deze stap. Afwisselingen in deze reactiesnelheden kunnen worden gekoppeld aan tumormetabolisme 17,21,22,25,62. De metabole route zijn in figuur 2.

Figuur 2: Schematische weergave van de belangrijkste metabole reactie van pyruvaat. Pyruvaat / lactaat omzetting wordt gekatalyseerd door LDH en pyruvaat / alanine omzetting wordt gekatalyseerd door ALT. Pyruvaat is irreversibel omgezet in acetyl-CoA en CO 2 door PDH en CO 2 in een pH-afhankelijke evenwicht met bicarbonaat 80. Klik hier om een grotere versie van deze figuur te bekijken.
De detectie van gehyperpolariseerde [1- 13 C] pyruvaat en zijn metabolieten is eerder aangetoond in de rat hijart 37,63 – 65, 66 lever, spieren en nieren 62,67. Een studie toonde significante verschillen in de lactaat-to-alanine verhouding tussen de normale en vastten rattenlever en 66 vertoonden een zeer verhoogde en gehyperpolariseerde [1- 13 C] lactaat niveau leverkanker 68,69. Er zijn aanwijzingen dat de tumor rang kunnen worden geïdentificeerd in een transgene adenocarcinoom van muizen prostaatkanker (TRAMP) middels gehyperpolariseerde [1- 13 C] pyruvaat 22, met het gehyperpolariseerde lactaat niveaus die een hoge correlatie met de histologische graad van de tumoren uitgesneden. De alanine gekatalyseerd van pyruvaat door ALT is ook gesuggereerd als een bruikbare marker in ratten leverkanker 23.
Meten van de pyruvaat-lactaat metabole flux is gebruikt voor de monitoring ischemie 63,65,70 en als reactie op behandeling met cytotoxische chemotherapie 17,40, gerichte geneesmiddelen <sup> 24,25,41, of radiotherapie 26 in diermodellen. Het is ook gebruikt voor de detectie van de fosfatidylinositol 3-kinase (PI3K) remmer LY294002 reactie in glioblastoma en borstkanker muismodellen 25. Veranderingen in pyruvaatstofwisseling in hersentumoren 26 en prostaatkanker 24,71 zijn eveneens waargenomen na behandeling.
prostaatcarcinoom
Prostaatcarcinoom is de belangrijkste kanker bij oudere mannen en de tweede belangrijkste kanker gerelateerde dood bij mannen wereldwijd 72. Tot op heden zijn geen betrouwbare, niet-invasieve methoden beschikbaar voor een vroege diagnose en typering van prostaatkanker 73,74, met nadruk op de dringende behoefte aan nieuwe metabole beeldvormende technieken aan strenge opsporing en enscenering van de patiënten mogelijk te maken. Prostaatcarcinoom werd gebruikt als een model om de mogelijkheden van ontbinding DNP in combinatie met 13 CMRSI in de patiënt aan te tonens 57. Dit werk werd voortgezet in een eerste klinische studie in dienst [1- 13 C] pyruvaat en 13 CMRSI voor de beeldvorming van prostaatkanker, en het heeft onlangs is afgerond (NCT01229618).
De motivatie achter dit werk was om te illustreren in meer detail en voor een breder publiek de toepassing van de 13 CMRSI methode in een preklinische omgeving met cellen. Het meten van de LDH-gekatalyseerde metabolisme van [1- 13 C] pyruvaat om [1- 13 C] lactaat in vitro in de PC3 prostaatcarcinoom cellijn, tonen we de mogelijke toepassing van ontbinding DNP in in vitro studies en het adres van de cruciale stappen en uitdagingen tijdens de experimenten.
Protocol
Representative Results
Discussion
13 CMRSI met gehyperpolariseerde probes is een veelbelovende methode om metabolisme in real time in vitro en in vivo. Een belangrijk aspect bij toepassing van deze experimentele werkwijze is de juiste normalisatie, met name wat betreft in vitro experimenten. Ten eerste, de voorbereiding van het monster moet behoren en consistent worden gedaan met dezelfde concentratie gehyperpolariseerd materiaal bereiken elk experiment. Dit vereist een nauwkeurige weging van zowel het monster gehyp…
Divulgations
The authors have nothing to disclose.
Acknowledgements
E.K. gratefully acknowledges the support of the Graduate School of Bioengineering (GSB) at Technische Universität München. This work was supported by the German Research Foundation (DFG) within the SFB Collaborative Research Center 824, “Imaging for Selection, Monitoring, and Individualization of Cancer Therapies.”
Materials
| HyperSense DNP Polariser | Oxford Instruments | 3.35 T preclinical DNP hyperpolarizer | |
| GE/Agilent MR901 | GE Healthcare/Agilent Technologies | 7 T preclinical MRI scanner, with small bore designed for experiments onrodent | |
| Spinsolve Carbon | Magritek | 1 T NMR spectrometer with permanent magnet | |
| Deuterium Oxide | Sigma Aldrich | 7789-20-0 | |
| Sodium phosphate dibasic | Sigma Aldrich | 7558-79-4 | |
| Sodium phosphate monbasic | Sigma Aldrich | 7558-80-7 | |
| Sodium hydroxide | Sigma Aldrich | 1310-73-2 | |
| Disodium edetate | Sigma Aldrich | 6381-92-6 | |
| Pyruvic acid – 13C1 | Cambridge Isotopes Laboratories | CLM-8077-1 | |
| Dotarem (0.5 mmol/L) | Guerbet | gadoterate meglumine | |
| tris (8-carboxy-2,2,6,6-tetra-(hydroxyethyl)-benzo-[1,2–4,5]-bis-(1,3)-dithiole-4-yl)-methyl sodium salt (OX063) | GE Healthcare | trityl radical used as a sourse of free electron | |
| PC3 cell line | ATCC | CRL1435 | |
| F-12K medium | ATCC | 30-2004 | |
| Fetal Bovine Serum | ATCC | SCRR-30-2020 | |
| Trypsine-EDTA Solution, 1X | ATCC | 30-2101 | |
| Sample plastic cup | Oxford Instruments | ||
| Trypan blue | Bio-Rad | 145-0013-MSDS |
References
- Rohren, E. M., Turkington, T. G., Coleman, R. E. Clinical applications of PET in oncology. Radiology. 231 (2), 305-332 (2004).
- Overhauser, A. W. Polarization of Nuclei in Metals. Phys. Rev. 92 (2), 411-415 (1953).
- Carver, T. R., Slichter, C. P. Polarization of Nuclear Spins in Metals. Phys. Rev. 92 (1), 212-213 (1953).
- Abragam, A., Proctor, W. G. Spin Temperature. Phys. Rev. 109 (5), 1441-1458 (1958).
- Abragam, a., Goldman, M. Principles of dynamic nuclear polarisation. Reports Prog. Phys. 41 (3), 395-467 (2001).
- Ardenkjaer-Larsen, J. H., Fridlund, B., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10158-10163 (2003).
- Shimon, D., Hovav, Y., Feintuch, A., Goldfarb, D., Vega, S. Dynamic nuclear polarization in the solid state: a transition between the cross effect and the solid effect. Phys. Chem. Chem. Phys. 14 (16), 5729-5743 (2012).
- Serra, S. C., Rosso, A., Tedoldi, F. Electron and nuclear spin dynamics in the thermal mixing model of dynamic nuclear polarization. Phys. Chem. Chem. Phys. 14 (38), 13299-13308 (2012).
- Gallagher, F. A., Kettunen, M. I., Brindle, K. M. Biomedical applications of hyperpolarized 13C magnetic resonance imaging. Prog. Nucl. Magn. Reson. Spectrosc. 55 (4), 285-295 (2009).
- Hurd, R. E., Yen, Y. -. F., Chen, A., Ardenkjaer-Larsen, J. H. Hyperpolarized 13C metabolic imaging using dissolution dynamic nuclear polarization. J. Magn. Reson. Imaging. 36 (6), 1314-1328 (2012).
- Ardenkjaer-Larsen, J. H., Fridlund, B., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10158-10163 (2003).
- Golman, K., in’t Zandt, R., Thaning, M. Real-time metabolic imaging. Proc. Natl. Acad. Sci. 103 (30), 11270-11275 (2006).
- Comment, A., Rentsch, J., et al. Producing over 100 ml of highly concentrated hyperpolarized solution by means of dissolution DNP. J. Magn. Reson. 194 (1), 152-155 (2008).
- Brindle, K. M., Bohndiek, S. E., Gallagher, F. A., Kettunen, M. I. Tumor imaging using hyperpolarized 13C magnetic resonance spectroscopy. Magn. Reson. Med. 66 (2), 505-519 (2011).
- Gallagher, F. A., Kettunen, M. I., Day, S. E., Lerche, M., Brindle, K. M. 13C MR spectroscopy measurements of glutaminase activity in human hepatocellular carcinoma cells using hyperpolarized 13C-labeled glutamine. Magn. Reson. Med. 60 (2), 253-257 (2008).
- Chen, A. P., Albers, M. J., et al. Hyperpolarized C-13 spectroscopic imaging of the TRAMP mouse at 3T-initial experience. Magn. Reson. Med. 58 (6), 1099-1106 (2007).
- Day, S. E., Kettunen, M. I., et al. Detecting tumor response to treatment using hyperpolarized 13C magnetic resonance imaging and spectroscopy. Nat. Med. 13 (11), 1382-1387 (2007).
- Schroeder, M. A., Swietach, P., et al. Measuring intracellular pH in the heart using hyperpolarized carbon dioxide and bicarbonate: a 13C and 31P magnetic resonance spectroscopy study. Cardiovasc. Res. 86 (1), 82-91 (2010).
- Hurd, R. E., Yen, Y. -. F., Tropp, J., Pfefferbaum, A., Spielman, D. M., Mayer, D. Cerebral dynamics and metabolism of hyperpolarized [1-(13)C]pyruvate using time-resolved MR spectroscopic imaging. J. Cereb. Blood Flow Metab. 30 (13), 1734-1741 (2010).
- Golman, K., Zandt, R. I., Lerche, M., Pehrson, R., Ardenkjaer-Larsen, J. H. Metabolic imaging by hyperpolarized 13C magnetic resonance imaging for in vivo tumor diagnosis. Cancer Res. 66 (22), 10855-10860 (2006).
- Park, I., Larson, P. E. Z., et al. Hyperpolarized 13C magnetic resonance metabolic imaging: application to brain tumors. Neuro. Oncol. 12 (2), 133-144 (2010).
- Albers, M. J., Bok, R., et al. Hyperpolarized 13C lactate, pyruvate, and alanine: noninvasive biomarkers for prostate cancer detection and grading. Cancer Res. 68 (20), 8607-8615 (2008).
- Yen, Y. -. F., Le Roux, P., et al. T(2) relaxation times of (13)C metabolites in a rat hepatocellular carcinoma model measured in vivo using (13)C-MRS of hyperpolarized [1-(13)C]pyruvate. NMR Biomed. 23 (4), 414-423 (2010).
- Dafni, H., Larson, P. E. Z., et al. Hyperpolarized 13C spectroscopic imaging informs on hypoxia-inducible factor-1 and myc activity downstream of platelet-derived growth factor receptor. Cancer Res. 70 (19), 7400-7410 (2010).
- Ward, C. S., Venkatesh, H. S., et al. Noninvasive detection of target modulation following phosphatidylinositol 3-kinase inhibition using hyperpolarized 13C magnetic resonance spectroscopy. Cancer Res. 70 (4), 1296-1305 (2010).
- Day, S. E., Kettunen, M. I., et al. Detecting response of rat C6 glioma tumors to radiotherapy using hyperpolarized [1- 13C]pyruvate and 13C magnetic resonance spectroscopic imaging. Magn. Reson. Med. 65 (2), 557-563 (2011).
- Johannesson, H., Macholl, S., Ardenkjaer-Larsen, J. H. Dynamic Nuclear Polarization of [1-13C]pyruvic acid at 4.6 tesla. J. Magn. Reson. 197 (2), 167-175 (2009).
- Durst, M., Koellisch, U., et al. Bolus tracking for improved metabolic imaging of hyperpolarised compounds. J. Magn. Reson. 243, 40-46 (2014).
- Khegai, O., Schulte, R. F., et al. Apparent rate constant mapping using hyperpolarized [1-(13)C]pyruvate. NMR Biomed. 27 (10), 1256-1265 (2014).
- Sogaard, L. V., Schilling, F., Janich, M. A., Menzel, M. I., Ardenkjaer-Larsen, J. H. In vivo measurement of apparent diffusion coefficients of hyperpolarized (1)(3)C-labeled metabolites. NMR Biomed. 27 (5), 561-569 (2014).
- Aquaro, G. D., Frijia, F., et al. 3D CMR mapping of metabolism by hyperpolarized 13C-pyruvate in ischemia-reperfusion. JACC. Cardiovasc. Imaging. 6 (6), 743-744 (2013).
- Menzel, M. I., Farrell, E. V., et al. Multimodal assessment of in vivo metabolism with hyperpolarized [1-13C]MR spectroscopy and 18F-FDG PET imaging in hepatocellular carcinoma tumor-bearing rats. J. Nucl. Med. 54 (7), 1113-1119 (2013).
- Schilling, F., Duwel, S., et al. Diffusion of hyperpolarized (13) C-metabolites in tumor cell spheroids using real-time NMR spectroscopy. NMR Biomed. 26 (5), 557-568 (2013).
- Schulte, R. F., Sperl, J. I., et al. Saturation-recovery metabolic-exchange rate imaging with hyperpolarized [1-13C] pyruvate using spectral-spatial excitation. Magn. Reson. Med. 69 (5), 1209-1216 (2013).
- Wiesinger, F., Weidl, E., et al. IDEAL spiral CSI for dynamic metabolic MR imaging of hyperpolarized [1-13C]pyruvate. Magn. Reson. Med. 68 (1), 8-16 (2012).
- Wilson, D. M., Keshari, K. R., et al. Multi-compound polarization by DNP allows simultaneous assessment of multiple enzymatic activities in vivo. J. Magn. Reson. 205 (1), 141-147 (2010).
- Schroeder, M. A., Atherton, H. J., et al. Real-time assessment of Krebs cycle metabolism using hyperpolarized 13C magnetic resonance spectroscopy. FASEB J. Off. Publ. Fed. Am. Soc. Exp. Biol. 23 (8), 2529-2538 (2009).
- Hurd, R. E., Yen, Y. -. F., et al. Metabolic imaging in the anesthetized rat brain using hyperpolarized [1-13C] pyruvate and [1-13C] ethyl pyruvate. Magn. Reson. Med. 63 (5), 1137-1143 (2010).
- Chen, A. P., Kurhanewicz, J., et al. Feasibility of using hyperpolarized [1-13C]lactate as a substrate for in vivo metabolic 13C MRSI studies. Magn. Reson. Imaging. 26 (6), 721-726 (2008).
- Witney, T. H., Kettunen, M. I., et al. Detecting treatment response in a model of human breast adenocarcinoma using hyperpolarised [1-(13)C]pyruvate and. Br. J. Cancer. 103 (9), 1400-1406 (2010).
- Bohndiek, S. E., Kettunen, M. I., et al. Detecting tumor response to a vascular disrupting agent using hyperpolarized (13)C magnetic resonance spectroscopy. Mol. Cancer Ther. 9 (12), 3278-3288 (2010).
- Gallagher, F. A., Kettunen, M. I., et al. Production of hyperpolarized [1,4-13C2]malate from [1,4-13C2]fumarate is a marker of cell necrosis and treatment response in tumors. Proc. Natl. Acad. Sci. U. S. A. 106 (47), 19801-19806 (2009).
- Jensen, P. R., Peitersen, T., et al. Tissue-specific short chain fatty acid metabolism and slow metabolic recovery after ischemia from hyperpolarized NMR in vivo. J. Biol. Chem. 284 (52), 36077-36082 (2009).
- Gallagher, F. A., Kettunen, M. I., et al. Magnetic resonance imaging of pH in vivo using hyperpolarized 13C-labelled bicarbonate. Nature. 453 (7197), 940-943 (2008).
- Scholz, D. J., Janich, M. A., et al. Quantified pH imaging with hyperpolarized 13C-bicarbonate. Magn. Reson. Med. 73 (6), 2274-2282 (2015).
- Koellisch, U., Gringeri, C. V., et al. Metabolic imaging of hyperpolarized [1-(13) C]acetate and [1-(13) C]acetylcarnitine – investigation of the influence of dobutamine induced stress. Magn. Reson. Med. 74 (4), 1011-1018 (2015).
- Koellisch, U., Laustsen, C., et al. Investigation of metabolic changes in STZ-induced diabetic rats with hyperpolarized [1-13C]acetate. Physiol. Rep. 3 (8), (2015).
- Jensen, P. R., Meier, S., Ardenkjaer-Larsen, J. H., Duus, J. O., Karlsson, M., Lerche, M. H. Detection of low-populated reaction intermediates with hyperpolarized NMR. Chem. Commun. (34), 5168-5170 (2009).
- Koelsch, B. L., Keshari, K. R., Peeters, T. H., Larson, P. E. Z., Wilson, D. M., Kurhanewicz, J. Diffusion MR of hyperpolarized 13C molecules in solution. Analyst. 138 (4), 1011-1014 (2013).
- Golman, K., Ardenkjaer-Larsen, J. H., Petersson, J. S., Mansson, S., Leunbach, I. Molecular imaging with endogenous substances. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10435-10439 (2003).
- von Morze, C., Larson, P. E. Z., et al. Imaging of Blood Flow Using Hyperpolarized [(13)C]Urea in Preclinical Cancer Models. J. Magn. Reson. Imaging. 33 (3), 692-697 (2011).
- Chiavazza, E., Kubala, E., et al. Earth’s magnetic field enabled scalar coupling relaxation of 13C nuclei bound to fast-relaxing quadrupolar 14N in amide groups. J. Magn. Reson. 227, 35-38 (2013).
- Jensen, P. R., Karlsson, M., Meier, S., Duus, J., Lerche, M. H. Hyperpolarized amino acids for in vivo assays of transaminase activity. Chem. – A Eur. J. 15 (39), 10010-10012 (2009).
- Gallagher, F. A., Kettunen, M. I., et al. Detection of tumor glutamate metabolism in vivo using 13C magnetic resonance spectroscopy and hyperpolarized [1-13C]glutamate. Magn. Reson. Med. 66 (1), 18-23 (2011).
- Chaumeil, M. M., Larson, P. E. Z., et al. Hyperpolarized [1-13C] glutamate: a metabolic imaging biomarker of IDH1 mutational status in glioma. Cancer Res. 74 (16), 4247-4257 (2014).
- Keshari, K. R., Wilson, D. M. Chemistry and biochemistry of 13C hyperpolarized magnetic resonance using dynamic nuclear polarization. Chem. Soc. Rev. 43 (5), 1627-1659 (2014).
- Nelson, S. J., Kurhanewicz, J., et al. Metabolic Imaging of Patients with Prostate Cancer Using Hyperpolarized [1-13C]Pyruvate. Sci. Transl. Med. 5 (198), (2013).
- Warburg, O. On the origin of cancer cells. Science. 123 (3191), 309-314 (1956).
- Warburg, O., Wind, F., Negelein, E. {Ü}ber den Stoffwechsel von Tumoren im K{ö}rper. Klin. Wochenschr. 5 (19), 829-832 (1926).
- Barnes, A. B., De Paepe, G., et al. High-Field Dynamic Nuclear Polarization for Solid and Solution. Biological NMR. Appl. Magn. Reson. 34 (3-4), 237-263 (2008).
- Koukourakis, M. I., Giatromanolaki, A., Sivridis, E., Gatter, K. C., Harris, A. L. Pyruvate dehydrogenase and pyruvate dehydrogenase kinase expression in non small cell lung cancer and tumor-associated stroma. Neoplasia. 7 (1), 1-6 (2005).
- Golman, K., Petersson, J. S. Metabolic Imaging and Other Applications of Hyperpolarized 13C1. Acad. Radiol. 13 (8), 932-942 (2016).
- Golman, K., Petersson, J. S., et al. Cardiac metabolism measured noninvasively by hyperpolarized 13C MRI. Magn. Reson. Med. 59 (5), 1005-1013 (2008).
- Merritt, M. E., Harrison, C., Storey, C., Jeffrey, F. M., Sherry, A. D., Malloy, C. R. Hyperpolarized 13C allows a direct measure of flux through a single enzyme-catalyzed step by NMR. Proc. Natl. Acad. Sci. U. S. A. 104 (50), 19773-19777 (2007).
- Merritt, M. E., Harrison, C., Storey, C., Sherry, A. D., Malloy, C. R. Inhibition of carbohydrate oxidation during the first minute of reperfusion after brief ischemia NMR detection of hyperpolarized 13CO2 and H13CO3-. Magn. Reson. Med. 60 (5), 1029-1036 (2008).
- Hu, S., Chen, A. P., et al. In vivo carbon-13 dynamic MRS and MRSI of normal and fasted rat liver with hyperpolarized 13C-pyruvate. Mol. imaging Biol. MIB Off. Publ. Acad. Mol. Imaging. 11 (6), 399-407 (2009).
- Kohler, S. J., Yen, Y., et al. In vivo 13 carbon metabolic imaging at 3T with hyperpolarized 13C-1-pyruvate. Magn. Reson. Med. 58 (1), 65-69 (2007).
- Hu, S., Lustig, M., et al. 3D compressed sensing for highly accelerated hyperpolarized (13)C MRSI with in vivo applications to transgenic mouse models of cancer. Magn. Reson. Med. 63 (2), 312-321 (2010).
- Kurhanewicz, J., Vigneron, D. B., et al. Analysis of cancer metabolism by imaging hyperpolarized nuclei: prospects for translation to clinical research. Neoplasia. 13 (2), 81-97 (2011).
- Schroeder, M. A., Cochlin, L. E., Heather, L. C., Clarke, K., Radda, G. K., Tyler, D. J. In vivo assessment of pyruvate dehydrogenase flux in the heart using hyperpolarized carbon-13 magnetic resonance. Proc. Natl. Acad. Sci. U. S. A. 105 (33), 12051-12056 (2008).
- Zierhut, M. L., Yen, Y. -. F., et al. Kinetic modeling of hyperpolarized 13C1-pyruvate metabolism in normal rats and TRAMP mice. J. Magn. Reson. 202 (1), 85-92 (2010).
- Dennis, L. K., Resnick, M. I. Analysis of recent trends in prostate cancer incidence and mortality. Prostate. 42 (4), 247-252 (2000).
- Jambor, I., Borra, R., et al. Functional imaging of localized prostate cancer aggressiveness using 11C-acetate PET/CT and 1H-MR spectroscopy. J. Nucl. Med. 51 (11), 1676-1683 (2010).
- Presti, J. C. J., Hricak, H., Narayan, P. A., Shinohara, K., White, S., Carroll, P. R. Local staging of prostatic carcinoma: comparison of transrectal sonography and endorectal MR imaging. AJR. Am. J. Roentgenol. 166 (1), 103-108 (1996).
- Schulte, R. F., Sacolick, L., et al. Transmit gain calibration for nonproton MR using the Bloch-Siegert shift. NMR Biomed. 24 (9), 1068-1072 (2011).
- Durst, M., Koellisch, U., et al. Comparison of acquisition schemes for hyperpolarised (1)(3)C imaging. NMR Biomed. 28 (6), 715-725 (2015).
- Janich, M. A., Menzel, M. I., et al. Effects of pyruvate dose on in vivo metabolism and quantification of hyperpolarized (1)(3)C spectra. NMR Biomed. 25 (1), 142-151 (2012).
- Harrison, C., Yang, C., et al. Comparison of kinetic models for analysis of pyruvate-to-lactate exchange by hyperpolarized 13 C NMR. NMR Biomed. 25 (11), 1286-1294 (2012).
- Gómez Damián, P. A., Sperl, J. I., et al. Multisite Kinetic Modeling of (13)C Metabolic MR Using [1-(13)C]Pyruvate. Radiol. Res. Pract. 2014, (2014).
- Talbot, J. -. N., Gutman, F., et al. PET/CT in patients with hepatocellular carcinoma using [(18)F]fluorocholine: preliminary comparison with [(18)F]FDG PET/CT. Eur. J. Nucl. Med. Mol. Imaging. 33 (11), 1285-1289 (2006).
- Reeder, S. B., Pineda, A. R., et al. Iterative decomposition of water and fat with echo asymmetry and least-squares estimation (IDEAL): application with fast spin-echo imaging. Magn. Reson. Med. 54 (3), 636-644 (2005).
- Laustsen, C., Ostergaard, J. A., et al. Assessment of early diabetic renal changes with hyperpolarized [1-(13) C]pyruvate. Diabetes. Metab. Res. Rev. 29 (2), 125-129 (2013).
- Serrao, E. M., Brindle, K. M. Potential Clinical Roles for Metabolic Imaging with Hyperpolarized [1-(13)C]Pyruvate. Front. Oncol. 6, 59 (2016).

