Гиперполяризованный<sup> 13</sup> C Метаболический магнитно-резонансная спектроскопия и обработка изображений
Summary
Dynamic nuclear polarization with subsequent sample dissolution has enabled real-time studies of metabolism in biological systems. Hyperpolarized [1-13C]pyruvate was used to study lactate dehydrogenase activity in a prostate carcinoma cell line in vitro.
Abstract
В последние десятилетия новые методы стадирования опухоли, рестадировании, мониторинг реакции на лечение, а также выявления рецидивов различных видов рака появились в сочетании с позитронно – эмиссионной томографии внедренный с 18 F-фтордезоксиглюкозы ([18 F ] -FDG ПЭТ). 13 C магнитно – резонансная томография спектроскопические (13 CMRSI) является минимально инвазивный метод визуализации , который позволяет контролировать метаболизм в естественных условиях и в режиме реального времени. Как и с любым другим методом , основанным на 13 С ядерного магнитного резонанса (ЯМР), она сталкивается с проблемой низкой тепловой поляризации и последующего низким отношением сигнал-шум из – за относительно низкой гиромагнитного отношения 13 С и его низкой изобилие природных ресурсов в биологические образцы. Путем преодоления этих ограничений, динамическая поляризация ядер (DNP) с последующим растворением образца в последнее время позволило широко используется ЯМР и магнитно-резонансная томография (МРТ) систем для измерения, Изучение и изображения ключевых метаболических путей в различных биологических системах. Особенно интересной и перспективной молекулы используется в 13 CMRSI является [1- 13 С] пируват, который, в последние десять лет, широко используется для в пробирке, доклинические, и, совсем недавно, клинические исследования для изучения метаболизма клеточной энергии при раке и других заболеваний. В этой статье мы опишем технику растворения DNP с использованием 3,35 T доклинические DNP hyperpolarizer и продемонстрировать его использование в исследованиях в пробирке. Аналогичный протокол для гиперполяризации могут быть применены по большей части в исследованиях в естественных условиях , а также. Для этого мы использовали лактатдегидрогеназы (ЛДГ) и катализируют метаболические реакции [1- 13 С] пируват в [1- 13 C] лактат в клеточной линии карциномы простаты, PC3, в пробирке с использованием 13 CMRSI.
Introduction
В настоящее время наиболее широко используется клинический метод стадирования опухоли, рестадировании, мониторинг реакции на лечение, а также выявления рецидивов широкого спектра раковых заболеваний является [18 F] -FDG ПЭТ. 1 Тем не менее, в последнее время , несколько новых и альтернативных подходов появились. Одним из таких методов является 13 CMRSI. Этот метод включает введение C-молекулы 13 в биологическом образце, а затем минимально инвазивной МРТ для оценки метаболизма в пробирке или в естественных условиях в режиме реального времени. Тем не менее, самой большой проблемой 13 CMRSI, по сравнению с другими методами , такими как [18 F] -FDG ПЭТ или компьютерной томографии, является низкое отношение сигнал-шум.
Сигнал ЯМР прямо пропорционален уровню поляризации, отношение разности населения спин ½ ядер в двух энергетических состояниях к общей численности населения (рис 1А). Поляризация является продуктом-гогиромагнитное отношение е (γ) ядер и приложенное напряженность магнитного поля над температурой. Типичная поляризация ядер 1 Н порядка 0,001% до 0,005% при 3 Т, что дает относительно плохое отношение сигнал-шум. Сегодняшнее состояние дел в современной МРТ является успешным методом визуализации только из – за высокой численности 1 Н в биологических образцах и высокой гиромагнитному соотношении 1 Н (у 1H = 42,576 МГц / T). Тем не менее, наблюдая других ядер, таких как углерод, является более сложным. Единственным стабильным, магнитно – активный изотоп углерода 13 С, составляет лишь 1,1% от общего числа атомов углерода. Кроме того, гиромагнитное отношение 13 C (γ 13С = 10,705 МГц / T) в четыре раза меньше , чем у 1 Н, что приводит к более низкой эффективности обнаружения. Таким образом, низкое содержание 13 С и низкой γ 13С вызывают тепловые измерения 13 C для достижения 0,0176% от чувствительности 1Измерение Н-ЯМР в естественных условиях.
Динамическая поляризация ядер
Способ преодолеть сравнительно слабую чувствительность 13 измерений С DNP. Первоначально он был описан для металлов в 1953 году Альберт В. Оверхаузером. В своей статье он заявил: "Показано , что если электронный спиновый резонанс электронов проводимости насыщается, ядра будут поляризованы в той же степени они были бы , если их гиромагнитное отношение было то , что спина электрона." 2 В дальнейшем в том же году, Карвер и Слихтера экспериментально подтвердили гипотезу Оверхаузера 3. В 1958 г. Абрагам и Проктор описал этот эффект для электронов в жидкостях и назвал его "твердый эффект." При температурах ниже 4 К, электрон-спиновой поляризации достигает почти 100% и более чем на три порядка выше , чем ядерно-спиновой поляризации (рис 1B) 4. Tего происходит потому , что гиромагнитное отношение электрона (Г е = 28024,944 МГц / T) на три порядка выше , чем ядерных гиромагнитных соотношениях. Слабые взаимодействия между электронами и ядрами, таких как эффект Оверхаузера, твердый эффект, перекрестный эффект, и эффект термического смешивания, позволяют передавать поляризации от электронных спинов ядерных спинов с использованием микроволнового излучения с частотой, близкой к соответствующему электрона парамагнитного резонанса (ЭПР) частота 5,6. Теория ДНП получила дальнейшее развитие, чтобы привлечь большее количество электронов и тепловое перемешивание. Тем не менее, на сегодняшний день нет единого количественное теоретическое описание ДНП не было опубликовано 7,8.
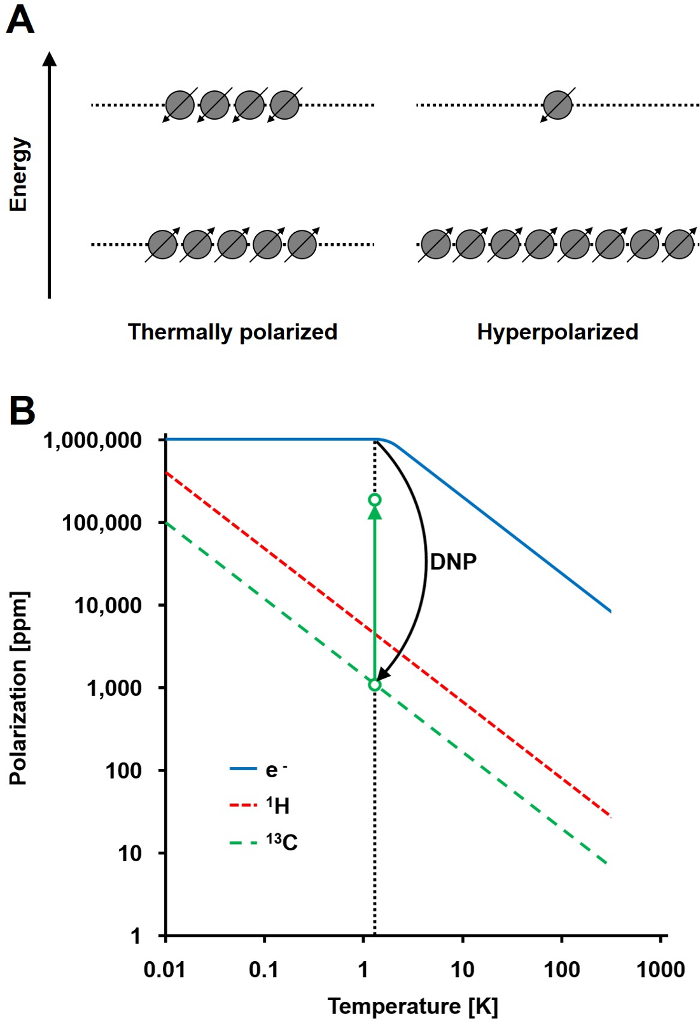
Рисунок 1: Понимание динамической поляризации ядер и гиперполяризации. А) Схематическое сравнение спиновой заселенностив состоянии теплового равновесия поляризации и гиперполяризованным состояния. Б) поляризации зависит от температуры. Поляризация электронов (е -) достигает 100% ниже 1.4 K. ДНП обеспечивает передачу поляризации от e- до ядер 13 С, что увеличивает их поляризацию до 10 5 – кратно. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Для того, чтобы ввести ДНП в исследованиях биологических систем с использованием ЯМР 13 С, должны были быть разработаны последующее растворение быстрого образца. 50 лет после того, как гипотеза Оверхаузера, Ян Х. Ardenkjaer-Larsen и др. решена технически сложный вопрос о привлечении к гиперпол замороженного образца в жидкое состояние с потерей минимальным гиперполяризации 6. Растворение DNP открыл новое поле исследований под названием 13 КМРЯ, обеспечивая новый метод для исследования и описания различных состояний 9,10 болезни. В качестве стабильных носителей непарный электрон, тритильная радикала трис (8-карбокси-2,2,6,6-тетра (гидроксиэтил) -benzo- [1,2-4,5] -бис (1,3) -dithiole-4-ил) -метил натриевая соль (OX063) или (2,2,6,6-тетраметилпиперидин-1-ил) оксил (TEMPO) обычно используется. Они смешиваются с желаемой молекулой 13 С-меченого и подвергается воздействию микроволнового излучения с частотой , близкой к соответствующей частоте ЭПР. Используя эту технику, поляризация ядер 13 С может быть увеличена до 37% 11. Это приводит к кратному усилению поляризации 10 5 по сравнению с тепловой равновесной поляризации 11,12. Тем не менее, как только микроволновое облучение прекращают и / или 13 С-молекула переходит в жидкое состояние, поляризация затухает с продольной релаксации (Т 1) ядра 13 С , который был поляризован. Таким образомИзобретение быстрых методов растворения или любой последующий метод сокращения времени до экспериментального измерения (т.е. инъекции) имеет решающее значение для биологических применений 13.
Существуют три основных требования , что молекула кандидат должен выполнить для успешного проведения 13 исследований CMRSI. Во- первых, 13 С ядром интерес должен иметь достаточно длинную T 1 (> 10 лет). Выбор 13 С-метки имеет решающее значение. Лучшие ядра – кандидаты являются атомы углерода, не имеющие прямого контакта с 1 Н-ядер через связь. Она также должна быть быстро метаболизируется в течение 2 – 3 Т – 1 раз, что приводит к потоку продукта метаболизма с существенно различным химическим сдвигом от исходного вещества. Образец смеси должна также образовывать аморфное стекло , если в твердом состоянии , так что пространственное распределение уменьшает расстояние между электроном и 13 С, что позволяет трансфер поляризации. Если молекула кандидат не образует аморфное стекло , естественно, она должна быть очень хорошо растворимы в Остекление агента, такого как глицерин или диметилсульфоксид 14. Эти требования приводят к относительно небольшому числу молекул-кандидатов. Тем не менее, даже после успешного открытия подходящей молекулы, разработка рабочего протокола для гиперполяризации может быть технически сложным 9,14,15.
В последние годы некоторые субстраты были успешно поляризованным, такие как [1- 13 С] пируват 12,16 – 36, [2- 13С] пируват 37, [1- 13 С] этилпируват 38, [1- 13 C ] лактат 39, [1- 13 C] фумарат 40 – 43, 13 С-бикарбонат 36,44,45, [1- 13 C] ацетата натрия 43,46 – 49, 13 C-мочевина 6,36,50,51 , [5- 13 C] glutamiпе 15,52,53, [1- 13 C] глутамата 53,54, [1- 13 C] 2-оксоглутарат 55, [1- 13 C] аланин и другие 14,56. Особенно интересным и часто используемый субстрат для гиперполяризации является [1- 13 С] пируват. Он широко используется в доклинических исследованиях для изучения клеточной энергии-обмен веществ при различных заболеваниях 14,17,22. [1- 13 С] пируват отвечает всем требованиям для успешного гиперполяризации, в том числе относительно длинный T 1 и быстрого переноса через клеточную мембрану перед впоследствии метаболизируются. Доклинические исследования с [1- 13 С] пируват в настоящее время переводятся в клинику 57.
Метаболизм пирувата
Хорошо известно, что существует прямая связь между мутациями в ДНК рак клеток и изменение их метаболических путей. Уже в 1920-е годы, Отто Варбург DiscovERed , что существует повышенный метаболизм глюкозы и лактата в опухолях по сравнению с здоровой тканью 58 – 60. В дальнейшем различные чередований в других метаболических путей, таких как пентозофосфатного пути, цикла трикарбоновых кислот, окислительного фосфорилирования и синтеза нуклеотидов и липидов, которые были описаны.
Пируват является конечным продуктом гликолиза. В опухоли, она подвергается анаэробный гликолиз , катализируемой ЛДГ 61 и вступает в реакцию с восстановленной формой кофермента никотинамидадениндинуклеотида (НАДН), в результате чего в лактат и окисленной формы кофермента (НАД +). В качестве альтернативы, пируват подвергается реакции переаминирования с глутамата с образованием аланина, катализируемой аланин-трансаминазы (АЛТ). Обе реакции легко обратимы. Пируват также подвергается декарбоксилирование, катализируемой пируват-дегидрогеназы (PDH) до диоксида углерода и ацетил-КоА, гepresenting необратимой реакции на этой стадии. Чередование этих скоростей реакций могут быть связаны с опухолью метаболизма 17,21,22,25,62. Метаболических путей приведены на рисунке 2.

Рисунок 2: Схема реакции основного метаболического пирувата. Пируват / лактат превращение катализируется СДГ, и преобразование пирувата / аланин катализируется ALT. Пируват необратимо превращается в ацетил-КоА и СО 2 PDH и СО 2 находится в зависимости от рН равновесии с бикарбонатом 80. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Обнаружение гиперполяризованного [1- 13 С] пируват и его метаболитов было показано ранее на крысах онискусство 37,63 – 65, печень 66, мышцы и почки 62,67. Одно исследование показало существенные различия в соотношении лактат-к-аланин между нормальным и голодном печени крысы 66 и продемонстрировали высокую надземные и гиперполяризованного [1- 13 C] лактат уровень заболеваемости раком печени 68,69. Существует доказательство того, что степень злокачественности опухоли могут быть идентифицированы в трансгенной аденокарциномой простаты мыши (TRAMP) с использованием гиперполяризованного [1- 13 С] пируват 22, с гиперполяризованным уровней лактата , показывающие высокую корреляцию с гистологической степени подакцизным опухолей. Аланин , катализируемой из пирувата АЛТ также была предложена в качестве маркера в полезный крысы гепатоцеллюлярной карциномы 23.
Измерение пируват-лактат метаболический поток был использован для мониторинга ишемии 63,65,70 и в качестве реакции на лечение с химиотерапией 17,40 цитотоксическое, таргетных препаратов <SUP> 24,25,41, или лучевая терапия 26 на животных моделях. Он также используется для обнаружения фосфатидилинозитол 3-киназы (PI3K) ингибитором реакции LY294002 в мышиных моделях глиобластомы и рака молочной железы 25. Изменения в пирувата в опухолей головного мозга 26 и рак простаты 24,71 также наблюдались после лечения.
карцинома простаты
Рак предстательной железы является преобладающей формой рака у пожилых мужчин и второй ведущей связанных с раком смерти у мужчин во всем мире 72. На сегодняшний день нет надежных, неинвазивные методы не доступны для ранней диагностики и определения характеристик рака простаты 73,74, подчеркивая настоятельную необходимость новых методов визуализации обмена веществ , с тем чтобы строгое обнаружение и постановку пациентов. Рак простаты был использован в качестве модели для демонстрации возможности растворения ДНП в сочетании с 13 CMRSI у пациентаS 57. Эта работа была продолжена в первом клиническом испытании с использованием [1- 13 C] пирувата и 13 CMRSI для визуализации рака простаты, и она совсем недавно была завершена (NCT01229618).
Мотивацией данной работы , чтобы проиллюстрировать более подробно и для более широкой аудитории к применению метода 13 CMRSI в доклинической обстановке с клетками. Измерение ЛДГ-катализируемой метаболизм [1- 13 С] пируват в [1- 13 C] лактат в пробирке в клеточной линии карциномы простаты PC3, мы демонстрируем возможное применение растворения ДНП в исследованиях в пробирке и решения важных шагов и проблемы во время экспериментов.
Protocol
Representative Results
Discussion
13 CMRSI с гиперполяризованных зондов является перспективным методом для контроля метаболизма в реальном времени в пробирке и в естественных условиях. Один очень важный аспект при использовании этого экспериментального процесса является надлежащей стандартизации, особ?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
E.K. gratefully acknowledges the support of the Graduate School of Bioengineering (GSB) at Technische Universität München. This work was supported by the German Research Foundation (DFG) within the SFB Collaborative Research Center 824, “Imaging for Selection, Monitoring, and Individualization of Cancer Therapies.”
Materials
| HyperSense DNP Polariser | Oxford Instruments | 3.35 T preclinical DNP hyperpolarizer | |
| GE/Agilent MR901 | GE Healthcare/Agilent Technologies | 7 T preclinical MRI scanner, with small bore designed for experiments onrodent | |
| Spinsolve Carbon | Magritek | 1 T NMR spectrometer with permanent magnet | |
| Deuterium Oxide | Sigma Aldrich | 7789-20-0 | |
| Sodium phosphate dibasic | Sigma Aldrich | 7558-79-4 | |
| Sodium phosphate monbasic | Sigma Aldrich | 7558-80-7 | |
| Sodium hydroxide | Sigma Aldrich | 1310-73-2 | |
| Disodium edetate | Sigma Aldrich | 6381-92-6 | |
| Pyruvic acid – 13C1 | Cambridge Isotopes Laboratories | CLM-8077-1 | |
| Dotarem (0.5 mmol/L) | Guerbet | gadoterate meglumine | |
| tris (8-carboxy-2,2,6,6-tetra-(hydroxyethyl)-benzo-[1,2–4,5]-bis-(1,3)-dithiole-4-yl)-methyl sodium salt (OX063) | GE Healthcare | trityl radical used as a sourse of free electron | |
| PC3 cell line | ATCC | CRL1435 | |
| F-12K medium | ATCC | 30-2004 | |
| Fetal Bovine Serum | ATCC | SCRR-30-2020 | |
| Trypsine-EDTA Solution, 1X | ATCC | 30-2101 | |
| Sample plastic cup | Oxford Instruments | ||
| Trypan blue | Bio-Rad | 145-0013-MSDS |
References
- Rohren, E. M., Turkington, T. G., Coleman, R. E. Clinical applications of PET in oncology. Radiology. 231 (2), 305-332 (2004).
- Overhauser, A. W. Polarization of Nuclei in Metals. Phys. Rev. 92 (2), 411-415 (1953).
- Carver, T. R., Slichter, C. P. Polarization of Nuclear Spins in Metals. Phys. Rev. 92 (1), 212-213 (1953).
- Abragam, A., Proctor, W. G. Spin Temperature. Phys. Rev. 109 (5), 1441-1458 (1958).
- Abragam, a., Goldman, M. Principles of dynamic nuclear polarisation. Reports Prog. Phys. 41 (3), 395-467 (2001).
- Ardenkjaer-Larsen, J. H., Fridlund, B., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10158-10163 (2003).
- Shimon, D., Hovav, Y., Feintuch, A., Goldfarb, D., Vega, S. Dynamic nuclear polarization in the solid state: a transition between the cross effect and the solid effect. Phys. Chem. Chem. Phys. 14 (16), 5729-5743 (2012).
- Serra, S. C., Rosso, A., Tedoldi, F. Electron and nuclear spin dynamics in the thermal mixing model of dynamic nuclear polarization. Phys. Chem. Chem. Phys. 14 (38), 13299-13308 (2012).
- Gallagher, F. A., Kettunen, M. I., Brindle, K. M. Biomedical applications of hyperpolarized 13C magnetic resonance imaging. Prog. Nucl. Magn. Reson. Spectrosc. 55 (4), 285-295 (2009).
- Hurd, R. E., Yen, Y. -. F., Chen, A., Ardenkjaer-Larsen, J. H. Hyperpolarized 13C metabolic imaging using dissolution dynamic nuclear polarization. J. Magn. Reson. Imaging. 36 (6), 1314-1328 (2012).
- Ardenkjaer-Larsen, J. H., Fridlund, B., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10158-10163 (2003).
- Golman, K., in’t Zandt, R., Thaning, M. Real-time metabolic imaging. Proc. Natl. Acad. Sci. 103 (30), 11270-11275 (2006).
- Comment, A., Rentsch, J., et al. Producing over 100 ml of highly concentrated hyperpolarized solution by means of dissolution DNP. J. Magn. Reson. 194 (1), 152-155 (2008).
- Brindle, K. M., Bohndiek, S. E., Gallagher, F. A., Kettunen, M. I. Tumor imaging using hyperpolarized 13C magnetic resonance spectroscopy. Magn. Reson. Med. 66 (2), 505-519 (2011).
- Gallagher, F. A., Kettunen, M. I., Day, S. E., Lerche, M., Brindle, K. M. 13C MR spectroscopy measurements of glutaminase activity in human hepatocellular carcinoma cells using hyperpolarized 13C-labeled glutamine. Magn. Reson. Med. 60 (2), 253-257 (2008).
- Chen, A. P., Albers, M. J., et al. Hyperpolarized C-13 spectroscopic imaging of the TRAMP mouse at 3T-initial experience. Magn. Reson. Med. 58 (6), 1099-1106 (2007).
- Day, S. E., Kettunen, M. I., et al. Detecting tumor response to treatment using hyperpolarized 13C magnetic resonance imaging and spectroscopy. Nat. Med. 13 (11), 1382-1387 (2007).
- Schroeder, M. A., Swietach, P., et al. Measuring intracellular pH in the heart using hyperpolarized carbon dioxide and bicarbonate: a 13C and 31P magnetic resonance spectroscopy study. Cardiovasc. Res. 86 (1), 82-91 (2010).
- Hurd, R. E., Yen, Y. -. F., Tropp, J., Pfefferbaum, A., Spielman, D. M., Mayer, D. Cerebral dynamics and metabolism of hyperpolarized [1-(13)C]pyruvate using time-resolved MR spectroscopic imaging. J. Cereb. Blood Flow Metab. 30 (13), 1734-1741 (2010).
- Golman, K., Zandt, R. I., Lerche, M., Pehrson, R., Ardenkjaer-Larsen, J. H. Metabolic imaging by hyperpolarized 13C magnetic resonance imaging for in vivo tumor diagnosis. Cancer Res. 66 (22), 10855-10860 (2006).
- Park, I., Larson, P. E. Z., et al. Hyperpolarized 13C magnetic resonance metabolic imaging: application to brain tumors. Neuro. Oncol. 12 (2), 133-144 (2010).
- Albers, M. J., Bok, R., et al. Hyperpolarized 13C lactate, pyruvate, and alanine: noninvasive biomarkers for prostate cancer detection and grading. Cancer Res. 68 (20), 8607-8615 (2008).
- Yen, Y. -. F., Le Roux, P., et al. T(2) relaxation times of (13)C metabolites in a rat hepatocellular carcinoma model measured in vivo using (13)C-MRS of hyperpolarized [1-(13)C]pyruvate. NMR Biomed. 23 (4), 414-423 (2010).
- Dafni, H., Larson, P. E. Z., et al. Hyperpolarized 13C spectroscopic imaging informs on hypoxia-inducible factor-1 and myc activity downstream of platelet-derived growth factor receptor. Cancer Res. 70 (19), 7400-7410 (2010).
- Ward, C. S., Venkatesh, H. S., et al. Noninvasive detection of target modulation following phosphatidylinositol 3-kinase inhibition using hyperpolarized 13C magnetic resonance spectroscopy. Cancer Res. 70 (4), 1296-1305 (2010).
- Day, S. E., Kettunen, M. I., et al. Detecting response of rat C6 glioma tumors to radiotherapy using hyperpolarized [1- 13C]pyruvate and 13C magnetic resonance spectroscopic imaging. Magn. Reson. Med. 65 (2), 557-563 (2011).
- Johannesson, H., Macholl, S., Ardenkjaer-Larsen, J. H. Dynamic Nuclear Polarization of [1-13C]pyruvic acid at 4.6 tesla. J. Magn. Reson. 197 (2), 167-175 (2009).
- Durst, M., Koellisch, U., et al. Bolus tracking for improved metabolic imaging of hyperpolarised compounds. J. Magn. Reson. 243, 40-46 (2014).
- Khegai, O., Schulte, R. F., et al. Apparent rate constant mapping using hyperpolarized [1-(13)C]pyruvate. NMR Biomed. 27 (10), 1256-1265 (2014).
- Sogaard, L. V., Schilling, F., Janich, M. A., Menzel, M. I., Ardenkjaer-Larsen, J. H. In vivo measurement of apparent diffusion coefficients of hyperpolarized (1)(3)C-labeled metabolites. NMR Biomed. 27 (5), 561-569 (2014).
- Aquaro, G. D., Frijia, F., et al. 3D CMR mapping of metabolism by hyperpolarized 13C-pyruvate in ischemia-reperfusion. JACC. Cardiovasc. Imaging. 6 (6), 743-744 (2013).
- Menzel, M. I., Farrell, E. V., et al. Multimodal assessment of in vivo metabolism with hyperpolarized [1-13C]MR spectroscopy and 18F-FDG PET imaging in hepatocellular carcinoma tumor-bearing rats. J. Nucl. Med. 54 (7), 1113-1119 (2013).
- Schilling, F., Duwel, S., et al. Diffusion of hyperpolarized (13) C-metabolites in tumor cell spheroids using real-time NMR spectroscopy. NMR Biomed. 26 (5), 557-568 (2013).
- Schulte, R. F., Sperl, J. I., et al. Saturation-recovery metabolic-exchange rate imaging with hyperpolarized [1-13C] pyruvate using spectral-spatial excitation. Magn. Reson. Med. 69 (5), 1209-1216 (2013).
- Wiesinger, F., Weidl, E., et al. IDEAL spiral CSI for dynamic metabolic MR imaging of hyperpolarized [1-13C]pyruvate. Magn. Reson. Med. 68 (1), 8-16 (2012).
- Wilson, D. M., Keshari, K. R., et al. Multi-compound polarization by DNP allows simultaneous assessment of multiple enzymatic activities in vivo. J. Magn. Reson. 205 (1), 141-147 (2010).
- Schroeder, M. A., Atherton, H. J., et al. Real-time assessment of Krebs cycle metabolism using hyperpolarized 13C magnetic resonance spectroscopy. FASEB J. Off. Publ. Fed. Am. Soc. Exp. Biol. 23 (8), 2529-2538 (2009).
- Hurd, R. E., Yen, Y. -. F., et al. Metabolic imaging in the anesthetized rat brain using hyperpolarized [1-13C] pyruvate and [1-13C] ethyl pyruvate. Magn. Reson. Med. 63 (5), 1137-1143 (2010).
- Chen, A. P., Kurhanewicz, J., et al. Feasibility of using hyperpolarized [1-13C]lactate as a substrate for in vivo metabolic 13C MRSI studies. Magn. Reson. Imaging. 26 (6), 721-726 (2008).
- Witney, T. H., Kettunen, M. I., et al. Detecting treatment response in a model of human breast adenocarcinoma using hyperpolarised [1-(13)C]pyruvate and. Br. J. Cancer. 103 (9), 1400-1406 (2010).
- Bohndiek, S. E., Kettunen, M. I., et al. Detecting tumor response to a vascular disrupting agent using hyperpolarized (13)C magnetic resonance spectroscopy. Mol. Cancer Ther. 9 (12), 3278-3288 (2010).
- Gallagher, F. A., Kettunen, M. I., et al. Production of hyperpolarized [1,4-13C2]malate from [1,4-13C2]fumarate is a marker of cell necrosis and treatment response in tumors. Proc. Natl. Acad. Sci. U. S. A. 106 (47), 19801-19806 (2009).
- Jensen, P. R., Peitersen, T., et al. Tissue-specific short chain fatty acid metabolism and slow metabolic recovery after ischemia from hyperpolarized NMR in vivo. J. Biol. Chem. 284 (52), 36077-36082 (2009).
- Gallagher, F. A., Kettunen, M. I., et al. Magnetic resonance imaging of pH in vivo using hyperpolarized 13C-labelled bicarbonate. Nature. 453 (7197), 940-943 (2008).
- Scholz, D. J., Janich, M. A., et al. Quantified pH imaging with hyperpolarized 13C-bicarbonate. Magn. Reson. Med. 73 (6), 2274-2282 (2015).
- Koellisch, U., Gringeri, C. V., et al. Metabolic imaging of hyperpolarized [1-(13) C]acetate and [1-(13) C]acetylcarnitine – investigation of the influence of dobutamine induced stress. Magn. Reson. Med. 74 (4), 1011-1018 (2015).
- Koellisch, U., Laustsen, C., et al. Investigation of metabolic changes in STZ-induced diabetic rats with hyperpolarized [1-13C]acetate. Physiol. Rep. 3 (8), (2015).
- Jensen, P. R., Meier, S., Ardenkjaer-Larsen, J. H., Duus, J. O., Karlsson, M., Lerche, M. H. Detection of low-populated reaction intermediates with hyperpolarized NMR. Chem. Commun. (34), 5168-5170 (2009).
- Koelsch, B. L., Keshari, K. R., Peeters, T. H., Larson, P. E. Z., Wilson, D. M., Kurhanewicz, J. Diffusion MR of hyperpolarized 13C molecules in solution. Analyst. 138 (4), 1011-1014 (2013).
- Golman, K., Ardenkjaer-Larsen, J. H., Petersson, J. S., Mansson, S., Leunbach, I. Molecular imaging with endogenous substances. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10435-10439 (2003).
- von Morze, C., Larson, P. E. Z., et al. Imaging of Blood Flow Using Hyperpolarized [(13)C]Urea in Preclinical Cancer Models. J. Magn. Reson. Imaging. 33 (3), 692-697 (2011).
- Chiavazza, E., Kubala, E., et al. Earth’s magnetic field enabled scalar coupling relaxation of 13C nuclei bound to fast-relaxing quadrupolar 14N in amide groups. J. Magn. Reson. 227, 35-38 (2013).
- Jensen, P. R., Karlsson, M., Meier, S., Duus, J., Lerche, M. H. Hyperpolarized amino acids for in vivo assays of transaminase activity. Chem. – A Eur. J. 15 (39), 10010-10012 (2009).
- Gallagher, F. A., Kettunen, M. I., et al. Detection of tumor glutamate metabolism in vivo using 13C magnetic resonance spectroscopy and hyperpolarized [1-13C]glutamate. Magn. Reson. Med. 66 (1), 18-23 (2011).
- Chaumeil, M. M., Larson, P. E. Z., et al. Hyperpolarized [1-13C] glutamate: a metabolic imaging biomarker of IDH1 mutational status in glioma. Cancer Res. 74 (16), 4247-4257 (2014).
- Keshari, K. R., Wilson, D. M. Chemistry and biochemistry of 13C hyperpolarized magnetic resonance using dynamic nuclear polarization. Chem. Soc. Rev. 43 (5), 1627-1659 (2014).
- Nelson, S. J., Kurhanewicz, J., et al. Metabolic Imaging of Patients with Prostate Cancer Using Hyperpolarized [1-13C]Pyruvate. Sci. Transl. Med. 5 (198), (2013).
- Warburg, O. On the origin of cancer cells. Science. 123 (3191), 309-314 (1956).
- Warburg, O., Wind, F., Negelein, E. {Ü}ber den Stoffwechsel von Tumoren im K{ö}rper. Klin. Wochenschr. 5 (19), 829-832 (1926).
- Barnes, A. B., De Paepe, G., et al. High-Field Dynamic Nuclear Polarization for Solid and Solution. Biological NMR. Appl. Magn. Reson. 34 (3-4), 237-263 (2008).
- Koukourakis, M. I., Giatromanolaki, A., Sivridis, E., Gatter, K. C., Harris, A. L. Pyruvate dehydrogenase and pyruvate dehydrogenase kinase expression in non small cell lung cancer and tumor-associated stroma. Neoplasia. 7 (1), 1-6 (2005).
- Golman, K., Petersson, J. S. Metabolic Imaging and Other Applications of Hyperpolarized 13C1. Acad. Radiol. 13 (8), 932-942 (2016).
- Golman, K., Petersson, J. S., et al. Cardiac metabolism measured noninvasively by hyperpolarized 13C MRI. Magn. Reson. Med. 59 (5), 1005-1013 (2008).
- Merritt, M. E., Harrison, C., Storey, C., Jeffrey, F. M., Sherry, A. D., Malloy, C. R. Hyperpolarized 13C allows a direct measure of flux through a single enzyme-catalyzed step by NMR. Proc. Natl. Acad. Sci. U. S. A. 104 (50), 19773-19777 (2007).
- Merritt, M. E., Harrison, C., Storey, C., Sherry, A. D., Malloy, C. R. Inhibition of carbohydrate oxidation during the first minute of reperfusion after brief ischemia NMR detection of hyperpolarized 13CO2 and H13CO3-. Magn. Reson. Med. 60 (5), 1029-1036 (2008).
- Hu, S., Chen, A. P., et al. In vivo carbon-13 dynamic MRS and MRSI of normal and fasted rat liver with hyperpolarized 13C-pyruvate. Mol. imaging Biol. MIB Off. Publ. Acad. Mol. Imaging. 11 (6), 399-407 (2009).
- Kohler, S. J., Yen, Y., et al. In vivo 13 carbon metabolic imaging at 3T with hyperpolarized 13C-1-pyruvate. Magn. Reson. Med. 58 (1), 65-69 (2007).
- Hu, S., Lustig, M., et al. 3D compressed sensing for highly accelerated hyperpolarized (13)C MRSI with in vivo applications to transgenic mouse models of cancer. Magn. Reson. Med. 63 (2), 312-321 (2010).
- Kurhanewicz, J., Vigneron, D. B., et al. Analysis of cancer metabolism by imaging hyperpolarized nuclei: prospects for translation to clinical research. Neoplasia. 13 (2), 81-97 (2011).
- Schroeder, M. A., Cochlin, L. E., Heather, L. C., Clarke, K., Radda, G. K., Tyler, D. J. In vivo assessment of pyruvate dehydrogenase flux in the heart using hyperpolarized carbon-13 magnetic resonance. Proc. Natl. Acad. Sci. U. S. A. 105 (33), 12051-12056 (2008).
- Zierhut, M. L., Yen, Y. -. F., et al. Kinetic modeling of hyperpolarized 13C1-pyruvate metabolism in normal rats and TRAMP mice. J. Magn. Reson. 202 (1), 85-92 (2010).
- Dennis, L. K., Resnick, M. I. Analysis of recent trends in prostate cancer incidence and mortality. Prostate. 42 (4), 247-252 (2000).
- Jambor, I., Borra, R., et al. Functional imaging of localized prostate cancer aggressiveness using 11C-acetate PET/CT and 1H-MR spectroscopy. J. Nucl. Med. 51 (11), 1676-1683 (2010).
- Presti, J. C. J., Hricak, H., Narayan, P. A., Shinohara, K., White, S., Carroll, P. R. Local staging of prostatic carcinoma: comparison of transrectal sonography and endorectal MR imaging. AJR. Am. J. Roentgenol. 166 (1), 103-108 (1996).
- Schulte, R. F., Sacolick, L., et al. Transmit gain calibration for nonproton MR using the Bloch-Siegert shift. NMR Biomed. 24 (9), 1068-1072 (2011).
- Durst, M., Koellisch, U., et al. Comparison of acquisition schemes for hyperpolarised (1)(3)C imaging. NMR Biomed. 28 (6), 715-725 (2015).
- Janich, M. A., Menzel, M. I., et al. Effects of pyruvate dose on in vivo metabolism and quantification of hyperpolarized (1)(3)C spectra. NMR Biomed. 25 (1), 142-151 (2012).
- Harrison, C., Yang, C., et al. Comparison of kinetic models for analysis of pyruvate-to-lactate exchange by hyperpolarized 13 C NMR. NMR Biomed. 25 (11), 1286-1294 (2012).
- Gómez Damián, P. A., Sperl, J. I., et al. Multisite Kinetic Modeling of (13)C Metabolic MR Using [1-(13)C]Pyruvate. Radiol. Res. Pract. 2014, (2014).
- Talbot, J. -. N., Gutman, F., et al. PET/CT in patients with hepatocellular carcinoma using [(18)F]fluorocholine: preliminary comparison with [(18)F]FDG PET/CT. Eur. J. Nucl. Med. Mol. Imaging. 33 (11), 1285-1289 (2006).
- Reeder, S. B., Pineda, A. R., et al. Iterative decomposition of water and fat with echo asymmetry and least-squares estimation (IDEAL): application with fast spin-echo imaging. Magn. Reson. Med. 54 (3), 636-644 (2005).
- Laustsen, C., Ostergaard, J. A., et al. Assessment of early diabetic renal changes with hyperpolarized [1-(13) C]pyruvate. Diabetes. Metab. Res. Rev. 29 (2), 125-129 (2013).
- Serrao, E. M., Brindle, K. M. Potential Clinical Roles for Metabolic Imaging with Hyperpolarized [1-(13)C]Pyruvate. Front. Oncol. 6, 59 (2016).

