ליזר מהיר גשוש שיטה מקלה על קביעת פולשני צור-חינם של תכונות תרמיות ליף
Summary
A method was developed to determine the specific heat capacity and thermal conductivity of leaf tissue by non-invasive, contact-free near infrared laser probing, which requires less than 1 min per sample.
Abstract
צמחים יכולים לייצר חומרים יקרי ערך כגון מטבוליטים משניים וחלבונים רקומביננטיים. הטיהור של האחרון מביומסה צמח יכולה להיות יעילה על ידי טיפול בחום (לבן). מנגנון לבן יכול להיות מתוכנן בצורה מדויקת יותר אם תכונות תרמיות של העלים ידועות לפרטיהם, כלומר, את היכולת החומה הסגולית ומוליכות תרמית. מדידת הנכסים אלה היא זמן רב ועבודה אינטנסיבית, ובדרך כלל דורשת שיטות פולשניות כי פנו המדגם ישירות. זה יכול להפחית את תשואת המוצר ועלול להיות בקנה אחד עם דרישות בלימה, למשל, בהקשר של ייצור נאות. כדי לטפל בבעיות אלה, שיטה לא פולשנית, ללא קשר פותחה הקובע את קיבולת חום סגולי מוליכות תרמית של עלה צמח שלמים כדקה. השיטה כרוכה ביישום דופק לייזר קצר של אורך מוגדר ועוצמת אל אזור קטן שלמדגם עלה, גרימת עלייה בטמפרטורה זו נמדדת באמצעות חיישן אינפרא אדום קרוב. גידול הטמפרטורה משולב עם תכונות עלה ידועות (עובי וצפיפות) כדי לקבוע את קיבולת החום הסגולית. מוליכות התרמית ואז מחושבת על בסיס הפרופיל של הירידה בטמפרטורה עוקבת לוקחות קרינת תרמית מעבר חום בהסעה בחשבון. החישובים הקשורים היבטים קריטיים של טיפול מדגם נדונים.
Introduction
עיבוד בקנה מידה גדול של חומרים ביולוגיים בדרך כלל דורש צעדים-טיפול בחום כמו פיסטור. ציוד תהליכים כאלה יכול להיות מתוכנן בצורה מדויקת יותר אם תכונות תרמיות של חומרים הביולוגיים מאופיינות היטב, כולל קיבולת החום הסגולית (ג, עמ 'הים) ו מוליכות תרמית (λ). פרמטרים אלה ניתן לקבוע בקלות לנוזלים, השעיות homogenates ידי calorimetry 1. עם זאת, פרמטרים כגון מדידה בדגימות מוצקות יכולים להיות עבודה אינטנסיבית, ולעתים קרובות דורשים מגע ישיר עם המדגם או אפילו חורבנה 2. לדוגמה, טכניקות photothermal דורשים מגע ישיר בין המדגם לבין גלאי 3. מגבלות אלו מקובלים במהלך עיבוד מזון, אך אינם עולים בקנה אחד עם תהליכי פיקוח הדוק כגון ייצור של חלבונים הביו-פרמצבטיקה בצמחים בהקשר של תרגול 4 ייצור נאותים. אניn בהקשר כזה, חזר (למשל, שבועי) ניטור של תכונות תרמיות שיידרש במהלך תקופת צמיחת שבעה שבועות עבור צמחים בודדים ככלי בקרת איכות. אם ניטור כזה ידרוש וצורכים עלו לכל מדידה, לא יהיה שום ביומסה עזבה לעבד בזמן הקציר.
בנוסף, שימוש בחלקים עלה רק במקום יגרום ופצע למפעל ולהגדיל את הסיכון של נמק או זיהום הפתוגן, שוב מצמצמים את התשואה התהליך. הסבירות של זיהום הפתוגן עלולה להגביר גם אם שיטה עם מקשר ישיר המדגם תשמש, גרימת הסיכון שאירוע האצווה כולה של צמחים יכולה להידבק באמצעות מגע עם מכשיר חיישן מזוהם. יש היבטים בדומה להיחשב לניטור של הצמח מדגיש כמו בצורת, למשל, בהקשר ecophysiological. לדוגמא, אובדן מים מנוטר לעתים קרובות על ידי שינוי ביומסה הטרי, מחייבת Tre פולשניתatment של הצמחים תחת חקירה 5, למשל, לנתח עלה. במקום זאת, קביעת קיבולת החום הסגולית, אשר תלויה את תכולת המים מדגם, באופן בלתי פולשני כמו לתאר כאן, יכול לשמש כפרמטר פונדקאי עבור מצב הידרציה של צמחים. בשני התרחישים (ייצור תרופות ואקופיזיולוגיה), מדגיש מלאכותי המושרה על ידי שיטות מדידה הרסניות או פולשני יהיה מזיק כפי שהם יכולים לעוות את נתוני הניסוי. לכן, שדווחו בעבר שיטות פלאש 6 או את המיקום של דגימות בין צלחות כסף 7 אינן מתאימות תהליכי ניסויים כאלה, כי הם גם דורשים מקשר ישיר המדגם או הם הרסניים. פרמטרי ג p, s ו- λ צריכות להיקבע על מנת לעצב המכשור הטכנולוגי עבור צעד לבן שיכול לפשט טיהור מוצר ובכך להפחית את עלויות ייצור 8-10. ג השניp, s ו- λ כעת ניתן נחוש במהירות על ידי לייזר אינפרא אדום ליד מגע ללא שאינו הרסני (NIR) חיטוט בצורה עקבית לשחזור 11 ו שיטה חדשה זו יוסבר בהרחבה בהמשך. התוצאות שהתקבלו בשיטה זו נעשה שימוש מוצלח לדמות העברת החום עלי טבק 12, המאפשר את העיצוב של ציוד עיבוד מתאים ובחירת המתאימים פרמטרים כגון טמפרטורה הלבנה.
השיטה קלה להקים (איור 1) ויש לו שני שלבים, מדידה וניתוח, שכל אחת מהן כולל שני שלבים עיקריים. בשלב המדידה, מדגם עלה מחומם ראשון באופן מקומי על ידי דופק ליזר קצר וטמפרטורת הדגימה המירבית היא רשמה. פרופיל הטמפרטורה של המדגם נרשם ואז למשך תקופה של 50 s. בשלב הניתוח, נכסים עלו כגון צפיפות (בקלות ובמדויק שקבעו measurem pycnometricאף אוזן גרון) משולב עם טמפרטורת הדגימה המירבית לחשב ג p, s. בשלב השני, פרופיל הטמפרטורה עלה משמש כקלט עבור משוואת מאזן אנרגיה, לוקח הולכה, הסעה וקרינה בחשבון, כדי לחשב λ.
הוראות צעד-אחר-צעד מפורטות ניתנים באזור פרוטוקול והרחיב על תוכן הסרטון מלווה. מדידות אופייניות מכן מוצגות בסעיף התוצאות. לבסוף, את היתרונות ומגבלות של השיטה מודגשות בסעיף הדיון יחד עם שיפורי פוטנציאל ויישומים נוספים.
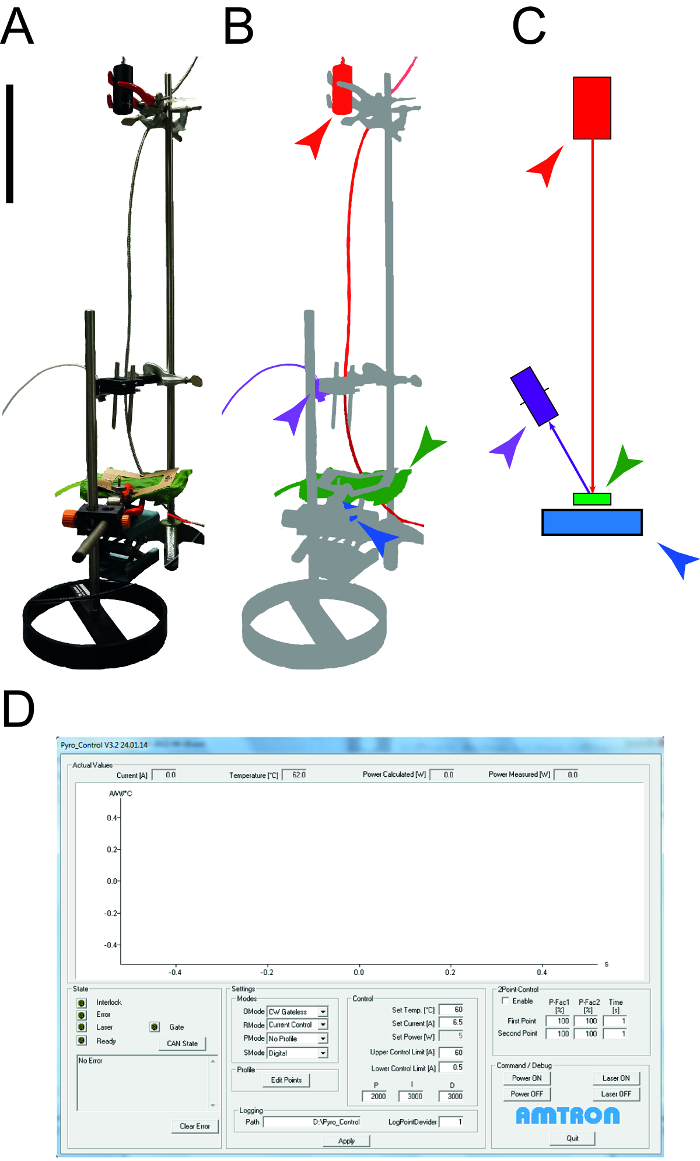
איור 1: מנגנון המשמש כדי לקבוע מאפיינים עלו תרמית. א. תצלום של המנגנון המדידה ששימשו לקביעת קיבולת חום סגולי מוליכות תרמית של leAves. ההתקנים ההיקפיים (המחשבים, אוסצילוסקופ) אינם מוצגים. B. ייצוג סכמטי של מנגנון המדידה. הליזר ואת הציוד מחובר מודגשים באדום, גלאי NIR למדידת טמפרטורה מוצגים סגול, מדגם העלה ירוק חיישן כוח פוטו-דיודה הוא כחול. ג. ציור של האלמנטים של ההתקנה המדידה עם אותו קוד הצבע כמו ב בר הגודל מצביע 0.1 מ '. D. תמונת מסך הממחיש את האלמנטים המאפיינים את תוכנות שליטת ליזר. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Protocol
Representative Results
Discussion
המגע ללא, שיטת מדידה בלתי הרסניות שתוארו לעיל ניתן להשתמש כדי לקבוע ג p, s ו- ʎ באופן סימולטני לשחזור. חישוב ʎ בפרט תלוי כמה פרמטרים רגישים שגיאים. אף על פי כן, ההשפעה של שגיאות אלה הייתה גם ליניארי או תת-מידתי, ואת המקדם שונה עבור כל הפרמטרים נמצאו פחות מ -10%. למ?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
The authors are grateful to Dr. Thomas Rademacher and Ibrahim Al Amedi for cultivating the plants used in this study. We would like to thank Dr. Richard M. Twyman for his assistance with editing the manuscript. This work was in part funded by the European Research Council Advanced Grant “Future-Pharma”, proposal number 269110, the Fraunhofer Zukunftsstiftung (Future Foundation), the Fraunhofer-Gesellschaft Internal Programs under Grant No. Attract 125-600164.
Materials
| 1" tube | Thorlabs | SM1L10E | Tube for fiber holder |
| Agarose | Sigma Aldrich | A0701 | Agarose |
| Bi-Convex lense f=25.4 | Thorlabs | LB1761 | Lense |
| Digital Handheld Optical Power and Energy Meter Console | Thorlabs | PM100D | Console for thermal surface absorber sensor |
| Digital Phosphor Oscilloscope | Tektronix | DPO7104 | Oscilloscope |
| DMR light microscope | Leica | n.a. | Light microscope |
| Falcon 50mL Conical Centrifuge Tubes | Fisher Scientific | 14-432-2 | Pycnometer |
| Ferty 2 Mega | Kammlott | 5.220072 | Fertilizer |
| Fiber holder | Thorlabs | Fiber holder | |
| Forma -86C ULT freezer | ThermoFisher | 88400 | Freezer |
| Greenhouse | n.a. | n.a. | For plant cultivation |
| Grodan Rockwool Cubes 10x10cm | Grodan | 102446 | Rockwool block |
| Infrared Detector Optris CT | Optris | OPTCTLT15 | Infrared detector |
| Infrared Detector Software Compact Connect | Optris | n.a. | Control software for infrared detector |
| Lambda 1050 UV/Vis spectrophotometer | PerkinElmer | L1050 | UV/VIS Spectrophotometer |
| Laser 400μm, 1550nm Conduction Cooled Single Bar Fiber Coupled Module | DILAS | M1F-SS2.1 | Laser |
| Laser cover | Amtron | LM200 | Laser Cover |
| Laser Driver | Amtron | CS 408 | Laser Driver |
| Osram cool white 36 W | Osram | 4930440 | Light source |
| Photodiode sensor | Thorlabs | PDA20H-EC | Power sensor for transmission measurements |
| Precision weight Ohaus Analytical Plus | Ohaus | 80251552 | Precision weight |
| Sample frame | Fraunhofer ILT | n.a. | Fixation of the leaf sample |
| Software Pyro Control | Amtron | n.a. | Laser Power Control Software |
| Stainless-steel-holder | n.a. | n.a. | Holder for measurement set-up |
| Teflon plates 2cm | Fraunhofer ILT | n.a. | Teflon attenuation |
| Thermal surface absorber Power sensor | Thorlabs | S314C | Sensor for laser power measurements |
| Vibratome | Leica | 1491200S001 | Vibratome |
| Zoc/Pro 6.51 | EmTec Innovative Software | n.a. | Laser Control Software |
References
- Wilhelm, E. . Heat Capacities: Liquids, Solutions and Vapours. , 516 (2010).
- Costa, J. M., Grant, O. M., Chaves, M. M. Thermography to explore plant-environment interactions. J. Exp. Bot. 64, 3937-3949 (2013).
- Jayalakshmy, M. S., Philip, J. Thermophysical Properties of Plant Leaves and Their Influence on the Environment Temperature. International Journal of Thermophysics. 31, 2295-2304 (2010).
- Buyel, J. F. Process development strategies in plant molecular farming. Curr. Pharm. Biotechnol. 16, 966-982 (2015).
- Schuster, A. C., et al. Effectiveness of cuticular transpiration barriers in a desert plant at controlling water loss at high temperatures. AoB PLANTS. 8, (2016).
- Parker, W. J., Jenkins, R. J., Abbott, G. L., Butler, C. P. Flash Method of Determining Thermal Diffusivity, Heat Capacity, and Thermal Conductivity. J Appl Phys. 32, 1679-1684 (1961).
- Hays, R. L. The thermal conductivity of leaves. Planta. 125, 281-287 (1975).
- Menzel, S., et al. Optimized blanching reduces the host cell protein content and substantially enhances the recovery and stability of two plant derived malaria vaccine candidates. Front. Plant Sci. , (2015).
- Buyel, J. F., Hubbuch, J., Fischer, R. Blanching intact leaves or heat precipitation in an agitated vessel or heat exchanger removes host cell proteins from tobacco extracts. J. Vis. Exp. , (2015).
- Beiss, V., et al. Heat-precipitation allows the efficient purification of a functional plant-derived malaria transmission-blocking vaccine candidate fusion protein. Biotechnol. Bioeng. 112, 1297-1305 (2015).
- Buyel, J. F., Gruchow, H. M., Tödter, N., Wehner, M. Determination of the thermal properties of leaves by non-invasive contact free laser probing. J. Biotechnol. 217, 100-108 (2016).
- Buyel, J. F. Numeric simulation can be used to predict heat transfer during the blanching of leaves and intact. Biochem. Eng. J. , (2015).
- Hedlund, H., Johansson, P. Heat capacity of birch determined by calorimetry: implications for the state of water in plants. Thermochim Acta. 349, 79-88 (2000).
- Chandrakanthi, M., Mehrotra, A. K., Hettiaratchi, J. P. A. Thermal conductivity of leaf compost used in biofilters: An experimental and theoretical investigation. Environ. Pollut. 136, 167-174 (2005).
- Larcher, W. . Physiological Plant Ecology: Ecophysiology and Stress Physiology of Functional Groups. , (2003).
- Cowen, R. A gamma-ray burst’s enduring fireball. Science News. 152, 197 (1997).
- Jones, H. G., et al. Thermal infrared imaging of crop canopies for the remote diagnosis and quantification of plant responses to water stress in the field. Funct. Plant Biol. 36, 978-989 (2009).
- Defraeye, T., Verboven, P., Ho, Q. T., Nicolai, B. Convective heat and mass exchange predictions at leaf surfaces: Applications, methods and perspectives. Comput. Electron. Agric. 96, 180-201 (2013).
- Arndt, S. K., Irawan, A., Sanders, G. J. Apoplastic water fraction and rehydration techniques introduce significant errors in measurements of relative water content and osmotic potential in plant leaves. Physiol. Plant. 155, 355-368 (2015).
- Jones, H. G., Schofield, P. Thermal and other remote sensing of plant stress. General and Applied Plant Physiology. 34, 19-32 (2008).
- Jones, H. G., Archer, N., Rotenberg, E., Casa, R. Radiation measurement for plant ecophysiology. J. Exp. Bot. 54, 879-889 (2003).
- Dupont, C., Chiriac, R., Gauthier, G., Toche, F. Heat capacity measurements of various biomass types and pyrolysis residues. Fuel. 115, 644-651 (2014).
- Chaerle, L., et al. Multi-sensor plant imaging: Towards the development of a stress-catalogue. Biotechnol. J. 4, 1152-1167 (2009).
- Hackl, H., Baresel, J. P., Mistele, B., Hu, Y., Schmidhalter, U. A Comparison of Plant Temperatures as Measured by Thermal Imaging and Infrared Thermometry. J. Agron. Crop. Sci. , 415-429 (2012).
- Yuan, L., et al. Spectral analysis of winter wheat leaves for detection and differentiation of diseases and insects. Field Crops Res. 156, 199-207 (2014).

