클리닉 기반 생물 저장소의 설립
Summary
피부 종양은 모스 (Mohs) 현미경 수술 후 폐기됩니다. 임상 지원 직원이 임상 작업을 방해하지 않고 하류 실험실 응용을위한 피부 종양 ( 예 : 편평 세포 암종, 기저 세포 암종 및 흑색 종) 샘플을 효과적으로 처리하고 저장할 수있는 프로토콜이 여기에 설명되어 있습니다.
Abstract
지난 몇 년 동안 피부암 ( 예, 편평 세포 암종, 기저 세포 암종 및 흑색 종)이 증가 해 왔습니다. 생물 의학 연구를위한 피부 종양 샘플에 대한 병행 요구가있을 것으로 예상됩니다. 그러나 조직 가용성은 생물 저장소를 확립하는 비용과 임상 조작을 방해하지 않는 임상 샘플을 입수 할 수있는 프로토콜이 없기 때문에 제한적입니다. 모스 수술 날짜에 일상적인 임상 절차에 최소한의 영향을 미치는 피부 종양 및 관련 혈액 및 타액 샘플을 수집하고 처리하기위한 프로토콜이 수립되었습니다. Mohs histotechnologist가 생검에서 입증 된 피부 악성 종양에 대한 첫 번째 모스 수술을받는 환자로부터 종양 샘플을 수집하고 가공합니다. 인접한 정상 조직은 수술 종결시 수집됩니다. 수집 할 수있는 추가 샘플은 전혈 및 협측 스왑입니다.. 정상적으로 폐기 된 조직 표본을 활용함으로써 병원에서 실험실 환경을 기반으로 여러 가지 주요 이점을 제공하는 생물 저장소가 생성되었습니다. 여기에는 광범위한 수집 된 샘플이 포함됩니다. 병리학 보고서를 포함하여 확인되지 않은 환자 기록에 대한 접근; 전형적인 기증자의 경우 추적 방문 중에 추가 샘플을 이용할 수 있습니다.
Introduction
암 및 바이오 마커 연구는 우수한 인체 조직 샘플의 공급에 의존하며, 제한된 공급으로 인해 연구 1,2 가 방해 받고 있습니다. 많은 피부 과학 연구는 인간 조직의 사용과 관련된 부적절한 공급, 다양한 품질 및 비용으로 인해 제한됩니다. 대형 전용 바이오 뱅크를 설립하는 데 드는 비용은 약 2 백만 달러로 추정되며, 이러한 비용은 인체 조직을 많은 연구자들이 사용할 수 없게 만듭니다. 또한 연구 샘플을 생성하고 저장하는 과정은 신중하게 실행하지 않으면 임상 조작에 영향을 미치고 환자 치료를 지연시킬 위험이 있습니다. 비용 효과적인 클리닉 기반의 바이오 저장소는 권장되는 모범 사례와 샘플 검증 4 , 5 , 6 에 따라 피부암 샘플에 초점을 맞추고 있습니다.
<p이 프로토콜은 편평 세포 암종 (SCC), 기저 세포 암종 (BCC) 및 흑색 종 피부암을 제거하기 위해 대량의 모스 현미경 수술을 수행하는 피부과 전문의에서 개발되었습니다. 자원 봉사자 기증자는이 환자 집단에서 모집 할 수 있습니다. 치료를 지연시키지 않고 동의 한 환자의 조직과 혈액을 신속하게 포획하기 위해서는 수집 장소에 바이오 저장소를 설치하는 것이 중요합니다. 같은 클리닉에서 샘플을 수집하면 수집 기술의 변화를 최소화하고 샘플의 품질 변화를 최소화 할 수 있습니다. 이는 다운 스트림 어플리케이션 7 , 8 에서 문제가 될 수 있습니다.Mohs 현미경 수술 기술의 목표는 최대한 많은 건강한 조직을 보존하면서 모든 암 조직을 제거하는 것입니다. 이 절차는 종양 조직의 얇은 층을 점진적으로 제거하는 것을 포함합니다. 연속되는 각 레이어는 그의(모든 종양 조직이 제거되었는지 여부를 결정하기 위해 피부과 의사가 종양 조직을 냉동시키고 H & E 염색을 시행 한 후) 논리적으로 검사했다. 환자가 사무실에있는 동안 조직의 후속 층의 절제 및 검사가 실행됩니다. 이 기술은 SCC 9 에 대한 최상의 치료 옵션으로 간주됩니다. 이 시점에서 상처는 닫히고, 치유 및 미용 외관을 향상시키기 위해 인접한 정상 조직 (ANT)을 자주 절제합니다. 따라서 종양 제거 수술은 향후 연구를 위해 조직 학적으로 특성화 된 조직을 수집하는 데 이상적입니다.
종양 조직, 인접한 정상 조직, 타액 및 혈액 샘플을 얻기위한 조달 절차는 정상적인 직원 업무에 미치는 영향을 최소화하도록 설계되었습니다 ( 그림 1 ). 의료 보조원은 절차를 위해 환자를 준비하는 동안 혈액을 채취합니다. 모스 절차 완료 후, M ohs histotechnologist는 표본의 추가 조직 슬라이드를 준비하고 조직을 biorepository에 전송합니다. 바이오 리포지토리 구축과 관련된 비용으로는 냉동 보관 냉동고 구입, 겸손한 임상 실험실 공간 창출 및 재고 추적 프로그램 개발 등이 있습니다.
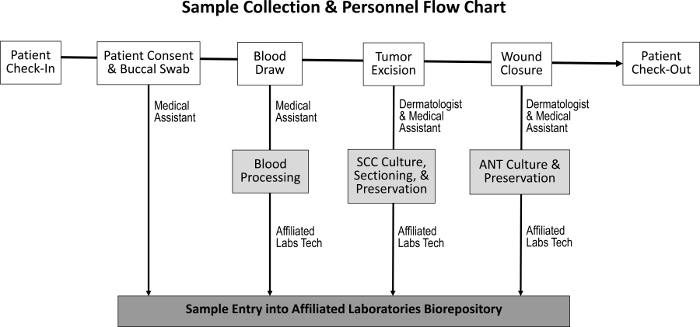
그림 1 : 샘플 수집 및 담당 직원의 순서. 환자가 체크인하고 환자의 동의를 얻으면 의료 보조원은 협측 면봉을 수집하여 혈액을 채취합니다. 피부과 의사와 의료 보조원은 종양을 절제하고 상처를 닫습니다. SCC와 ANT 표본은 각각 수집됩니다. 헌혈 기술자가 혈액을 처리하고 SCC 및 ANT 표본에 조직 배양, 보존 및 바이오 저장소로 들어가기위한 섹션을 분류합니다.ftp_upload / 55583 / 55583fig1large.jpg "target ="_ blank ">이 그림의 확대 버전을 보려면 여기를 클릭하십시오.
수집 된 샘플의 다양성은 다양한 실험 접근법을 가능하게합니다 ( 그림 2 ). 환자에게서 채취 한 샘플은 협측 면봉 (필요한 경우 타액을 수집 할 수 있음), 전혈 및 절제 된 조직입니다. 구강 내 면봉과 전혈에서 채취 한 샘플은 유전자 타이핑과 조직 일치를 위해 가공없이 저장됩니다. 미래의 분석을 위해 전혈이 백혈구 (WBC)와 혈장 분획으로 분리됩니다. 모스 처리 후, 동결 된 종양을 액체 질소에 직접 놓고 -80 ° C의 냉동고로 옮깁니다. 신선하고 실행 가능한 종양 조직 및 ANT 샘플은 이전 기술 10 , 11의 변형을 사용하여 배양 한 다음 저온 보존합니다. 수집하는 동안 각 샘플 유형의 번호는 스프레드 시트에 기록되기 전에 기록됩니다 재고 추적 프로그램은 정확한 처리를 용이하게합니다 ( 표 1 ).
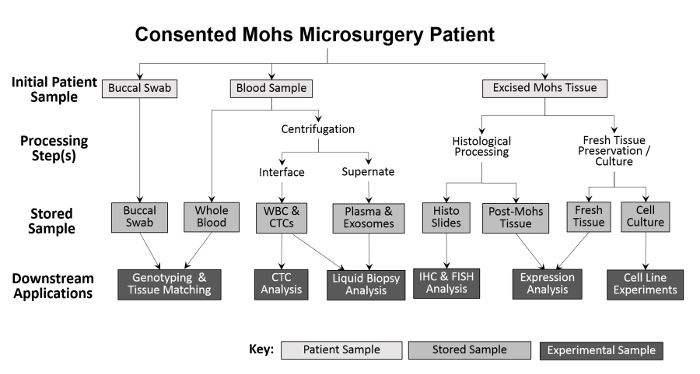
도표 2 : 진료소 근거한 biorepository 견본 수집과 가공의 개관. 환자에게서 협측 면봉과 혈액 샘플을 수집하여 다운 스트림 genotyping과 조직 매칭을 위해 보관합니다. 전혈은 백혈구 (WBC) 분리 및 CTC 분석뿐만 아니라 혈장 수집 및 액체 생검 분석을 위해 추가 처리됩니다. Mohs 절차 중에 절제 한 조직을 진단 목적으로 조직 학적으로 처리 한 후 조직학 슬라이드를 면역 조직 화학 분석을 위해 실험적으로 사용할 수 있습니다. 절제 된 조직 샘플이 충분히 큰 경우, 신선한 조직의 일부를 제거하고 단백질 및 RNA 분리 및 배양 된 세포주를 확립하기 위해 절단한다.55583 / 55583fig1large.jpg "target ="_ blank ">이 그림의 확대 버전을 보려면 여기를 클릭하십시오.
| 컬렉션 날짜 : | |||||
| 환자 1 | 환자 2 | 환자 3 | 환자 4 | 환자 5 | |
| 이니셜 및 생년월일 | |||||
| 눈 색깔 | |||||
| 샘플 유형 | |||||
| 샘플 위치 | |||||
| 타액 | |||||
| 승구멍 혈액 | |||||
| 혈장 | |||||
| 유력한 종양 | |||||
| 조직 생체 적합성 | |||||
| 종양 모스 액체 질소 | |||||
| 조직 일반 액체 질소 | |||||
| 슬라이드 |
표 1 : 샘플 수집을 기록하기위한 체크리스트. 수집 된 각 샘플과 함께 추적되고 기록 된 데이터에는 환자의 머리 글자, 생년월일, 눈색 (피부 유형의 경우), 로케티on 표본 제거. 타액 샘플 수, 혈액 수집 체적 및 수집 된 생존 및 보존 된 조직 검체 수 또한 추후 사용을위한 참고 자료로 기록됩니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
샘플 수집 절차의 유효성을 확인하기 위해 각 샘플 유형은 다운 스트림 어플리케이션에서 테스트되었습니다. 이전 기술 12의 수정을 사용하여, 종양 및 ANT는 단백질 및 RNA 분리에 성공적으로 사용되었으며 잠재적으로 DNA 분리에 사용될 수 있습니다. 조직 절편으로부터 확립 된 생체 외편은 현미경으로 평가되었으며, 보존 된 조직 슬라이드는 면역 조직 화학과 면역 형광 검사에 사용되었다.
여기에 설명 된 프로토콜을 따르면이 모델을 다른 피부과 진료소, 다른 종양 유형 (예 : 흑색 종)으로 확장 할 수 있습니다., 그리고 인간 암에 대한 다방면 연구를위한 인간 조직 샘플을 제공하는 기타 외과 전문 분야 및 관행. 이 프로토콜의 약간의 수정은 다른 관행에 필수적 일 수 있지만 원칙적으로이 프로토콜은 환자 치료 과정에서 수집 된 환자 샘플을 정기적으로 폐기하는 모든 수술에 적용 할 수 있습니다.
Protocol
Representative Results
Discussion
저자의 지식에 따르면이 프로토콜은 비용 효율적이고 빠른 접근 방식으로 피부 조직 샘플을 임상 적으로 조달하는 데 주력하는 최초의 제품입니다. Mohs 미세 수술을받는 환자는 일반적으로 특정 시간대에 예정되며 수집은이 기간으로 제한됩니다. 샘플 채취에는 환자 관리에 종사하는 의료 보조원, 종양 샘플을 처리하는 모스 (Mohs) histotechnologist 및 샘플 진입 및 혈액 처리를 담당하는 지정 실험실…
Divulgations
The authors have nothing to disclose.
Acknowledgements
이 연구는 중서부 대학 건강 과학 연구 촉진 기금, EEH 수여, Midwestern University Office of Research 및 후원 프로그램 교내 기금, KJL에게 수여되었습니다. Affiliated Laboratories 및 Affiliated Dermatology에서 추가 지원을 제공했습니다. 기술 지원을 위해 Sarah Potekhen, Jamie Barto, Stefani Fawks, Cody Jording, Stacie Schimke, Heather Kissel 및 Ali Zaidi에게 감사드립니다.
Materials
| BD Vacutainer Plastic Blood Collection Tubes with K3EDTA | ThermoFisher Scientific | 02-685-2B | |
| Electron Microscopy Sciences Double Edge Blades | ThermoFisher Scientific | 50-949-411 | |
| Curved Medium Point General Purpose Forceps | ThermoFisher Scientific | 16-100-110 | |
| Premium Microcentrifuge Tubes | ThermoFisher Scientific | 05-408-138 | |
| Lonza Walkersville KGM Keratinocyte Medium | ThermoFisher Scientific | NC9791321 | |
| Electron Microscopy Sciences Tissue TEK OCT Compound | ThermoFisher Scientific | 50-363-579 | |
| Leica CM1950 Cryostat | Leica Biosystems | 14047743909 | |
| Frosted Microscope Slides | ThermoFisher Scientific | 12-550-343 | |
| Shandon Rapid-Chrome H&E Frozen Section Staining Kit | ThermoFisher Scientific | 99-900-01 | |
| Nalgene Long-Term Storage Cryogenic Tubes | ThermoFisher Scientific | 03-337-7X | |
| Falcon 15 mL Conical Centrifuge Tubes | ThermoFisher Scientific | 14-959-53A | |
| Boca Scientific BuccalT-Swab | ThermoFisher Scientific | NC9679349 | |
| Cell Signaling Technology 10x RIPA Buffer | ThermoFisher Scientific | 50-195-822 | |
| Halt Protease and Phosphatase Inhibitor Cocktail | ThermoFisher Scientific | PI78443 | |
| Eppendorf 5424R Microcentrifuge | ThermoFisher Scientific | 05-401-203 | |
| Pellet Morter Cordless Homogenizer | ThermoFisher Scientific | 12-141-3 | |
| RNAse Free Pellet Pestle | ThermoFisher Scientific | 121-141-364 | |
| Forma SteriCycle CO2 Incubator | ThermoFisher Scientific | 13-998-089 | |
| HyClone Fetal Bovine Serum | ThermoFisher Scientific | SH30071.02 | |
| Gibco Advanced DMEM/F-12 | ThermoFisher Scientific | 12-634-028 | |
| Gibco Penicillin-Streptomycin | ThermoFisher Scientific | 15140148 | |
| Gibco 1M Hepes | ThermoFisher Scientific | 15-630-130 | |
| Nunc Cell Culture 35 mm with Vent | ThermoFisher Scientific | 1256591 | |
| Anti-CFH monoclonal antibody clone OX-24 | Abnova | MAB12583 | |
| Anti-p40 (p63 delta) antibody | Abnova | ABX-144A | |
| Anti MUC-1 antibody | Santa Cruz Biotech | sc-7313 | |
| Anti-Snail + Slug (phospho S246) | Abcam | Ab63568 | |
| Goat anti-rabbit IgG, Alexa Fluor 488 | Invitrogen | A-11034 | |
| Alexa Fluor 568 Phallodin | Molecular Probes | A12380 | |
| ProLong Gold Antifade Mountant with DAPI | Molecular Probes | P36941 | |
| Zeiss Axio Imager Z1 Microscope with Axiocam camera | Zeiss | 4300009901 | |
| Olympus IX51 phase contrast with DP72 camera | Olympus | IX511F3 |
References
- Baker, M. Biorepositories: Building better biobanks. Nature. 486, 141-146 (2012).
- Ambrosone, C. B., Nesline, M. K., Davis, W. Establishing a cancer center data bank and biorepository for multidisciplinary research. Cancer Epidemiol Biomarkers Prev. 15, 1575-1577 (2006).
- Baird, P. M., Gunter, E. W., Vaught, J. Building a biobank. Biopreserv Biobank. 14, 87-88 (2016).
- Caixeiro, N. J., Lai, K., Lee, C. S. Quality assessment and preservation of RNA from biobank tissue specimens: a systematic review. J Clin Pathol. 69, 260-265 (2016).
- Campbell, L. D., et al. Development of the ISBER best practices for repositories: Collection, storage, retrieval and distribution of biological materials for research. Biopreserv Biobank. 10, 232-233 (2012).
- Neumeister, V. M. Tools to assess tissue quality. Clin Biochem. 47, 280-287 (2014).
- Vaught, J., et al. An NCI perspective on creating sustainable biospecimen resources. J Natl Cancer Inst Monogr. 2011, 1-7 (2011).
- Fu, T., Aasi, S. Z., Hollmig, S. T. Management of high-risk squamous cell carcinoma of the skin. Curr Treat Options Oncol. 17, (2016).
- Rasmussen, C., Thomas-Virnig, C., Allen-Hoffmann, B. L. Classical human epidermal keratinocyte cell culture. Methods Mol Biol. 945, 161-175 (2013).
- Purdie, K. J., Pourreyron, C., South, A. P. Cancer cell culture: Methods and protocols. , 151-159 (2011).
- Berglund, S. R., Schwietert, C. W., Jones, A. A., Stern, R. L., Lehman, J., Goldberg, Z. Optimized methodology for sequential extraction of RNA and protein from small human skin biopsies. J Invest Dermatol. 127, 349-353 (2007).
- Schroeder, A., et al. The RIN: an RNA integrity number for assigning integrity values to RNA measurements. BMC Mol Biol. 7, 1-14 (2006).
- Cooper, H. L., et al. Expression and glycosylation of MUC1 in epidermolysis bullosa-associated and sporadic cutaneous squamous cell carcinomas. Br J Dermatol. 151, 540-545 (2004).
- Riihila, P. M., et al. Complement factor H: a biomarker for progression of cutaneous squamous cell carcinoma. J Invest Dermatol. 134, 498-506 (2014).
- Ha Lan, T. T., et al. Expression of the p40 isoform of p63 has high specificity for cutaneous sarcomatoid squamous cell carcinoma. J Cutan Pathol. 41, 831-838 (2014).
- Alomari, A. K., Glusac, E. J., McNiff, J. M. p40 is a more specific marker than p63 for cutaneous poorly differentiated squamous cell carcinoma. J Cutan Pathol. 41, 839-845 (2014).
- Qiao, B., Johnson, N. W., Gao, J. Epithelial-mesenchymal transition in oral squamous cell carcinoma triggered by transforming growth factor-beta1 is Snail family-dependent and correlates with matrix metalloproteinase-2 and -9 expressions. Int J Oncol. 37, 663-668 (2010).
- Vaught, J. Developments in biospecimen research. Br Med Bull. 114, 29-38 (2015).

