إنشاء مستودع حيوي قائم على العيادة
Summary
وغالبا ما يتم التخلص من الأورام الجلدية بعد جراحة ميكروغرافيك موس. يتم وصف بروتوكول هنا أن تمكن موظفي الدعم السريري لمعالجة وتخزين الورم الجلدي على نحو فعال (على سبيل المثال، سرطان الخلايا الحرشفية ، سرطان الخلايا القاعدية، وسرطان الجلد) عينات لتطبيقات المختبر المصب دون التدخل في العمليات السريرية.
Abstract
وازدادت حالات الإصابة بسرطان الجلد ( مثل سرطان الخلايا الحرشفية وسرطان الخلايا القاعدية وسرطان الجلد) خلال السنوات القليلة الماضية. ومن المتوقع أن يكون هناك طلب مواز لعينات الورم الجلدية للدراسات البحثية الطبية الحيوية. غير أن توافر الأنسجة محدود نظرا لتكلفة إنشاء مستودع حيوي وعدم وجود بروتوكولات متاحة للحصول على عينات سريرية لا تتداخل مع العمليات السريرية. تم إنشاء بروتوكول لجمع ومعالجة الورم الجلدي وعينات الدم واللعاب المرتبطة به والتي لها تأثير ضئيل على الإجراءات السريرية الروتينية في تاريخ جراحة موس. يتم جمع عينات الورم ومعالجتها من المرضى الذين يخضعون لطبقتهم الأولى من جراحة موس للأمراض الخبيثة الجلدية ثبت خزعة من قبل مهندس الهستولوجيا موس. يتم جمع الأنسجة العادية المجاورة في وقت إغلاق الجراحية. العينات الإضافية التي يمكن جمعها هي مسحات كاملة الدم والشدق. من خلال استخدام عينات الأنسجة التي يتم التخلص منها عادة، تم إنشاء مستودع حيوي يقدم العديد من المزايا الرئيسية من خلال أن يكون مقرها في العيادة مقابل إعداد المختبر. وتشمل هذه مجموعة واسعة من العينات التي تم جمعها. الوصول إلى سجلات المرضى التي تم تحديدها، بما في ذلك تقارير علم الأمراض؛ والجهات المانحة النموذجية، الحصول على عينات إضافية خلال زيارات المتابعة.
Introduction
يعتمد السرطان وعلامات العلامات البيولوجية على العرض من عينات الأنسجة البشرية ذات الجودة العالية، وقد أعاق العرض المحدود البحث 1 ، 2 . العديد من الدراسات الجلدية محدودة بسبب عدم كفاية العرض، ونوعية متغيرة، والتكاليف المرتبطة باستخدام الأنسجة البشرية. وقدرت تكلفة إنشاء بنك بيوبانك كبير ومكرس بما يقرب من مليوني دولار 3 ، وهذه التكاليف تضع استخدام الأنسجة البشرية بعيدا عن متناول العديد من الباحثين. وعلاوة على ذلك، فإن عملية توليد وتخزين عينات البحوث تشكل خطرا على التأثير على العمليات السريرية وتأخير رعاية المرضى إذا لم يتم تنفيذها بعناية. وقد تم إنشاء مستودع حيوي فعال من حيث التكلفة ومستند إلى العيادة يركز على عينات سرطان الجلد بعد اتباع أفضل الممارسات الموصى بها والتحقق من صحة العينة 4 و 5 و 6 .
<pكلاس = "jove_content"> وقد تم تطوير هذا البروتوكول في عيادة الأمراض الجلدية التي تؤدي حجم كبير من العمليات الجراحية ميكروغرافيك موس لإزالة سرطان الخلايا الحرشفية (شك)، وسرطان الخلايا القاعدية (بسك)، وسرطان الجلد سرطان الجلد. ويمكن تجنيد المانحين المتطوعين من هذا العدد من المرضى. من المهم إنشاء مستودع حيوي في موقع جمع لالتقاط بسرعة الأنسجة والدم من المرضى موافق عليها دون تأخير العلاج. جمع عينات من نفس العيادة يقلل من الاختلافات في تقنيات الجمع ويقلل من الاختلافات في نوعية العينات، والتي يمكن أن تكون مشكلة للتطبيقات المصب 7 ، 8 .والهدف من تقنية الجراحة المجهرية موس هو التأكد من إزالة جميع الأنسجة السرطانية مع الحفاظ على أكبر قدر ممكن من الأنسجة السليمة. الإجراء ينطوي على الإزالة التدريجية للطبقات الرقيقة من أنسجة الورم. كل طبقة متعاقبة لهفحص (بعد كريوسكتيونينغ الأنسجة الورم وأداء H & E تلطيخ) من قبل طبيب الأمراض الجلدية لتحديد ما إذا كان قد تم إزالة جميع الأنسجة السرطانية. يتم تنفيذ استئصال وفحص الطبقات اللاحقة من الأنسجة في حين يبقى المريض في المكتب. وتعتبر هذه التقنية الخيار الأفضل لعلاج شك 9 . عند هذه النقطة، يتم إغلاق الجرح، لتحسين الشفاء والمظهر التجميلي، والأنسجة العادية المجاورة (أنت) في كثير من الأحيان استئصال. وبالتالي، فإن هذا الإجراء الجراحي لإزالة الورم هو مثالي مثالي لجمع الأنسجة نسيجيا للدراسات المستقبلية.
وقد تم تصميم إجراءات الشراء للحصول على أنسجة الورم، الأنسجة الطبيعية المجاورة، اللعاب، وعينات الدم ليكون لها تأثير ضئيل على واجبات الموظفين العادية ( الشكل 1 ). ويقوم المساعدين الطبيين بإجراء عمليات سحب الدم أثناء تحضير المريض للإجراء. بعد الانتهاء من إجراء موس، و M أوهس هيستوتيشنولوجيست إعداد شرائح نسيجية إضافية من العينة ونقل الأنسجة إلى مستودع حيوي. وتشمل التكاليف المرتبطة بإنشاء مستودع حيوي شراء مجمدات للحفظ بالتبريد، وإنشاء حيز مختبر طبي متواضع، ووضع برنامج لتتبع المخزون.
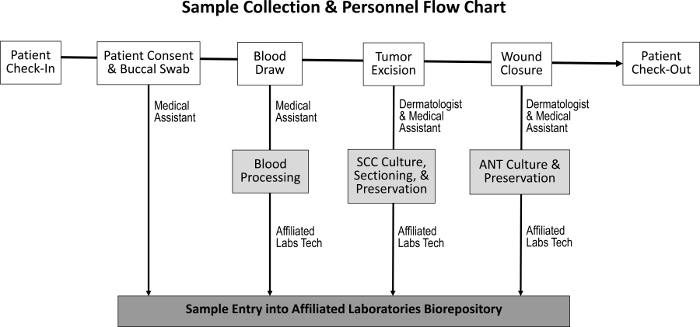
الشكل 1: تسلسل جمع العينات والموظفين المسؤولين. عند تسجيل المريض والحصول على موافقة المريض، يقوم المساعد الطبي بجمع مسحة الشدق وإجراء عملية سحب الدم. طبيب الأمراض الجلدية والمساعد الطبي ثم استئصال الورم وإغلاق الجرح، وخلال ذلك الوقت يتم جمع شك و أنت العينات، على التوالي. يقوم فني مختبرات متخصص بمعالجة الدم والأقسام عينات شك و أنت لثقافة الأنسجة، وحفظها، والدخول في مستودع حيوي.ftp_upload / 55583 / 55583fig1large.jpg "تارجيت =" _ بلانك "> الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
تنوع العينات التي تم جمعها تمكن مجموعة متنوعة من النهج التجريبية ( الشكل 2 ). العينات التي تم جمعها من المريض هي مسحات الشدق (اللعاب ويمكن أيضا أن تجمع إذا لزم الأمر)، والدم الكامل، والأنسجة استئصال. يتم حفظ مسحات الشدق وعينة من الدم كله، من دون معالجة، من أجل التنميط الجيني والأنسجة مطابقة. يتم فصل الدم الكامل إلى خلايا الدم البيضاء (وك) وكسور البلازما للتحليلات المستقبلية. بعد تجهيز موهس، يتم وضع الورم المجمد مباشرة في النيتروجين السائل ونقلها إلى الفريزر -80 درجة مئوية. يتم استزراع جديدة، الأنسجة الورم قابلة للحياة وعينات أنت باستخدام تعديلات التقنيات السابقة 10 ، 11 ثم كريوبريزرفيد. أثناء التجميع، يتم تسجيل عدد كل نوع من أنواع العينات على جدول بيانات قبل الدخول إلى برنامج تتبع المخزون لتيسير المعالجة الدقيقة ( الجدول 1 ).
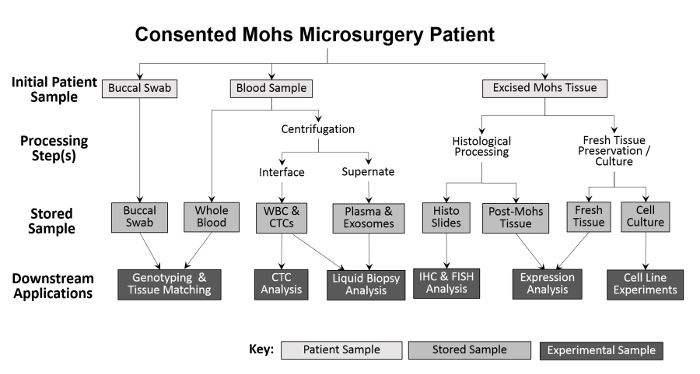
الشكل 2: الخطوط العريضة لجمع العينات البيولوجية المستندة إلى العيادة ومعالجتها. يتم جمع مسحة الشدق وعينة الدم من المريض وتخزينها للتوليف الجيني والمطابقة الأنسجة. يتم معالجة الدم الكامل أيضا لعزل خلايا الدم البيضاء (وك) وتحليل كتك، وكذلك لجمع البلازما وتحليل خزعة السائل. الأنسجة استئصال خلال إجراء موس يتم معالجتها نسيجيا لأغراض التشخيص، وبعد ذلك الشرائح نسيجية يمكن استخدامها تجريبيا لمزيد من التحليلات المناعية. شريطة أن عينة الأنسجة استئصال كبيرة بما فيه الكفاية، يتم إزالة جزء من الأنسجة الطازجة ومقطوع للبروتين وعزل الحمض النووي الريبي، وإنشاء خطوط الخلايا المستزرعة.55583 / 55583fig1large.jpg "تارجيت =" _ بلانك "> الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
| تاريخ المجموعة: | |||||
| المريض 1 | المريض 2 | المريض 3 | المريض 4 | المريض 5 | |
| البدايات وتاريخ الميلاد | |||||
| لون العين | |||||
| نوع العينة | |||||
| موقع العينة | |||||
| لعاب | |||||
| Wثقب الدم | |||||
| بلازما | |||||
| الورم فيابل | |||||
| الأنسجة عادي قابل للحياة | |||||
| الورم موهس النيتروجين السائل | |||||
| الأنسجة العادية النيتروجين السائل | |||||
| الشرائح |
الجدول 1: قائمة مرجعية لتسجيل مجموعات العينات. البيانات التي تم تتبعها وتسجيلها مع كل عينة تم جمعها تشمل الأحرف الأولى للمريض، وتاريخ الميلاد، ولون العين (للطباعة الجلد)، وكذلك الموقععلى إزالة العينة. كما يتم تسجيل عدد لعينات اللعاب، وأحجام جمع الدم، وعدد من عينات الأنسجة قابلة للحياة والحفاظ عليها التي تم جمعها كمراجع للمخصصات لاستخدامها لاحقا. الرجاء النقر هنا لتحميل هذا الملف.
للتحقق من صحة إجراءات جمع العينات، تم اختبار كل نوع من عينات في التطبيقات المصب. باستخدام التعديلات من التقنيات السابقة 12 ، الورم و أنت قد استخدمت بنجاح في البروتين وعزل الحمض النووي الريبي ويمكن أن تستخدم لعزل الحمض النووي. وقد تم تقييم إإكسبلنتس قابلة للحياة أنشئت من أقسام الأنسجة عن طريق الفحص المجهري، في حين تم استخدام الشرائح النسيجية المخزنة لالمناعية والمناعي.
من خلال اتباع بروتوكول الموصوفة هنا، فمن الممكن لتوسيع هذا النموذج إلى عيادات الأمراض الجلدية الأخرى، وأنواع الورم الأخرى (مثل سرطان الجلد)، وغيرها من التخصصات والممارسات الجراحية لتوفير عينات الأنسجة البشرية للأبحاث متعددة الأوجه في سرطان الإنسان. التعديلات الطفيفة من هذا البروتوكول من المرجح أن تكون ضرورية لممارسات أخرى ولكن، من حيث المبدأ، وهذا البروتوكول ينطبق على أي ممارسة الجراحية التي تتجاهل بشكل روتيني عينات المريض التي تم جمعها في سياق علاج المريض.
Protocol
Representative Results
Discussion
إلى علم المؤلف، وهذا البروتوكول هو الأول من نوعه الذي يركز على المشتريات السريرية من عينات الأنسجة الجلدية في كل من نهج فعالة من حيث التكلفة وسريعة. وعادة ما يتم تحديد المرضى الذين يخضعون لجراحة المجهرية موه خلال فترات محددة من الزمن، ويقتصر جمع هذه الفترات. جمع العي…
Disclosures
The authors have nothing to disclose.
Acknowledgements
وأيد هذا العمل من أموال من جامعة ميدوسترن كلية العلوم الصحية منحة تسهيل البحوث، منحت ل إيه، ومكتب جامعة ميدوسترن للبحوث والبرامج برعاية منحة الداخلية، التي منحت ل كيل. وقدمت دعما إضافيا من قبل المختبرات التابعة والأمراض الجلدية التابعة لها. نشكر سارة بوتيكين، جيمي بارتو، ستيفاني فوكس، كودي جوردينغ، ستاسي شيمكي، هيذر كيسيل، وعلي زايدي على مساعدتهم التقنية.
Materials
| BD Vacutainer Plastic Blood Collection Tubes with K3EDTA | ThermoFisher Scientific | 02-685-2B | |
| Electron Microscopy Sciences Double Edge Blades | ThermoFisher Scientific | 50-949-411 | |
| Curved Medium Point General Purpose Forceps | ThermoFisher Scientific | 16-100-110 | |
| Premium Microcentrifuge Tubes | ThermoFisher Scientific | 05-408-138 | |
| Lonza Walkersville KGM Keratinocyte Medium | ThermoFisher Scientific | NC9791321 | |
| Electron Microscopy Sciences Tissue TEK OCT Compound | ThermoFisher Scientific | 50-363-579 | |
| Leica CM1950 Cryostat | Leica Biosystems | 14047743909 | |
| Frosted Microscope Slides | ThermoFisher Scientific | 12-550-343 | |
| Shandon Rapid-Chrome H&E Frozen Section Staining Kit | ThermoFisher Scientific | 99-900-01 | |
| Nalgene Long-Term Storage Cryogenic Tubes | ThermoFisher Scientific | 03-337-7X | |
| Falcon 15 mL Conical Centrifuge Tubes | ThermoFisher Scientific | 14-959-53A | |
| Boca Scientific BuccalT-Swab | ThermoFisher Scientific | NC9679349 | |
| Cell Signaling Technology 10x RIPA Buffer | ThermoFisher Scientific | 50-195-822 | |
| Halt Protease and Phosphatase Inhibitor Cocktail | ThermoFisher Scientific | PI78443 | |
| Eppendorf 5424R Microcentrifuge | ThermoFisher Scientific | 05-401-203 | |
| Pellet Morter Cordless Homogenizer | ThermoFisher Scientific | 12-141-3 | |
| RNAse Free Pellet Pestle | ThermoFisher Scientific | 121-141-364 | |
| Forma SteriCycle CO2 Incubator | ThermoFisher Scientific | 13-998-089 | |
| HyClone Fetal Bovine Serum | ThermoFisher Scientific | SH30071.02 | |
| Gibco Advanced DMEM/F-12 | ThermoFisher Scientific | 12-634-028 | |
| Gibco Penicillin-Streptomycin | ThermoFisher Scientific | 15140148 | |
| Gibco 1M Hepes | ThermoFisher Scientific | 15-630-130 | |
| Nunc Cell Culture 35 mm with Vent | ThermoFisher Scientific | 1256591 | |
| Anti-CFH monoclonal antibody clone OX-24 | Abnova | MAB12583 | |
| Anti-p40 (p63 delta) antibody | Abnova | ABX-144A | |
| Anti MUC-1 antibody | Santa Cruz Biotech | sc-7313 | |
| Anti-Snail + Slug (phospho S246) | Abcam | Ab63568 | |
| Goat anti-rabbit IgG, Alexa Fluor 488 | Invitrogen | A-11034 | |
| Alexa Fluor 568 Phallodin | Molecular Probes | A12380 | |
| ProLong Gold Antifade Mountant with DAPI | Molecular Probes | P36941 | |
| Zeiss Axio Imager Z1 Microscope with Axiocam camera | Zeiss | 4300009901 | |
| Olympus IX51 phase contrast with DP72 camera | Olympus | IX511F3 |
References
- Baker, M. Biorepositories: Building better biobanks. Nature. 486, 141-146 (2012).
- Ambrosone, C. B., Nesline, M. K., Davis, W. Establishing a cancer center data bank and biorepository for multidisciplinary research. Cancer Epidemiol Biomarkers Prev. 15, 1575-1577 (2006).
- Baird, P. M., Gunter, E. W., Vaught, J. Building a biobank. Biopreserv Biobank. 14, 87-88 (2016).
- Caixeiro, N. J., Lai, K., Lee, C. S. Quality assessment and preservation of RNA from biobank tissue specimens: a systematic review. J Clin Pathol. 69, 260-265 (2016).
- Campbell, L. D., et al. Development of the ISBER best practices for repositories: Collection, storage, retrieval and distribution of biological materials for research. Biopreserv Biobank. 10, 232-233 (2012).
- Neumeister, V. M. Tools to assess tissue quality. Clin Biochem. 47, 280-287 (2014).
- Vaught, J., et al. An NCI perspective on creating sustainable biospecimen resources. J Natl Cancer Inst Monogr. 2011, 1-7 (2011).
- Fu, T., Aasi, S. Z., Hollmig, S. T. Management of high-risk squamous cell carcinoma of the skin. Curr Treat Options Oncol. 17, (2016).
- Rasmussen, C., Thomas-Virnig, C., Allen-Hoffmann, B. L. Classical human epidermal keratinocyte cell culture. Methods Mol Biol. 945, 161-175 (2013).
- Purdie, K. J., Pourreyron, C., South, A. P. Cancer cell culture: Methods and protocols. , 151-159 (2011).
- Berglund, S. R., Schwietert, C. W., Jones, A. A., Stern, R. L., Lehman, J., Goldberg, Z. Optimized methodology for sequential extraction of RNA and protein from small human skin biopsies. J Invest Dermatol. 127, 349-353 (2007).
- Schroeder, A., et al. The RIN: an RNA integrity number for assigning integrity values to RNA measurements. BMC Mol Biol. 7, 1-14 (2006).
- Cooper, H. L., et al. Expression and glycosylation of MUC1 in epidermolysis bullosa-associated and sporadic cutaneous squamous cell carcinomas. Br J Dermatol. 151, 540-545 (2004).
- Riihila, P. M., et al. Complement factor H: a biomarker for progression of cutaneous squamous cell carcinoma. J Invest Dermatol. 134, 498-506 (2014).
- Ha Lan, T. T., et al. Expression of the p40 isoform of p63 has high specificity for cutaneous sarcomatoid squamous cell carcinoma. J Cutan Pathol. 41, 831-838 (2014).
- Alomari, A. K., Glusac, E. J., McNiff, J. M. p40 is a more specific marker than p63 for cutaneous poorly differentiated squamous cell carcinoma. J Cutan Pathol. 41, 839-845 (2014).
- Qiao, B., Johnson, N. W., Gao, J. Epithelial-mesenchymal transition in oral squamous cell carcinoma triggered by transforming growth factor-beta1 is Snail family-dependent and correlates with matrix metalloproteinase-2 and -9 expressions. Int J Oncol. 37, 663-668 (2010).
- Vaught, J. Developments in biospecimen research. Br Med Bull. 114, 29-38 (2015).

