Création d'un biorepository basé sur une clinique
Summary
Les tumeurs cutanées sont souvent éliminées suite à la chirurgie micrographique de Mohs. Un protocole est décrit ici qui permet au personnel de soutien clinique de traiter et de stocker efficacement les échantillons de tumeur cutanée ( p. Ex., Carcinome épidermoïde, carcinome basique et mélanome) pour des applications en laboratoire en aval sans interférer avec les opérations cliniques.
Abstract
L'incidence du cancer de la peau ( p. Ex., Carcinome épidermoïde, carcinome basocellulaire et mélanome) a augmenté au cours des dernières années. On s'attend à ce qu'il y ait une demande parallèle pour les échantillons de tumeurs cutanées pour des études de recherche biomédicales. La disponibilité des tissus, cependant, est limitée en raison du coût de l'établissement d'un biorepository et du manque de protocoles disponibles pour l'obtention d'échantillons cliniques qui n'interfèrent pas avec les opérations cliniques. Un protocole a été établi pour collecter et traiter la tumeur cutanée et les échantillons de sang et de salive associés qui ont un impact minimal sur les procédures cliniques de routine à la date de la chirurgie de Mohs. Les échantillons de tumeurs sont recueillis et traités à partir de patients subissant leur première couche de chirurgie de Mohs pour des tumeurs malignes cutanées éprouvées par biopsie par l'histotechnologiste de Mohs. Le tissu normal adjacent est recueilli au moment de la fermeture chirurgicale. Des échantillons supplémentaires qui peuvent être collectés sont des écouvillons sanguins et buccales. En utilisant des échantillons de tissus qui sont normalement rejetés, un biorepository a été généré qui offre plusieurs avantages clés en étant basé dans la clinique par rapport au paramètre de laboratoire. Ceux-ci incluent une large gamme d'échantillons collectés; Accès aux dossiers de patients identifiés, y compris les rapports de pathologie; Et, pour le donneur typique, accéder à des échantillons supplémentaires lors des visites de suivi.
Introduction
La recherche sur le cancer et les biomarqueurs repose sur une offre d'échantillons de tissus humains de qualité, et une offre limitée a entravé la recherche 1 , 2 . De nombreuses études dermatologiques sont limitées par l'offre insuffisante, la qualité variable et les coûts associés à l'utilisation du tissu humain. Le coût de l'établissement d'une importante biobanche dédiée a été estimé à environ deux millions de dollars 3 , et ces coûts mettent l'utilisation des tissus humains hors de la portée de nombreux chercheurs. En outre, le processus de génération et de stockage d'échantillons de recherche pose le risque d'affecter les opérations cliniques et de retarder les soins aux patients, si cela n'est pas soigneusement exécuté. Un biorepository basé sur une clinique rentable a été établi qui se concentre sur les échantillons de cancer de la peau selon les meilleures pratiques recommandées et la validation des échantillons 4 , 5 , 6 .
<pClass = "jove_content"> Ce protocole a été développé dans une clinique de dermatologie qui effectue un grand volume de chirurgies micrographiques de Mohs pour éliminer le carcinome épidermoïde (SCC), le cancer de base (BCC) et les cancers de la peau du mélanome. Les bailleurs de fonds volontaires peuvent être recrutés auprès de cette population de patients. Il est important d'établir le biorepository sur le site de collecte pour capturer rapidement les tissus et le sang des patients consentis sans délai de traitement. La collecte d'échantillons de la même clinique minimise les variations dans les techniques de collecte et minimise les variations de la qualité des échantillons, ce qui peut poser problème aux applications en aval 7 , 8 .L'objectif de la technique de la chirurgie micrographique de Mohs est de s'assurer que tout le tissu cancéreux est éliminé tout en préservant autant de tissus sains que possible. La procédure implique l'élimination progressive de couches minces de tissu tumoral. Chaque couche successive est son(Après avoir critisé le tissu tumoral et réalisé une coloration H & E) par un dermatologue pour déterminer si tous les tissus cancéreux ont été enlevés. L'excision et l'examen des couches subséquentes de tissus sont exécutés alors que le patient reste dans le bureau. Cette technique est considérée comme la meilleure option de traitement pour SCC 9 . À ce stade, la plaie est fermée et, pour améliorer la guérison et l'apparence esthétique, le tissu normal adjacent (ANT) est souvent excisé. Ainsi, cette procédure chirurgicale pour éliminer une tumeur est idéale pour la collecte de tissu histologiquement caractérisé pour des études futures.
La procédure de passation des marchés pour l'obtention de tissus tumoraux, des tissus normaux adjacents, de la salive et du sang a été conçue pour avoir un impact minimal sur les tâches normales du personnel ( figure 1 ). Les assistants médicaux effectuent les tirages sanguins tout en préparant le patient pour la procédure. Après l'achèvement de la procédure Mohs, le M Oh histotechnologist prépare des diapositives histologiques supplémentaires du spécimen et transfère le tissu au biorepository. Les coûts associés à l'établissement du biorepository comprennent l'achat de congélateurs à cryoconservation, la création d'un espace de laboratoire clinique modeste et le développement d'un programme de suivi des stocks.
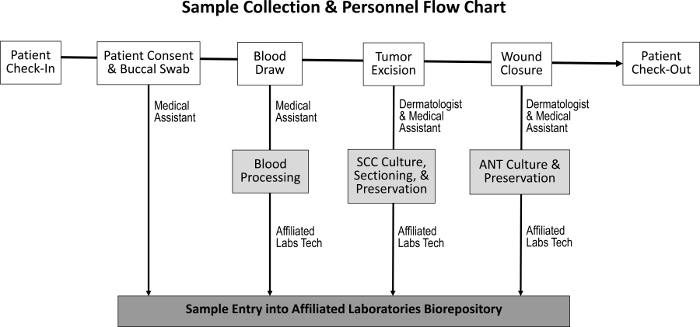
Figure 1: Séquence de la collecte des échantillons et du personnel responsable. Lors de l'enregistrement des patients et de l'obtention du consentement du patient, l'assistant médical collecte un prélèvement buccal et effectue un prélèvement sanguin. Le dermatologue et l'assistant médical excises la tumeur et ferment la plaie, au cours duquel les échantillons SCC et ANT sont collectés, respectivement. Un technicien de laboratoire spécialisé traite le sang et les sections des spécimens SCC et ANT pour la culture tissulaire, la préservation et l'entrée dans le biorepository.Ftp_upload / 55583 / 55583fig1large.jpg "target =" _ blank "> Cliquez ici pour voir une version plus grande de cette figure.
La diversité des échantillons collectés permet une variété d'approches expérimentales ( figure 2 ). Les échantillons recueillis auprès du patient sont des écouvillons buccaux (la salive peut également être recueillie si nécessaire), du sang entier et du tissu excisé. Les écouvillons buccaux et un échantillon de sang entier sont sauvegardés, sans traitement, pour le génotypage et l'appariement des tissus. Le sang entier est séparé en globules blancs (WBC) et les fractions de plasma pour des analyses futures. Après le traitement de Mohs, la tumeur congelée est placée directement dans de l'azote liquide et transférée à un congélateur de -80 ° C. Les tissus tumoraux frais et viables et les échantillons ANT sont cultivés en utilisant des modifications des techniques précédentes 10 , 11 puis cryoconservées. Pendant la collecte, le nombre de chaque type d'échantillon est enregistré sur une feuille de calcul avant l'entrée dans Le programme de suivi des stocks pour faciliter un traitement précis ( tableau 1 ).
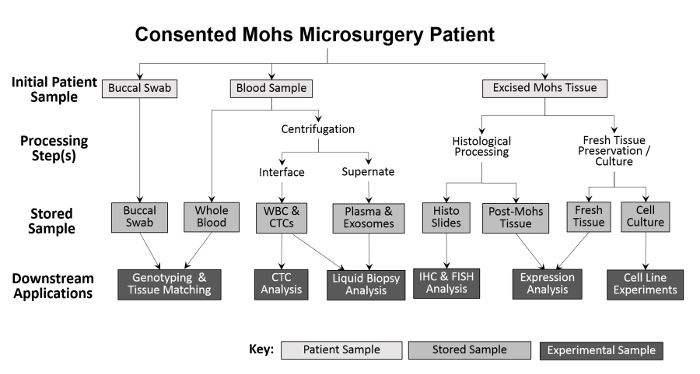
Figure 2: Résumé de la collecte et du traitement des échantillons biologiques à base de clinique. Un prélèvement buccal et un échantillon de sang sont recueillis auprès du patient et stockés pour le génotypage en aval et l'appariement des tissus. Le sang entier est ensuite traité pour l'isolement des globules blancs (WBC) et l'analyse CTC, ainsi que pour la collecte plasma et l'analyse de la biopsie liquide. Le tissu excisé pendant la procédure Mohs est traité histologiquement à des fins diagnostiques, après quoi les diapositives histologiques peuvent être utilisées expérimentalement pour d'autres analyses immunohistochimiques. Pourvu que l'échantillon de tissu excisé soit suffisamment grand, une partie de tissu frais est enlevée et sectionnée pour l'isolement de protéines et d'ARN et pour l'établissement de lignées cellulaires cultivées.55583 / 55583fig1large.jpg "target =" _ blank "> Cliquez ici pour voir une version plus grande de cette figure.
| Date de collecte: | |||||
| Patient 1 | Patient 2 | Patient 3 | Patient 4 | Patient 5 | |
| Initiales et date de naissance | |||||
| Couleur des yeux | |||||
| Échantillon type | |||||
| Emplacement de l'échantillon | |||||
| Salive | |||||
| WTrou sang | |||||
| Plasma | |||||
| Tumoral viable | |||||
| Tissu Normal Viable | |||||
| Tumeur Mohs Nitrogen Liquide | |||||
| Tissue Normal Nitrogen Liquide | |||||
| Diapositives |
Tableau 1: Liste de contrôle pour enregistrer les collections d'échantillons. Les données suivies et enregistrées avec chaque échantillon recueilli comprennent les initiales du patient, la date de naissance et la couleur des yeux (pour la typage de la peau), ainsi que la localisationSur l'enlèvement de l'échantillon. Le nombre d'échantillons de salive, les volumes de collecte de sang et le nombre de spécimens de tissus viables et conservés collectés sont également consignés comme références pour les allocations aux utilisations ultérieures. Cliquez ici pour télécharger ce fichier.
Pour valider les procédures de collecte des échantillons, chaque type d'échantillon a été testé dans les applications en aval. En utilisant des modifications des techniques précédentes 12 , la tumeur et l'ANT ont été utilisés avec succès dans l'isolement des protéines et de l'ARN et peuvent éventuellement être utilisés pour l'isolement de l'ADN. Les explants viables établis à partir des sections de tissu ont été évalués par microscopie, tandis que des diapositives histologiques stockées ont été utilisées pour l'immunohistochimie et l'immunofluorescence.
En suivant le protocole décrit ici, il est possible d'étendre ce modèle à d'autres cliniques de dermatologie, à d'autres types de tumeurs (comme le mélanome), Et d'autres spécialités et pratiques chirurgicales pour fournir des échantillons de tissus humains pour la recherche à multiples facettes sur les cancers humains. De légères modifications de ce protocole sont susceptibles d'être nécessaires pour d'autres pratiques, mais, en principe, ce protocole s'applique à toute pratique chirurgicale qui répète systématiquement les échantillons de patients recueillis au cours du traitement du patient.
Protocol
Representative Results
Discussion
Pour la connaissance de l'auteur, ce protocole est le premier de son genre qui se concentre sur l'achat clinique d'échantillons de tissus cutanés dans une approche rentable et rapide. Les patients subissant une microchirurgie Mohs sont généralement programmés pendant des blocs de temps spécifiques, et la collecte est limitée à ces périodes. La collecte d'échantillons implique l'effort de l'assistant médical impliqué dans les soins aux patients, l'histotechnologue de Mohs qui trait…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Ce travail a été soutenu par des fonds du Collège de l'Université du Midwestern, Subvention de facilitation de la recherche en sciences de la santé, décerné à EEH, et Midwestern University, Bureau de la recherche et programmes sponsorisés Intramural Grant, décerné à KJL. Un soutien supplémentaire a été fourni par les Laboratoires Affiliés et la Dermatologie Affiliée. Nous remercions Sarah Potekhen, Jamie Barto, Stefani Fawks, Cody Jording, Stacie Schimke, Heather Kissel et Ali Zaidi pour leur assistance technique.
Materials
| BD Vacutainer Plastic Blood Collection Tubes with K3EDTA | ThermoFisher Scientific | 02-685-2B | |
| Electron Microscopy Sciences Double Edge Blades | ThermoFisher Scientific | 50-949-411 | |
| Curved Medium Point General Purpose Forceps | ThermoFisher Scientific | 16-100-110 | |
| Premium Microcentrifuge Tubes | ThermoFisher Scientific | 05-408-138 | |
| Lonza Walkersville KGM Keratinocyte Medium | ThermoFisher Scientific | NC9791321 | |
| Electron Microscopy Sciences Tissue TEK OCT Compound | ThermoFisher Scientific | 50-363-579 | |
| Leica CM1950 Cryostat | Leica Biosystems | 14047743909 | |
| Frosted Microscope Slides | ThermoFisher Scientific | 12-550-343 | |
| Shandon Rapid-Chrome H&E Frozen Section Staining Kit | ThermoFisher Scientific | 99-900-01 | |
| Nalgene Long-Term Storage Cryogenic Tubes | ThermoFisher Scientific | 03-337-7X | |
| Falcon 15 mL Conical Centrifuge Tubes | ThermoFisher Scientific | 14-959-53A | |
| Boca Scientific BuccalT-Swab | ThermoFisher Scientific | NC9679349 | |
| Cell Signaling Technology 10x RIPA Buffer | ThermoFisher Scientific | 50-195-822 | |
| Halt Protease and Phosphatase Inhibitor Cocktail | ThermoFisher Scientific | PI78443 | |
| Eppendorf 5424R Microcentrifuge | ThermoFisher Scientific | 05-401-203 | |
| Pellet Morter Cordless Homogenizer | ThermoFisher Scientific | 12-141-3 | |
| RNAse Free Pellet Pestle | ThermoFisher Scientific | 121-141-364 | |
| Forma SteriCycle CO2 Incubator | ThermoFisher Scientific | 13-998-089 | |
| HyClone Fetal Bovine Serum | ThermoFisher Scientific | SH30071.02 | |
| Gibco Advanced DMEM/F-12 | ThermoFisher Scientific | 12-634-028 | |
| Gibco Penicillin-Streptomycin | ThermoFisher Scientific | 15140148 | |
| Gibco 1M Hepes | ThermoFisher Scientific | 15-630-130 | |
| Nunc Cell Culture 35 mm with Vent | ThermoFisher Scientific | 1256591 | |
| Anti-CFH monoclonal antibody clone OX-24 | Abnova | MAB12583 | |
| Anti-p40 (p63 delta) antibody | Abnova | ABX-144A | |
| Anti MUC-1 antibody | Santa Cruz Biotech | sc-7313 | |
| Anti-Snail + Slug (phospho S246) | Abcam | Ab63568 | |
| Goat anti-rabbit IgG, Alexa Fluor 488 | Invitrogen | A-11034 | |
| Alexa Fluor 568 Phallodin | Molecular Probes | A12380 | |
| ProLong Gold Antifade Mountant with DAPI | Molecular Probes | P36941 | |
| Zeiss Axio Imager Z1 Microscope with Axiocam camera | Zeiss | 4300009901 | |
| Olympus IX51 phase contrast with DP72 camera | Olympus | IX511F3 |
References
- Baker, M. Biorepositories: Building better biobanks. Nature. 486, 141-146 (2012).
- Ambrosone, C. B., Nesline, M. K., Davis, W. Establishing a cancer center data bank and biorepository for multidisciplinary research. Cancer Epidemiol Biomarkers Prev. 15, 1575-1577 (2006).
- Baird, P. M., Gunter, E. W., Vaught, J. Building a biobank. Biopreserv Biobank. 14, 87-88 (2016).
- Caixeiro, N. J., Lai, K., Lee, C. S. Quality assessment and preservation of RNA from biobank tissue specimens: a systematic review. J Clin Pathol. 69, 260-265 (2016).
- Campbell, L. D., et al. Development of the ISBER best practices for repositories: Collection, storage, retrieval and distribution of biological materials for research. Biopreserv Biobank. 10, 232-233 (2012).
- Neumeister, V. M. Tools to assess tissue quality. Clin Biochem. 47, 280-287 (2014).
- Vaught, J., et al. An NCI perspective on creating sustainable biospecimen resources. J Natl Cancer Inst Monogr. 2011, 1-7 (2011).
- Fu, T., Aasi, S. Z., Hollmig, S. T. Management of high-risk squamous cell carcinoma of the skin. Curr Treat Options Oncol. 17, (2016).
- Rasmussen, C., Thomas-Virnig, C., Allen-Hoffmann, B. L. Classical human epidermal keratinocyte cell culture. Methods Mol Biol. 945, 161-175 (2013).
- Purdie, K. J., Pourreyron, C., South, A. P. Cancer cell culture: Methods and protocols. , 151-159 (2011).
- Berglund, S. R., Schwietert, C. W., Jones, A. A., Stern, R. L., Lehman, J., Goldberg, Z. Optimized methodology for sequential extraction of RNA and protein from small human skin biopsies. J Invest Dermatol. 127, 349-353 (2007).
- Schroeder, A., et al. The RIN: an RNA integrity number for assigning integrity values to RNA measurements. BMC Mol Biol. 7, 1-14 (2006).
- Cooper, H. L., et al. Expression and glycosylation of MUC1 in epidermolysis bullosa-associated and sporadic cutaneous squamous cell carcinomas. Br J Dermatol. 151, 540-545 (2004).
- Riihila, P. M., et al. Complement factor H: a biomarker for progression of cutaneous squamous cell carcinoma. J Invest Dermatol. 134, 498-506 (2014).
- Ha Lan, T. T., et al. Expression of the p40 isoform of p63 has high specificity for cutaneous sarcomatoid squamous cell carcinoma. J Cutan Pathol. 41, 831-838 (2014).
- Alomari, A. K., Glusac, E. J., McNiff, J. M. p40 is a more specific marker than p63 for cutaneous poorly differentiated squamous cell carcinoma. J Cutan Pathol. 41, 839-845 (2014).
- Qiao, B., Johnson, N. W., Gao, J. Epithelial-mesenchymal transition in oral squamous cell carcinoma triggered by transforming growth factor-beta1 is Snail family-dependent and correlates with matrix metalloproteinase-2 and -9 expressions. Int J Oncol. 37, 663-668 (2010).
- Vaught, J. Developments in biospecimen research. Br Med Bull. 114, 29-38 (2015).

