Establecimiento de un Biorepository basado en la Clínica
Summary
Los tumores cutáneos se descartan a menudo después de la cirugía micrográfica de Mohs. Se describe aquí un protocolo que permite al personal de soporte clínico procesar y almacenar eficazmente muestras de tumores cutáneos ( por ejemplo, carcinoma de células escamosas, carcinoma basocelular y melanoma) para aplicaciones de laboratorio aguas abajo sin interferir con las operaciones clínicas.
Abstract
La incidencia de cáncer de piel ( por ejemplo, carcinoma de células escamosas, carcinoma basocelular y melanoma) ha aumentado en los últimos años. Se espera que haya una demanda paralela de muestras tumorales cutáneas para estudios de investigación biomédica. Sin embargo, la disponibilidad de tejidos es limitada debido al costo de establecer un depósito biológico y la falta de protocolos disponibles para obtener muestras clínicas que no interfieran con las operaciones clínicas. Se estableció un protocolo para recolectar y procesar el tumor cutáneo y las muestras asociadas de sangre y saliva que tienen un impacto mínimo en los procedimientos clínicos de rutina en la fecha de la cirugía de Mohs. Las muestras tumorales se recogen y procesan a partir de pacientes sometidos a su primera capa de cirugía Mohs para neoplasias cutáneas probadas por biopsia por el histotecnólogo Mohs. El tejido normal adyacente se recoge en el momento del cierre quirúrgico. Las muestras adicionales que se pueden recoger son hisopos de sangre entera y bucal. Mediante la utilización de muestras de tejido que normalmente se desechan, se generó un depósito biológico que ofrece varias ventajas clave basándose en la clínica frente al laboratorio. Estos incluyen una amplia gama de muestras recogidas; Acceso a los registros de pacientes no identificados, incluidos los informes de patología; Y, para el donante típico, el acceso a muestras adicionales durante las visitas de seguimiento.
Introduction
La investigación sobre el cáncer y los biomarcadores se basa en un suministro de muestras de tejido humano de calidad, y la oferta limitada ha obstaculizado la investigación 1 , 2 . Muchos estudios dermatológicos están limitados por la oferta inadecuada, la calidad variable y los costos asociados con el uso de tejido humano. El costo de establecer un gran biobanco dedicado se ha estimado en aproximadamente dos millones de dólares 3 , y estos costos colocan el uso de tejido humano fuera del alcance de muchos investigadores. Además, el proceso de generación y almacenamiento de muestras de investigación plantea el riesgo de afectar las operaciones clínicas y retrasar la atención al paciente si no se ejecuta cuidadosamente. Se ha establecido un biorepository rentable, basado en clínicas, que se centra en las muestras de cáncer de piel siguiendo las mejores prácticas recomendadas y la validación de muestras 4 , 5 , 6 .
<pEste protocolo se ha desarrollado en una clínica de dermatología que realiza un gran volumen de cirugías micrográficas de Mohs para eliminar el carcinoma de células escamosas (SCC), el carcinoma basocelular (CBC) y los cánceres de piel de melanoma. Los donantes voluntarios pueden ser reclutados de esta población de pacientes. Es importante establecer el biorepository en el sitio de la colección para capturar rápidamente el tejido y la sangre de pacientes consentidos sin retrasar el tratamiento. La recopilación de muestras de la misma clínica minimiza las variaciones en las técnicas de recolección y minimiza las variaciones en la calidad de las muestras, lo que puede ser problemático para las aplicaciones posteriores 7 , 8 .El objetivo de la técnica de cirugía micrográfica Mohs es asegurar que todo el tejido canceroso se elimina mientras se preserva el mayor número posible de tejidos sanos. El procedimiento implica la eliminación progresiva de capas delgadas de tejido tumoral. Cada capa sucesiva es suExaminado tologically (después de cryosectioning el tejido del tumor y de realizar la mancha de H & E) por un dermatologist para determinar si todo el tejido del cáncer se ha quitado. La extirpación y examen de capas posteriores de tejidos se realiza mientras el paciente permanece en la oficina. Esta técnica se considera la mejor opción de tratamiento para SCC 9 . En este punto, la herida se cierra y, para mejorar la cicatrización y la apariencia estética, el tejido normal adyacente (ANT) es frecuentemente extirpado. Por lo tanto, este procedimiento quirúrgico para extirpar un tumor es idealmente adecuado para recoger tejidos histológicamente caracterizados para futuros estudios.
El procedimiento de adquisición para obtener tejido tumoral, tejido adyacente normal, saliva y muestras de sangre ha sido diseñado para tener un impacto mínimo en las tareas normales del personal ( Figura 1 ). Asistentes médicos realizar la sangre dibuja mientras se prepara al paciente para el procedimiento. Después de completar el procedimiento de Mohs, el M Ohs histotechnologist prepara más diapositivas histológicas de la muestra y transfiere el tejido al biorepository. Los costos asociados con el establecimiento del depósito biológico incluyen la compra de congeladores de crioconservación, la creación de un espacio de laboratorio clínico modesto y el desarrollo de un programa de seguimiento de inventario.
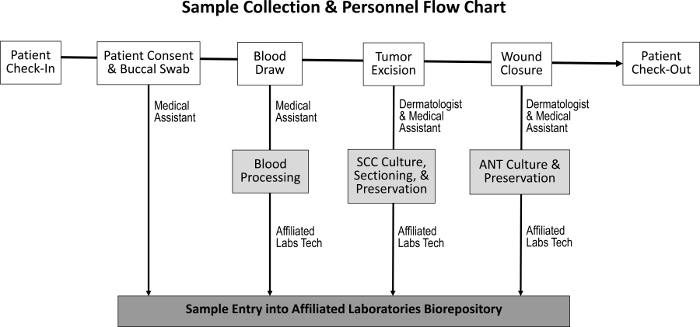
Figura 1: Secuencia de recolección de muestras y personal responsable. Tras el ingreso del paciente y el logro del consentimiento del paciente, el asistente médico recoge un hisopo bucal y realiza un drenaje de sangre. El dermatólogo y el asistente médico luego excisan el tumor y cierran la herida, durante el cual se recogen las muestras de SCC y ANT, respectivamente. Un técnico de laboratorio dedicado procesa la sangre y secciona las muestras de SCC y ANT para el cultivo de tejidos, la preservación y la entrada en el biorepository.Ftp_upload / 55583 / 55583fig1large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.
La diversidad de muestras recogidas permite una variedad de enfoques experimentales ( Figura 2 ). Las muestras recogidas del paciente son hisopos bucales (la saliva también se puede recoger si es necesario), sangre entera y tejido extirpado. Los hisopos bucales y una muestra de la sangre entera se guardan, sin procesar, para el genotipado y el emparejamiento de tejidos. La sangre entera se separa en glóbulos blancos (WBC) y fracciones de plasma para análisis futuros. Después del procesamiento de Mohs, el tumor congelado se coloca directamente en nitrógeno líquido y se transfiere a un congelador a -80ºC. Las muestras frescas, viables de tejido tumoral y de ANT se cultivan usando modificaciones de las técnicas anteriores 10 , 11 y luego se crioconservan. Durante la recolección, el número de cada tipo de muestra se registra en una hoja de cálculo antes de El programa de seguimiento de inventarios para facilitar el procesamiento preciso ( Tabla 1 ).
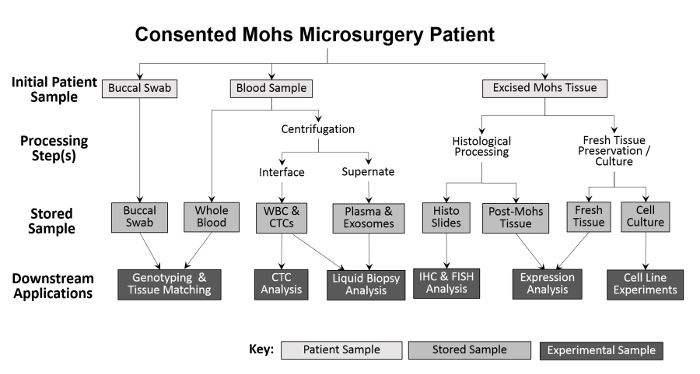
Figura 2: Esquema de la recolección y procesamiento de muestras de biorrepositores basados en la clínica. Se recoge un hisopo bucal y una muestra de sangre del paciente y se almacena para genotipificación y emparejamiento de tejido aguas abajo. La sangre entera se procesa posteriormente para el aislamiento de glóbulos blancos (WBC) y el análisis de CTC, así como para la colección de plasma y el análisis de biopsia de líquido. El tejido excisado durante el procedimiento de Mohs se procesa histológicamente para fines de diagnóstico, después de lo cual las diapositivas histológicas pueden usarse experimentalmente para análisis inmunohistoquímicos adicionales. Siempre que la muestra de tejido extirpada sea lo suficientemente grande, una porción de tejido fresco se elimina y secciona para aislamiento de proteína y ARN y para el establecimiento de líneas celulares cultivadas.55583 / 55583fig1large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.
| Fecha de colección: | |||||
| Paciente 1 | Paciente 2 | Paciente 3 | Paciente 4 | Paciente 5 | |
| Iniciales y fecha de nacimiento | |||||
| Color de los ojos | |||||
| Tipo de ejemplo | |||||
| Ubicación de la muestra | |||||
| Saliva | |||||
| WAgujero de sangre | |||||
| Plasma | |||||
| Tumor Viable | |||||
| Tejido Normal Viable | |||||
| Tumor Mohs Nitrógeno Líquido | |||||
| Nitrógeno líquido normal del tejido | |||||
| Diapositivas |
Tabla 1: Lista de verificación para registrar las colecciones de muestras. Los datos rastreados y registrados con cada muestra recogida incluyen iniciales del paciente, fecha de nacimiento y color de los ojos (para la tipificación de la piel), así como la locatiEn la extracción de la muestra. El número de muestras de saliva, los volúmenes de recolección de sangre y el número de especímenes de tejidos viables y conservados recolectados también se registran como referencias para asignaciones a usos posteriores. Haga clic aquí para descargar este archivo.
Para validar los procedimientos de recolección de muestras, cada tipo de muestra se ha probado en aplicaciones descendentes. Utilizando modificaciones de las técnicas anteriores 12 , el tumor y la ANT se han utilizado con éxito en el aislamiento de proteínas y ARN y pueden usarse potencialmente para aislar el ADN. Los explantes viables establecidos a partir de las secciones de tejido se han evaluado mediante microscopía, mientras que las diapositivas histológicas almacenadas se han utilizado para inmunohistoquímica e inmunofluorescencia.
Siguiendo el protocolo descrito aquí, es posible extender este modelo a otras clínicas de dermatología, otros tipos de tumores (como el melanoma), Y otras especialidades y prácticas quirúrgicas para proporcionar muestras de tejido humano para la investigación multifacética en cánceres humanos. Es probable que algunas modificaciones de este protocolo sean necesarias para otras prácticas pero, en principio, este protocolo es aplicable a cualquier práctica quirúrgica que descarte rutinariamente muestras de pacientes recolectadas durante el tratamiento del paciente.
Protocol
Representative Results
Discussion
A juicio del autor, este protocolo es el primero de su tipo que se centra en la adquisición clínica de muestras de tejido cutáneo en un enfoque rentable y rápido. Los pacientes sometidos a microcirugía de Mohs se programan típicamente durante bloques específicos del tiempo, y la colección se limita a estos períodos. La recolección de muestras involucra el esfuerzo del asistente médico involucrado en el cuidado del paciente, el histotecnólogo de Mohs que procesa las muestras tumorales y un miembro del persona…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Este trabajo fue apoyado con fondos de la Midwestern University Colegio de Ciencias de la Salud Investigación Facilitación Grant, otorgado a EEH, y Midwestern University Oficina de Investigación y Programas Patrocinados Intramural Grant, otorgado a KJL. El apoyo adicional fue proporcionado por Affiliated Laboratories y Affiliated Dermatology. Agradecemos a Sarah Potekhen, Jamie Barto, Stefani Fawks, Cody Jording, Stacie Schimke, Heather Kissel y Ali Zaidi por su asistencia técnica.
Materials
| BD Vacutainer Plastic Blood Collection Tubes with K3EDTA | ThermoFisher Scientific | 02-685-2B | |
| Electron Microscopy Sciences Double Edge Blades | ThermoFisher Scientific | 50-949-411 | |
| Curved Medium Point General Purpose Forceps | ThermoFisher Scientific | 16-100-110 | |
| Premium Microcentrifuge Tubes | ThermoFisher Scientific | 05-408-138 | |
| Lonza Walkersville KGM Keratinocyte Medium | ThermoFisher Scientific | NC9791321 | |
| Electron Microscopy Sciences Tissue TEK OCT Compound | ThermoFisher Scientific | 50-363-579 | |
| Leica CM1950 Cryostat | Leica Biosystems | 14047743909 | |
| Frosted Microscope Slides | ThermoFisher Scientific | 12-550-343 | |
| Shandon Rapid-Chrome H&E Frozen Section Staining Kit | ThermoFisher Scientific | 99-900-01 | |
| Nalgene Long-Term Storage Cryogenic Tubes | ThermoFisher Scientific | 03-337-7X | |
| Falcon 15 mL Conical Centrifuge Tubes | ThermoFisher Scientific | 14-959-53A | |
| Boca Scientific BuccalT-Swab | ThermoFisher Scientific | NC9679349 | |
| Cell Signaling Technology 10x RIPA Buffer | ThermoFisher Scientific | 50-195-822 | |
| Halt Protease and Phosphatase Inhibitor Cocktail | ThermoFisher Scientific | PI78443 | |
| Eppendorf 5424R Microcentrifuge | ThermoFisher Scientific | 05-401-203 | |
| Pellet Morter Cordless Homogenizer | ThermoFisher Scientific | 12-141-3 | |
| RNAse Free Pellet Pestle | ThermoFisher Scientific | 121-141-364 | |
| Forma SteriCycle CO2 Incubator | ThermoFisher Scientific | 13-998-089 | |
| HyClone Fetal Bovine Serum | ThermoFisher Scientific | SH30071.02 | |
| Gibco Advanced DMEM/F-12 | ThermoFisher Scientific | 12-634-028 | |
| Gibco Penicillin-Streptomycin | ThermoFisher Scientific | 15140148 | |
| Gibco 1M Hepes | ThermoFisher Scientific | 15-630-130 | |
| Nunc Cell Culture 35 mm with Vent | ThermoFisher Scientific | 1256591 | |
| Anti-CFH monoclonal antibody clone OX-24 | Abnova | MAB12583 | |
| Anti-p40 (p63 delta) antibody | Abnova | ABX-144A | |
| Anti MUC-1 antibody | Santa Cruz Biotech | sc-7313 | |
| Anti-Snail + Slug (phospho S246) | Abcam | Ab63568 | |
| Goat anti-rabbit IgG, Alexa Fluor 488 | Invitrogen | A-11034 | |
| Alexa Fluor 568 Phallodin | Molecular Probes | A12380 | |
| ProLong Gold Antifade Mountant with DAPI | Molecular Probes | P36941 | |
| Zeiss Axio Imager Z1 Microscope with Axiocam camera | Zeiss | 4300009901 | |
| Olympus IX51 phase contrast with DP72 camera | Olympus | IX511F3 |
References
- Baker, M. Biorepositories: Building better biobanks. Nature. 486, 141-146 (2012).
- Ambrosone, C. B., Nesline, M. K., Davis, W. Establishing a cancer center data bank and biorepository for multidisciplinary research. Cancer Epidemiol Biomarkers Prev. 15, 1575-1577 (2006).
- Baird, P. M., Gunter, E. W., Vaught, J. Building a biobank. Biopreserv Biobank. 14, 87-88 (2016).
- Caixeiro, N. J., Lai, K., Lee, C. S. Quality assessment and preservation of RNA from biobank tissue specimens: a systematic review. J Clin Pathol. 69, 260-265 (2016).
- Campbell, L. D., et al. Development of the ISBER best practices for repositories: Collection, storage, retrieval and distribution of biological materials for research. Biopreserv Biobank. 10, 232-233 (2012).
- Neumeister, V. M. Tools to assess tissue quality. Clin Biochem. 47, 280-287 (2014).
- Vaught, J., et al. An NCI perspective on creating sustainable biospecimen resources. J Natl Cancer Inst Monogr. 2011, 1-7 (2011).
- Fu, T., Aasi, S. Z., Hollmig, S. T. Management of high-risk squamous cell carcinoma of the skin. Curr Treat Options Oncol. 17, (2016).
- Rasmussen, C., Thomas-Virnig, C., Allen-Hoffmann, B. L. Classical human epidermal keratinocyte cell culture. Methods Mol Biol. 945, 161-175 (2013).
- Purdie, K. J., Pourreyron, C., South, A. P. Cancer cell culture: Methods and protocols. , 151-159 (2011).
- Berglund, S. R., Schwietert, C. W., Jones, A. A., Stern, R. L., Lehman, J., Goldberg, Z. Optimized methodology for sequential extraction of RNA and protein from small human skin biopsies. J Invest Dermatol. 127, 349-353 (2007).
- Schroeder, A., et al. The RIN: an RNA integrity number for assigning integrity values to RNA measurements. BMC Mol Biol. 7, 1-14 (2006).
- Cooper, H. L., et al. Expression and glycosylation of MUC1 in epidermolysis bullosa-associated and sporadic cutaneous squamous cell carcinomas. Br J Dermatol. 151, 540-545 (2004).
- Riihila, P. M., et al. Complement factor H: a biomarker for progression of cutaneous squamous cell carcinoma. J Invest Dermatol. 134, 498-506 (2014).
- Ha Lan, T. T., et al. Expression of the p40 isoform of p63 has high specificity for cutaneous sarcomatoid squamous cell carcinoma. J Cutan Pathol. 41, 831-838 (2014).
- Alomari, A. K., Glusac, E. J., McNiff, J. M. p40 is a more specific marker than p63 for cutaneous poorly differentiated squamous cell carcinoma. J Cutan Pathol. 41, 839-845 (2014).
- Qiao, B., Johnson, N. W., Gao, J. Epithelial-mesenchymal transition in oral squamous cell carcinoma triggered by transforming growth factor-beta1 is Snail family-dependent and correlates with matrix metalloproteinase-2 and -9 expressions. Int J Oncol. 37, 663-668 (2010).
- Vaught, J. Developments in biospecimen research. Br Med Bull. 114, 29-38 (2015).

