Infección por neumococo de células endoteliales humanas primarias en flujo constante
Summary
Este estudio describe el monitoreo microscópico de la adherencia del neumococo a las cadenas del factor von Willebrand producidas en la superficie de células endoteliales primarias humanas diferenciadas bajo tensión de cizallamiento en condiciones de flujo definidas. Este protocolo se puede extender a la visualización detallada de estructuras celulares específicas y cuantificación de bacterias mediante la aplicación de procedimientos de inmunoinso diferencial.
Abstract
La interacción de Streptococcus pneumoniae con la superficie de las células endoteliales se media en el flujo sanguíneo a través de proteínas sensibles al mecanosensible como el Factor Von Willebrand (VWF). Esta glicoproteína cambia su conformación molecular en respuesta al estrés de cizallamiento, exponiendo así sitios de unión para un amplio espectro de interacciones huésped-ligand. En general, el cultivo de células endoteliales primarias bajo un flujo de cizallamiento definido es conocido por promover la diferenciación celular específica y la formación de una capa endotelial estable y estrechamente vinculada que se asemeja a la fisiología del revestimiento interno de un vaso sanguíneo . Por lo tanto, el análisis funcional de las interacciones entre patógenos bacterianos y la vasculatura huésped que involucra proteínas mecanósensitiveas requiere el establecimiento de sistemas de bombeo que puedan simular las fuerzas de flujo fisiológico que se sabe que afectan a la superficie de células vasculares.
El dispositivo microfluídico utilizado en este estudio permite una recirculación continua y sin pulsos de fluidos con un caudal definido. El sistema de bomba de presión de aire controlado por ordenador aplica una tensión de cizallamiento definida en las superficies de células endoteliales mediante la generación de un flujo medio continuo, unidireccional y controlado. Los cambios morfológicos de las células y la unión bacteriana se pueden monitorear y cuantificar microscópicamente en el flujo mediante el uso de diapositivas de canal especiales que están diseñadas para la visualización microscópica. A diferencia de la infección por cultivo celular estático, que en general requiere una fijación de muestraantes antes del etiquetado inmune y los análisis microscópicos, las diapositivas microfluídicas permiten tanto la detección basada en fluorescencia de proteínas, bacterias y componentes celulares después de la fijación de la muestra; inmunofluorescencia en serie; y detección directa basada en fluorescencia en tiempo real. En combinación con bacterias fluorescentes y anticuerpos específicos etiquetados con fluorescencia, este procedimiento de infección proporciona un sistema de visualización de múltiples componentes eficiente para un gran espectro de aplicaciones científicas relacionadas con los procesos vasculares.
Introduction
La patogénesis de las infecciones por neumococo se caracteriza por una interacción multifacética con una diversidad de compuestos de matriz extracelular y componentes de la hemostasia humana, como el plasminógeno y el VWF1,2, 3,4,5,6,7,8. El VWF multidominio de glicoproteína sirve como regulador clave de una hemostasis equilibrada mediante la mediación del reclutamiento de trombocitos y la incorporación de fibrina en el sitio de formación de trombos vasculares9. La importancia del VWF funcional y activo para el control del sangrado y la cicatrización de heridas se demuestra en la enfermedad de von Willebrand, un trastorno hemorrágico hereditario común10.
Globular VWF circula en el sistema sanguíneo humano a una concentración de hasta 14,0 g/ml11,10. En respuesta a la lesión vascular, la liberación local de FVW por parte de los cuerpos endoteliales de palademán de Weibel (WBP) se incrementa notablemente11,12. Estudios anteriores muestran que la adherencia del neumococo a las células endoteliales humanas y su producción de la toxina formacional de poros neumolisina estimula significativamente la secreción luminal de VWF13. Las fuerzas hidrodinámicas del flujo sanguíneo inducen una apertura estructural de los dominios de VWF mecanoresponsive. A caudales de 10 dyn/cm2 el VWF multimerizes a cadenas de proteínas largas de hasta varios cientos de micrómetros de longitud que permanecen unidos al subendotelio10,12.
Para comprender la función de las cadenas multimerizadas de VWF generadas bajo tensión cortante en la interacción del neumococo con la superficie endotelial, se estableció un enfoque de infección del cultivo celular basado en microfluidos. Se utilizó un dispositivo microfluídico con un sistema de bomba de presión de aire controlado por software. Esto permitió una recirculación continua y unidireccional del medio de cultivo celular con un caudal definido. De este tipo, el sistema aplicó una tensión cortante definida en la superficie de las células endoteliales, que permanecía unida dentro de diapositivas de canal especializadas. Este enfoque permitió la simulación de la fuerza cortante dentro del torrente sanguíneo del sistema vascular humano, en el que las cadenas VWF se generan en células endoteliales diferenciadas en condiciones de flujo constante definidas. Para ello, las células endoteliales se cultivaron en diapositivas de canal específicas (ver Tabla de Materiales),que fueron adaptadas para análisis microscópicos durante el flujo. El sistema de bomba microfluídica proporcionó la situación de tensión de cizallamiento altamente definida y controlada necesaria para la formación de cadenas VWF extendidas en la capa de células endoteliales confluentes. Después de la estimulación de la secreción de VWF de las células endoteliales de venas umbilicales humanas cultivadas confluentes (HUVEC) por la suplementación con histamina, la formación de cuerdas fue inducida mediante la aplicación de una tensión de cizallamiento (o) de 10 dyn/cm2. La tensión de cizallamiento se define como la fuerza que actúa sobre la capa de celda. Se calcula aproximadamente de acuerdo con Cornish et. al.14 con la ecuación 1:
En el caso de la tensión de cizallamiento en dyn/cm2, á viscosidad en (dyn)/cm2, h a la mitad de la altura del canal, a la mitad de la anchura del canal y a la velocidad de flujo en ml/min.
El resultado de la ecuación 1 depende de las diferentes alturas y anchuras de las diferentes diapositivas utilizadas (ver Tabla de Materiales). En este estudio se utilizó una diapositiva de canal Luer de 0,4 m que dio como resultado un factor de deslizamiento de cámara de 131,6 (ver fórmula 2).
La viscosidad del medio a 37oC es de 0,0072 dyns/cm2 y se utilizó una tensión de cizallamiento de 10 dyn/cm2. Esto dio lugar a un caudal de 10,5 ml/min (véase la fórmula 3).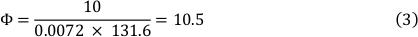
Aquí, la adaptación y el avance de un procedimiento de cultivo celular microfluídico utilizando un sistema de flujo laminar unidireccional para la investigación y visualización de los mecanismos de infección bacteriana en la vasculatura del huésped se describe en detalle. La generación de cadenas VWF en capas endoteliales también se puede estimular mediante el uso de otros sistemas de bomba que son capaces de aplicar una tensión de cizallamiento continua y constante15.
Después del cultivo de células endoteliales primarias para confluencia en el flujo y la estimulación de la formación de cuerdas DeVWF, se añadieron neumococos que expresan proteína de fluorescencia roja (RFP)16 a la capa de células endoteliales bajo control microscópico constante. La unión de bacterias a las cuerdas del VWF en la superficie de las células endoteliales se visualizó y monitorizó microscópicamente durante hasta tres horas en tiempo real mediante el uso de anticuerpos con etiquetas fluorescentes específicas de VWF. Con este enfoque, se determinó el papel del VWF como cofactor de adhesión que promueve el apego bacteriano al endotelio vascular8.
Además de la visualización microscópica de la secreción de proteínas y los cambios de conformación, este método podría utilizarse para monitorear pasos individuales de los procesos de infección bacteriana en tiempo real y para cuantificar la cantidad de bacterias adheridas en diferentes puntos de tiempo de Infección. El sistema específico de bomba controlada por software también ofrece la posibilidad de cultivar las células endoteliales en condiciones de flujo constante definidas durante un máximo de varios días y permite una incubación de flujo medio pulsada definida. Además, este método se puede aplicar utilizando diferentes tipos de celda. La adaptación del protocolo de tinción también permite la detección y visualización de bacterias internalizadas en células eucariotas.
Este manuscrito describe este protocolo experimental avanzado que se puede utilizar como un enfoque definido, confiable y reproducible para una caracterización eficiente y versátil de los procesos fisiopatológicos.
Protocol
Representative Results
Discussion
La simulación de la interacción bacteriana con proteínas huésped sensibles al mecanosensible como el VWF requiere un sistema de cultivo celular perfundible que permita la generación de un flujo definido, unidireccional y continuo de líquidos, generando así un flujo confiable de tensión de cizallamiento . Ya se han descrito varios sistemas de bombas microfluídicas. Una revisión exhaustiva de Bergmann et al. resume los aspectos clave de los diferentes modelos de cultivo celular bidimensional y tridimensional<sup …
Divulgations
The authors have nothing to disclose.
Acknowledgements
El proyecto fue financiado por el DFG (BE 4570/4-1) a S.B.
Materials
| 1 mL Luer-syringe | Fisher Scientific | 10303002 | with 1 mL volume for gelatin injection using the luer-connection of the slides |
| 2 mL Luer-syringe | Sarstedt | 9077136 | For pieptting/injecting fluids into the luer connections of the channel chamber slides |
| Accutase | eBioscience now thermo fisher | 00-4555-56 | protease mix used for gentle detachment of endothelial cells |
| AlexaFluor350-conjugated Phalloidin | Abcam | ab176751 | no concentration available from the manufacturer, stock solution is sufficient for 300 tets, company recommends to use 100 µl of a 1:1000 dilution, blue fluorescence (DAPI-filter settings) |
| AlexaFluor488-conjugated goat-derived anti-mouse antibody | Thermo Fisher Sientific | A11001 | stock concentration: 2 mg/mL for immunostaining of human VWF in microfluidic slide after PFA fixation, green fluorescence |
| AlexaFluor568-conjugated goat-derived anti-rabbit-antibody | Thermo Fisher Scientific | A-11011 | stock concentration: 2 mg/mL for immunostaining of pneumococci in microfluidic slide after pFA fixation, red fluorescence |
| Bacto Todd-Hewitt-Broth | Becton Dickinson GmbH | BD 249210 | complex bacterial culture medium |
| Bovine Serum Albumin (BSA) | Sigma Aldrich | A2153-25G | solubilized, for preparation of blocking buffer |
| Cell culture flasks with filter | TPP | 90026 | subcultivation of HUVEC in non-coated cell culture flasks of 25 cm2 surface |
| Centrifuge Allegra X-12R | Beckman Coulter Life Sciences | 392304 | spinning down of bacteria (volumes of > 2mL) |
| Centrifuge Allegra X-30 | Beckman Coulter Life Sciences | B06314 | spinning down of eukaryotic cells |
| Centrifuge Z 216 MK | Hermle | 305.00 V05 – Z 216 M | spinning down of bacteria (volumes of less than 2 mL) |
| Chloramphenicol | Carl Roth GmbH + Co. KG, Karlsruhe | 3886.2 | used in a concentration of 0.2 /mL for cultivation of pneumococci transformed with genetic construct carrying red fluorescent protein and chloramphenicol resistance cassette |
| Clamp for perfusion tubing | ibidi | 10821 | for holding the liquid in the tube bevor connecting the slide to the pump system |
| CO2-Incubator | Fisher Scientific | MIDI 40 | incubator size is perfectly adapted to teh size of the fluidic unit with connected channel slide and was used for flow cultivation at 37°C and 5% CO2 |
| CO2-Incubator | Sanyo | MCO-18 AIC | for incubation of bacteria and cells in a defined atmosphere at 5% CO2 and 37°C |
| Colombia blood agar plates | Becton Dickinson GmbH | PA-254005.06 | agar-based complex culture medium for S. pneumoniae supplemented with 7% sheep blood |
| Computer | Dell | Latitude 3440 | Comuter with pressure pump software |
| Confocal Laser Scanning Microscope (CLSM) | Leica | DMi8 | An inverse microscope with a stage covered by a heatable chamber and with a fluorescence unit equipped with fluorescence filter, Xenon-light source (SP8, DMi8) and DFC 365 FX Kamera (1392 x 1040, 1.4 Megapixel) |
| Di Potassium hydrogen phosphate (KH2PO4) | Carl Roth GmbH + Co. KG, Karlsruhe | 3904.1 | used for PBS buffer |
| Drying material | Merck | 101969 | orange silica beads for drying used in a glass bottle with a tubing adaptor |
| ECGM supplement Mix | Promocell | C-39215 | supplement mix for ECGM -medium, required for precultivation of endothelial cells: 0.02 mL/mL Fetal calf serum, 0.004 mL/ mL endothelial cell growth supplement, 0.1 ng / mL epidermal growth factor, 1 ng / mL basic fibroblast growth factor, 90 µg / mL heparin, 1 µg / mL Hydrocortisone |
| ECGMS | Promocell | C-22010 | ECGM supplemented with 5 % [w/w] FCS and 1 mM MgSO4 to increase cell adhesion |
| Endothelial Cell growth medium (ECGM, ready to use) | Promocell | C-22010 | culture medium of HUVECs, already supplemented with all components of the supplement mix |
| Fetal Calf Serum (FCS) | biochrome now Merck | S 0415 | supplement for cell culture, used for infection analyses |
| FITC-conjugated goat anti-human VWF antibody | Abcam | ab8822 | stock concentration: 10 mg/mL, for immunodetection of globular and multimerized VWF in flow |
| Fluidic Unit | ibidi | 10903 | fluidic unit for flow cultivation |
| Gelatin (porcine) | Sigma Aldrich | G-1890-100g | for precoating of microslide channel surface |
| histamine dihydrochloride | Sigma Aldrich | H-7250-10MG | for induction of VWF secretion from endothelial Weibel Palade Bodies |
| Human Umbilical Vein Endothelial Cell (HUVEC) | Promocell | C-12203 Lot-Nr. 396Z042 | primary endothelial cells from pooled donor, stored crypcoserved in liquid nitrogen |
| Human VWF-specific antibody derived from mouse (monoclonal) | Santa Cruz | sc73268 | stock concentration: 200 µg/mL for immunostaining of VWF in microfluidic slide after PFA fixation |
| Injection Port | ibidi | 10820 | for injection of histamin or bacteria into the reservoir tubing during the flow circulation |
| Light microscope | Zeiss | Axiovert 35M | inverse light microscope for control of eukaryotic cell detachement and cell counting using a 40 x water objective allowing 400 x magnification |
| Luer-slides I0.4 (ibiTreat472microslides) | ibidi | 80176 | physically modified slides for fludic cultivation (μ–Slide I0.4Luer with a channel hight of 0.4 mm, a channel volume of 100 μl, a growth area of 2.5 cm and a coating area of 25.4 cm2) suitable for all kinds of flow assay, the physical treatment generates a hydrophilic and adhesive surface. |
| Magnesium sulfate (MgSO4, unhydrated) | Sigma Aldrich | M7506-500G | For preparation of ECGMS medium |
| Microfluidic Pump | ibidi | 10905 | air pressure pump |
| Neubauer cell counting chamber | Karl Hecht GmbH&Co KG | 40442002 | microscopic counting chamber for HUVECs |
| Paraformaldehyde 16% (PFA) | Electron Microscopy Sciences | 15710-S | for cross linking of samples |
| Perfusion Set | ibidi | 10964 | Perfusion Set Yellow/Green has a tubing diameter of 1.6 mm, a tube length of 50 cm, a total working volume of 13.6 mL, a dead tube volume of 2.8 mL and a reservoir size of 10 mL. combined with the µ-slide L0.4Luer, at 37°C and a viscosity of 0.0072 dyn x s/cm2 a flow rate range of 3.8mL/min up to 33.9 mL/min and shear stress between 3.5 dyn/cm2 and 31.2 dyn/cm2 can be reached. with 50 cm lenght for microfluidic |
| Phosphate-buffered saline (PBS) | the solution was prepared using the following chemicals: 0.2 g/L KCl, 1.44 g/L Na2HPO4, 0.24 g/L KH2PO4 , pH 7.4 | ||
| Plastic cuvettes | Sarstedt | 67,741 | (2 x optic) for OD measurement at 600 nm |
| Pneumococcus-specific antiserum | Pineda | raised in rabbit using heat-inactivated Streptococcus pneumoniae NCTC10319 and D39, IgG-purified using proteinA-sepharose column. | |
| Polystyrene or Styrofoam plate | this is a precaution step to avoid cold stress on the cells seeded in the channel slides. Any type of styrofoam such as packaging box-material can be used. The plate might by 0.5 cm thick and should have a size of 20 cm2. | ||
| Potassium chloride (KCl) | Carl Roth GmbH + Co. KG, Karlsruhe | 6781.1 | used for PBS buffer |
| Pump Control Software (PumpControl v1.5.4) | ibidi | v1.5.4 | Computer software for controlling the pressure pump, setting the flow conditions and start/end the flow |
| reaction tubes 1.5/ 2.0mL | Sarstedt | 72.706/ 72.695.500 | required for antibody dilutions |
| reaction tubes with 50 mL volume | Sarstedt | 6,25,48,004 | |
| RFP-expressing pneumococci | National Collection of Type Cultures, Public Health England | 10,319 | Streptococcus pneumoniae serotype 47 expressing RFP fused to ahistone-like protein integrated into the genome |
| serological pipets 5, 10 mL | Sarstedt | 86.1253.025/ 86.1254.025 | for pipeting larger volumes |
| Sodium Carbonate (Na2CO3, water free) | Sigma Aldrich | 451614-25G | for preparation of 100 mM Sodium Carbonate buffer |
| Sodium dihydrogen phosphate (NaH2PO4) | Carl Roth GmbH + Co. KG, Karlsruhe | P030.2 | used for PBS buffer |
| Spectral Photometer Libra S22 | Biochrom | 80-2115-20 | measurement of optical density (OD) of bacterial suspension at 600 nm |
| Sucrose | Sigma Aldrich | S0389-500G | for preparation of blocking buffer |
| Triton X-100 | Sigma Aldrich | T9284-500ML | Used in 0.1% end concentration diluted in dH20 for eukaryotic cell permeabilization after PFA fixation |
| Yeast extract | oxoid | LP0021 | bacteria are cultivated in THB supplement with 1% [w/w] yeast extract = complete bacterial cultivation medium THY |
References
- Weiser, J. N., Ferreira, D. M., Paton, J. C. Streptococcus pneumoniae: transmission, colonization and invasion. Nature Reviews Microbiology. 16 (6), 355-367 (2018).
- Bergmann, S., Hammerschmidt, S. Versatility of pneumococcal surface proteins. Microbiology. 152, 295-303 (2006).
- Bergmann, S., et al. Integrin-linked kinase is required for vitronectin-mediated internalization of Streptococcus pneumoniae by host cells. Journal of Cell Science. 122, 256-267 (2009).
- Bergmann, S., Schoenen, H., Hammerschmidt, S. The interaction between bacterial enolase and plasminogen promotes adherence of Streptococcus pneumoniae to epithelial and endothelial cells. International Journal of Medical Microbiology. 303, 452-462 (2013).
- Bergmann, S., Rohde, M., Chhatwal, G. S., Hammerschmidt, S. Alpha-enolase of Streptococcus pneumoniae is a plasmin(ogen)-binding protein displayed on the bacterial cell surface. Molecular Microbiology. 40, 1273-1287 (2001).
- Bergmann, S., et al. Identification of a novel plasmin(ogen)-binding motif in surface displayed alpha-enolase of Streptococcus pneumoniae. Molecular Microbiology. 49, 411-423 (2003).
- Bergmann, S., Rohde, M., Preissner, K. T., Hammerschmidt, S. The nine residue plasminogen-binding motif of the pneumococcal enolase is the major cofactor of plasmin-mediated degradation of extracellular matrix, dissolution of fibrin and transmigration. Thrombosis and Haemostasis. 94, 304-311 (2005).
- Jagau, H., et al. Von willebrand factor mediates pneumococcal aggregation and adhesion in flow. Frontiers in Microbiology. 10, 511 (2019).
- Tischer, A., et al. Enhanced local disorder in a clinically elusive von willebrand factor provokes high-affinity platelet clumping. Journal of Molecular Biology. 429, 2161-2177 (2017).
- Ruggeri, Z. M. Structure of von willebrand factor and its function in platelet adhesion and thrombus formation. Best Practice Research Clinical Haematology. 14, 257-279 (2001).
- Spiel, A. O., Gilbert, J. C., Jilma, B. Von willebrand factor in cardiovascular disease: Focus on acute coronary syndromes. Circulation. 117, 1449-1459 (2008).
- Springer, T. A. Von Willebrand factor, Jedi knight of the bloodstream. Blood. 124, 1412-1425 (2014).
- Luttge, M., et al. Streptococcus pneumoniae induces exocytosis of weibel-palade bodies in pulmonary endothelial cells. Cellular Microbiology. 14, 210-225 (2012).
- Cornish, R. J. Flow in a Pipe of Rectangular Cross-Section. Proceedings of the Royal Society A. 786, 691-700 (1928).
- Michels, A., Swystun, L. L., Mewburn, J., Albánez, S., Lillicrap, D. Investigating von Willebrand Factor Pathophysiology Using a Flow Chamber Model of von Willebrand Factor-platelet String Formation. Journal of Visualized Experiments. 14 (126), (2017).
- Kjos, M., et al. fluorescent Streptococcus pneumoniae for live-cell imaging of host-pathogen interactions. Journal of Bacteriology. 197, 807-818 (2015).
- Bergmann, S., Steinert, M. From single cells to engineered and explanted tissues: New perspectives in bacterial infection biology. International Reviews of Cell and Molecular Biology. 319, 1-44 (2015).
- Harrison, D. J., et al. Micromachining a miniaturized capillary electrophoresis-based chemical analysis system on a chip. Science. 261 (5123), 895-897 (1993).
- Magnusson, M. K., Mosher, D. F. Fibronectin: Structure, assembly, and cardiovascular implications. Arteriosclerosis, Thrombosis, and Vascular Biology. 18, 1363-1370 (1998).
- Zerlauth, G., Wolf, G. Plasma fibronectin as a marker for cancer and other diseases. The American Journal of Medicine. 77 (4), 685-689 (1984).
- Li, X. J., Valadez, A. V., Zuo, P., Nie, Z. 2012. Microfluidic 3D cell culture: potential application for tissue-based bioassays. Bioanalysis. 4, 1509-1525 (2019).
- Fiddes, L. K., et al. A circular cross-section PDMS microfluidics system for replication of cardiovascular flow conditions. Biomaterials. 31, 3459-3464 (2010).
- Schimek, K., et al. Integrating biological vasculature into a multi-organ-chip microsystem. Lab on a Chip. 13, 3588-3598 (2013).
- Pappelbaum, K. I., et al. Ultralarge von willebrand factor fibers mediate luminal Staphylococcus aureus adhesion to an intact endothelial cell layer under shear stress. Circulation. 128, 50-59 (2013).
- Schneider, S. W., et al. Shear-induced unfolding triggers adhesion of von willebrand factor fibers. Proceedings of the National Academy of Sciences of the United States of America. 104, 7899-7903 (2007).
- Reneman, R. S., Hoek, A. P. G. Wall shear stress as measured in vivo: consequences for the design of the arterial system. Medical & Biological Engineering & Computing. 46 (5), 499-507 (2008).
- Valentijn, K. M., Sadler, J. E., Valentijn, J. A., Voorberg, J., Eikenboom, J. Functional architecture of Weibel- Palade bodies. Blood. 117, 5033-5043 (2011).
- Freshney, R. I. . Culture of animal cells: A manual of basic Technique, 5th edition. , (2005).
- Shaw, J. A., Shaw, A. J. . Epithelial cell culture- a practical approach. , 218 (1996).
- Elm, C., et al. Ectodomains 3 and 4 of human polymeric Immunoglobulin receptor (hpIgR) mediate invasion of Streptococcus pneumoniae into the epithelium. Journal of Biological Chemistry. 279 (8), 6296-6304 (2004).
- Nerlich, A., et al. Invasion of endothelial cells by tissue-invasive M3 type group A streptococci requires Src kinase and activation of Rac1 by a phosphatidylinositol 3-kinase-independent mechanism. Journal of Biological Chemistry. 284 (30), 20319-20328 (2009).
- Ho, C. T., et al. Liver-cell patterning lab chip: mimicking the morphology of liver lobule tissue. Lab on a Chip. 13, 3578-3587 (2013).
- Huh, D., et al. Reconstituting organ-level lung functions on a chip. Science. 328, 1662-1668 (2010).
- Harink, B., Le Gac, S., Truckenmuller, R., van Blitterswijk, C., Habibovic, P. Regeneration-on-a-chip? The perspectives on use of microfluidics in regenerative medicine. Lab on a Chip. 13, 3512-3528 (2013).

