نموذج ثقافة الأعضاء التنكسية Proinflammatory لمحاكاة مرض القرص الفقري في مرحلة مبكرة.
Summary
يقدم هذا البروتوكول نموذجا تجريبيا جديدا لثقافة الأعضاء البقرية التنكسية proinflammatory لمحاكاة انحطاط القرص الفقري في مرحلة مبكرة.
Abstract
انحطاط القرص الفقري (IVD) أعراض (IDD) هو عبء اجتماعي واقتصادي كبير ويتميز التهاب وتدهور الأنسجة. بسبب عدم وجود العلاجات المسببة ، هناك حاجة ملحة لنماذج مبتكرة تجريبية لزراعة الأعضاء لدراسة الآليات المشاركة في تطور المرض ، وإيجاد أهداف علاجية ، والحد من الحاجة إلى نماذج حيوانية. نحن هنا نقدم رواية، بروتوكول نموذج ثقافة الجهاز ثلاثي الأبعاد تحاكي البيئة الدقيقة proinflammatory والكاتالية، والتي هي موجودة خلال IDD.
في البداية، تم تشريح ال IVDs caudal البقرية وتنظيفها واستزراعها في وسط زراعة الأنسجة. تم تطبيق التحميل الحيوي الفسيولوجي أو المرضي في مفاعل حيوي مصنوع خصيصا لمدة ساعتين يوميا. تم تعيين IVDs إلى مجموعة مراقبة (متوسط الجلوكوز العالي ، التحميل الفسيولوجي ، حقن ملحي عازل بالفوسفات) ومجموعة مرضية (متوسط الجلوكوز المنخفض ، التحميل المرضي ، حقن عامل نخر الورم ألفا) لمدة أربعة أيام. تم إجراء تحليل التعبير الجيني من خلايا اللبوسوس النواة التي تم جمعها من IVDs و المقايسة المناعية المرتبطة بالإنزيم لوسائط ثقافة الأعضاء المكيفة.
كشفت بياناتنا عن تعبير أعلى عن العلامات الالتهابية وانخفاض ارتفاعات القرص بعد التحميل في المجموعة المرضية مقارنة بمجموعة التحكم. هذا البروتوكول موثوق به لمحاكاة التهاب IVD وانحطاط ويمكن توسيعه لتوسيع نطاق تطبيقه.
Introduction
آلام أسفل الظهر (LBP) يمكن أن تؤثر على الأفراد من جميع الأعمار، وهو السبب الرئيسي للإعاقة في جميع أنحاء العالم1,2,3. التكلفة الإجمالية المرتبطة LBP يتجاوز 100 مليار دولار سنويا4،5. أعراض الضمور الفقري (IVD) انحطاط (IDD) ، وهي حالة تتميز التهاب وتدهور الأنسجة ، هو سبب رئيسي لLBP6،7. على وجه التحديد ، يتميز معرف الهوية بانهيار يتطور تدريجيا لمصفوفة IVD خارج الخلية (ECM) ، الناجمة والمحفزة بسبب عوامل متعددة تؤدي إلى تسارع الأمراض والاضطرابات العصبية ، والإعاقة في نهاية المطاف. وعلاوة على ذلك، ويرتبط معرف مع الإفراج عن السيتوكينات proinflammatory، غيرت الميكانيكا الحيوية العمود الفقري، تولد الأوعية، ونمو الأعصاب، مما يزيد من الإحساس بالألم، مما تسبب تماما LBP المزمن (اعتلال نشط)6،8. حتى الآن، تشمل خيارات العلاج استئصال القرص والانصهار اللاحق للفقرات المجاورة، وزرع بدلة IVD، أو النهج غير الجراحية، مثل الأدوية المضادة للالتهابات غير الستيرويدية، والمواد الأفيونية، ومرخيات العضلات للمرضى الذين يعانون من الهوية9. كلا الخيارات العلاجية القياسية الحالية، الجراحية وغير الجراحية، هي فقط فعالة جزئيا وتفشل في معالجة المشكلة البيولوجية الكامنة9،10. يتميز مرض القرص التنكسية في مرحلة مبكرة من استجابة الأنسجة الالتهابية الأولية ، وخاصة زيادة في عامل نخر الورم ألفا (TNF-alpha) التعبير11. تحدث هذه التغييرات المبكرة في القرص في المقام الأول على المستوى الخلوي دون تعطيل بنية القرص ويمكن محاكاتها سابقا بسبب نقص التغذية في ظل ظروف مؤيدة للالتهابات12. لذلك ، فإن المحاكاة الدقيقة للوضع في الجسم الحي للتحقيق في آليات الانحطاط هذه وإيجاد أهداف علاجية مناسبة أمر بالغ الأهمية. بالإضافة إلى ذلك ، إلى هذه المحاكاة من الخصائص الجزيئية ، وبيئة التحميل الميكانيكية للأقراص يلعب دورا رئيسيا في التغيرات المرضية والفسيولوجية من IVD. وبالتالي، فإن الجمع بين هذه النهج من شأنه أن يقودنا خطوة إلى الأمام لمحاكاة البيئة الدقيقة المعقدة لل IVDs في الجسم الحي. لا توجد حاليا دراسات النظر في جانب التحميل الديناميكي جنبا إلى جنب مع الإعداد الموالية للالتهابات والتغذية على حد علمنا.
على الرغم من أن النماذج الحيوانية الكبيرة تسمح بالتحقيق في التفاعلات المحتملة ذات الصلة في الجسم الحي ، إلا أنها مكلفة وتعمل بشكل مكثف. وعلاوة على ذلك، وبما أن استخدام النماذج الحيوانية في البحوث كان لفترة طويلة موضع جدل، فإن تخفيض عدد الحيوانات اللازمة للإجابة على أسئلة بحثية هامة أمر بالغ الأهمية. وأخيرا، لا يوجد حاليا نموذج حيواني مثالي لمحاكاة معرف في أبحاث IVD13،14. لذلك ، من الضروري إنشاء بديل فعال من حيث التكلفة وموثوق به ، مثل نموذج ثقافة الأعضاء لمحاكاة الهوية والعمليات الالتهابية والتنكسية المرتبطة بها. في الآونة الأخيرة ، سمح لنا تطبيق البروتوكول الحالي بشأن إنشاء نموذج ثقافة الأعضاء التنكسية والتنكسية لمحاكاة مرض القرص الفقري في مرحلة مبكرة بالتحقيق في تأثير الأدوية المضادة للالتهابات في ثقافة الجهاز IDD15.
هنا، ونحن نصف كيفية الحصول على أقراص الفقرية البقرية والحث على حالة معرف المرحلة المبكرة عن طريق البيئة الدقيقة تقويضي وبروينفلامماتوري الناجمة عن الحقن الداخلي المباشر للورم نخر عامل ألفا (TNF-α) والتحميل التنكسية في مفاعل حيوي في ظل ظروف متوسطة منخفضة التغذية. يوضح الشكل 1 النموذج التجريبي ويظهر المفاعل الحيوي المستخدم لمحاكاة ظروف التحميل التنكسية والفسيولوجية.
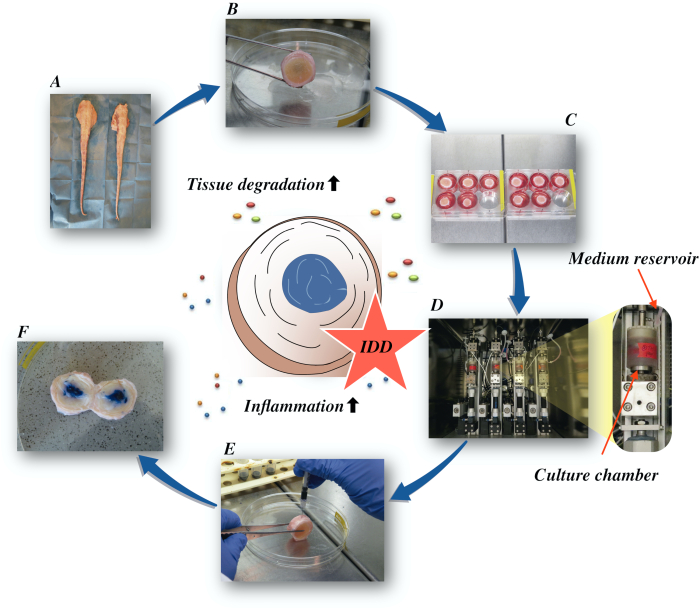
الشكل 1: توضيح الإعداد التجريبي. أ: ذيل البقر; ب: تشريح الأقراص الفقرية البقرية; ج: نقل القرص إلى لوحة جيدة مع الثقافة المتوسطة؛ D: تحميل المحاكاة في مفاعل حيوي؛ E: تقنية الحقن داخل الفصيلة; F: IVD بعد حقن PBS / تريبان صبغة زرقاء للكشف عن التوزيع. معرف: انحطاط القرص الفقري. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
Representative Results
Discussion
نحن هنا قدمنا بروتوكول مفصل لمحاكاة الأمراض التنكسية والالتهابية IVDD. يمكن تطبيق هذا البروتوكول لإجراء فحوصات مفصلة للمسارات الالتهابية مما يؤدي إلى الآثار المدمرة على القرص. وعلاوة على ذلك، يمكن أن يساعد البروتوكول في تحديد الأهداف العلاجية الواعدة التي ينطوي عليها تطور المرض.
<p class="jo…Disclosures
The authors have nothing to disclose.
Acknowledgements
وقد تم دعم هذا العمل من قبل مؤسسة AO وOSpine الدولية. تلقى باباك سارافي دعم الزمالة من المؤسسة الألمانية للعمود الفقري والمؤسسة الألمانية لهشاشة العظام. تم دعم جيرنوت لانغ من قبل برنامج بيرتا-أوتنشتاين للعلماء السريريين المتقدمين، كلية الطب، جامعة فرايبورغ، ألمانيا.
Materials
| 1-Bromo-3-chloropropane(BCP) | Sigma-Aldrich, St. Louis, USA | B9673 | |
| Ascorbate-2-phosphate | Sigma-Aldrich, St. Louis, USA | A8960 | |
| Band saw | Exakt Apparatebau, Norderstedt, Germany | model 30/833 | |
| Betadine | Munndipharma, Frankfurt, Germany | ||
| Bovine IL-8 Do.it-Yourself ELISA | Kingfisher Biotech, St. Paul, USA | DIY1028B-003 | |
| Corning ITS Premix | Corning Inc., New York, USA | 354350 | |
| DMEM high glucose | Gibco by life technologies, Carlsbad, USA | 10741574 | |
| DMEM low glucose | Gibco by life technologies, Carlsbad, USA | 11564446 | |
| Ethanol for molecular biology | Sigma-Aldrich, St. Louis, USA | 09-0851 | |
| Fetal Bovine Serum (FBS) | Gibco by life technologies, Carlsbad, USA | A4766801 | |
| Non-essential amino acid solution | Gibco by life technologies, Carlsbad, USA | 11140050 | |
| Penicillin/Streptomycin(P/S) | gibco by life technologies, Carlsbad, USA | 11548876 | |
| Phosphate Buffer Solution, tablet | Sigma-Aldrich, St. Louis, USA | P4417 | |
| Pronase | Sigma-Aldrich, St. Louis, USA | 10165921001 | |
| Primocin | InvivoGen, Sandiego, USA | ant-pm-05 | |
| Pulsavac Jet Lavage System | Zimmer, IN,USA | ||
| TissueLyser II | Quiagen, Venlo, Netherlands | 85300 | |
| Streptavidinn-HRP | Kingfisher Biotech, St. Paul, USA | AR0068-001 | |
| Superscript VILO | Invitrogen by life Technologies, Carlsbad, USA | 10704274 | |
| cDNA Synthesis Kit | Applied Biosystems by life technologies | 10400745 | |
| TaqMan Universal Master Mix | Applied Biosystems by life technologies | ||
| TNF-alpha, recombinant human protein | R&D systems, Minnesota, USA | 210-TA-005 | |
| TRI Reagent | Molecular Research Center, Cincinnati, USA | TR 118 | |
| Tris-EDTA buffer solution | sigma-Aldrich, St. Louis, USA | 93283 | |
| Gene bIL-6 | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) TTC CAA AAA TGG AGG AAA AGG A Primer rev (5′–3′) TCC AGA AGA CCA GCA GTG GTT Probe (5′FAM/3′TAMRA) CTT CCA ATC TGG GTT CAA TCA GGC GATT |
| Gene bIL8 | Applied Biosystems by life technologies | Bt03211906_m1 | |
| Gene bTNF-alpha | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) CCT CTT CTC AAG CCT CAA GTA ACA A Primer rev (5′–3′) GAG CTG CCC CGG AGA GTT Probe (5′FAM/3′TAMRA) ATG TCG GCT ACA ACG TGG GCT ACC G |
| GENE bIL1beta | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) TTA CTA CAG TGA CGA GAA TGA GCT GTT Primer rev (5′–3′) GGT CCA GGT GTT GGA TGC A Probe (5′FAM/3′TAMRA) CTC TTC ATC TGT TTA GGG TCA TCA GCC TCA A |
| RPLP0 | Applied Biosystems by life technologies | Bt03218086_m1 |
References
- Vos, T., et al. Global, regional, and national incidence, prevalence, and years lived with disability for 328 diseases and injuries for 195 countries, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. The Lancet. 390 (10100), 1211-1259 (2017).
- Hoy, D., et al. Measuring the global burden of low back pain. Best Practice & Research Clinical Rheumatology. 24 (2), 155-165 (2010).
- Thiese, M. S., et al. Prevalence of low back pain by anatomic location and intensity in an occupational population. BMC Musculoskeletal Disorders. 15 (1), 283 (2014).
- Katz, J. N. Lumbar Disc Disorders and Low-Back Pain: Socioeconomic Factors and Consequences. The Journal of Bone and Joint Surgery (American). 88, 21 (2006).
- Vlaeyen, J. W. S., et al. Low back pain. Nature Reviews Disease Primers. 4 (1), 52 (2018).
- Khan, A. N., et al. Inflammatory biomarkers of low back pain and disc degeneration: a review: Biomarkers of disc degeneration and back pain. Annals of the New York Academy of Sciences. 1410 (1), 68-84 (2017).
- Kim, H. S., Wu, P. H., Jang, I. T. Lumbar Degenerative Disease Part 1: Anatomy and Pathophysiology of Intervertebral Discogenic Pain and Radiofrequency Ablation of Basivertebral and Sinuvertebral Nerve Treatment for Chronic Discogenic Back Pain: A Prospective Case Series and Review of Literature. International Journal of Molecular Sciences. 21 (4), 1483 (2020).
- Adams, M. A., Roughley, P. J. What is Intervertebral Disc Degeneration, and What Causes It. Spine. 31 (18), 2151-2161 (2006).
- Wu, P. H., Kim, H. S., Jang, I. T. Intervertebral Disc Diseases Part 2: A Review of the Current Diagnostic and Treatment Strategies for Intervertebral Disc Disease. International Journal of Molecular Sciences. 21 (6), 2135 (2020).
- Lurie, J. D., et al. Surgical Versus Nonoperative Treatment for Lumbar Disc Herniation: Eight-Year Results for the Spine Patient Outcomes Research Trial. Spine. 39 (1), 3-16 (2014).
- Risbud, M. V., Shapiro, I. M. Role of cytokines in intervertebral disc degeneration: pain and disc content. Nature Reviews Rheumatology. 10 (1), 44-56 (2014).
- Ponnappan, R. K., et al. An organ culture system to model early degenerative changes of the intervertebral disc. Arthritis Research & Therapy. 13 (5), 171 (2011).
- O’Connell, G. D., Vresilovic, E. J., Elliott, D. M. Comparison of Animals Used in Disc Research to Human Lumbar Disc Geometry. Spine. 32 (3), 328-333 (2007).
- Stannard, J. T., et al. Development of a whole organ culture model for intervertebral disc disease. Journal of Orthopaedic Translation. 5, 1-8 (2016).
- Li, Z., et al. Preclinical ex-vivo Testing of Anti-inflammatory Drugs in a Bovine Intervertebral Degenerative Disc Model. Frontiers in Bioengineering and Biotechnology. 8, 583 (2020).
- Li, Z., et al. Development of an ex vivo cavity model to study repair strategies in loaded intervertebral discs. European Spine Journal. 25 (9), 2898-2908 (2016).
- Kazezian, Z., Li, Z., Alini, M., Grad, S., Pandit, A. Injectable hyaluronic acid down-regulates interferon signaling molecules, IGFBP3 and IFIT3 in the bovine intervertebral disc. Acta Biomaterialia. 52, 118-129 (2017).
- Caprez, S., Menzel, U., Li, Z., Grad, S., Alini, M., Peroglio, M. Isolation of high-quality RNA from intervertebral disc tissue via pronase predigestion and tissue pulverization. JOR Spine. 1 (2), 1017 (2018).
- Lopa, S., Ceriani, C., Cecchinato, R., Zagra, L., Moretti, M., Colombini, A. Stability of housekeeping genes in human intervertebral disc, endplate and articular cartilage cells in multiple conditions for reliable transcriptional analysis. European Cells & Materials. 31, 395-406 (2016).
- Lang, G., et al. An intervertebral disc whole organ culture system to investigate proinflammatory and degenerative disc disease condition. Journal of Tissue Engineering and Regenerative Medicine. 12 (4), 2051-2061 (2018).
- Du, J., et al. Proinflammatory intervertebral disc cell and organ culture models induced by tumor necrosis factor alpha. JOR Spine. 3, 1104 (2020).
- Purmessur, D., Walter, B. A., Roughley, P. J., Laudier, D. M., Hecht, A. C., Iatridis, J. A role for TNFα in intervertebral disc degeneration: A non-recoverable catabolic shift. Biochemical and Biophysical Research Communications. 433 (1), 151-156 (2013).
- Walter, B. A., Likhitpanichkul, M., Illien-Junger, S., Roughley, P. J., Hecht, A. C., Iatridis, J. C. TNFα Transport Induced by Dynamic Loading Alters Biomechanics of Intact Intervertebral Discs. PLOS One. 10 (3), 0118358 (2015).
- Gullbrand, S. E., et al. A large animal model that recapitulates the spectrum of human intervertebral disc degeneration. Osteoarthritis and Cartilage. 25 (1), 146-156 (2017).
- Willems, N., et al. Safety of intradiscal injection and biocompatibility of polyester amide microspheres in a canine model predisposed to intervertebral disc degeneration: intradiscal application of pea microspheres. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 105 (4), 707-714 (2017).
- Michalek, A. J., Buckley, M. R., Bonassar, L. J., Cohen, I., Iatridis, J. C. The effects of needle puncture injury on microscale shear strain in the intervertebral disc annulus fibrosus. The Spine Journal. 10 (12), 1098-1105 (2010).
- Illien-Jünger, S., et al. The combined effects of limited nutrition and high-frequency loading on intervertebral discs with endplates. Spine. 35 (19), 1744-1752 (2010).
- Gantenbein, B., et al. Organ culture bioreactors–platforms to study human intervertebral disc degeneration and regenerative therapy. Current Stem Cell Research & Therapy. 10 (4), 339-352 (2015).
- Boubriak, O. A., Watson, N., Sivan, S. S., Stubbens, N., Urban, J. P. G. Factors regulating viable cell density in the intervertebral disc: blood supply in relation to disc height. Journal of Anatomy. 222 (3), 341-348 (2013).
- Maroudas, A., Stockwell, R. A., Nachemson, A., Urban, J. Factors involved in the nutrition of the human lumbar intervertebral disc: cellularity and diffusion of glucose in vitro. Journal of Anatomy. 120, 113-130 (1975).
- Beckstein, J. C., Sen, S., Schaer, T. P., Vresilovic, E. J., Elliott, D. M. Comparison of Animal Discs Used in Disc Research to Human Lumbar Disc: Axial Compression Mechanics and Glycosaminoglycan Content. Spine. 33 (6), 166-173 (2008).
- Walter, B. A., Illien-Jünger, S., Nasser, P. R., Hecht, A. C., Iatridis, J. C. Development and validation of a bioreactor system for dynamic loading and mechanical characterization of whole human intervertebral discs in organ culture. Journal of Biomechanics. 47 (9), 2095-2101 (2014).
- Rajan, N. E., et al. Toll-Like Receptor 4 (TLR4) Expression and Stimulation in a Model of Intervertebral Disc Inflammation and Degeneration. Spine. 38 (16), 1343-1351 (2013).
- vanden Akker, G. G., Rorije, A. J., Davidson, E. N. B., vander Kraan, P. M. Phenotypic marker genes distinguish inner and outer annulus fibrosus from nucleus pulposus tissue in the bovine intervertebral disc. Osteoarthritis and Cartilage. 25, 402 (2017).
- Du, J., et al. Functional cell phenotype induction with TGF-β1 and collagen-polyurethane scaffold for annulus fibrosus rupture repair. European Cells & Materials. 39, 1-17 (2020).
- Risbud, M. V., et al. Defining the phenotype of young healthy nucleus pulposus cells: recommendations of the Spine Research Interest Group at the 2014 annual ORS meeting. Journal of Orthopaedic Research: Official Publication of the Orthopaedic Research Society. 33 (3), 283-293 (2015).

