神经节苷脂提取、纯化和分析
Summary
神经节苷脂是含唾液酸的鞘糖脂,在大脑中特别丰富。它们的两性性质需要有机/水提取和纯化技术,以确保最佳的回收率和准确的分析。本文概述了分析和制备规模的神经节苷脂提取,纯化和薄层色谱分析。
Abstract
神经节苷脂是含有一种或多种唾液酸残基的鞘氨醇脂。它们存在于所有脊椎动物细胞和组织上,但在大脑中特别丰富。它们主要在细胞质膜的外叶上表达,通过横向关联调节细胞表面蛋白的活性,在细胞 – 细胞相互作用中充当受体,并且是病原体和毒素的靶标。人类神经节苷脂生物合成的遗传失调导致严重的先天性神经系统疾病。由于其两性性质,神经节苷脂的提取,纯化和分析需要许多研究人员自发现以来80年来已经优化的技术。在这里,我们描述了用于从组织和细胞中提取,纯化以及主要神经节苷脂的初步定性和定量分析的台级方法,这些方法可以在几个小时内完成。我们还描述了从大脑中更大规模地分离和纯化主要神经节苷脂物种的方法。总之,这些方法为这类生物活性分子提供了分析和制备规模的访问。
Introduction
神经节苷脂被定义为含有一种或多种唾液酸残基的鞘氨醇脂1。它们主要在细胞表面表达,其疏水性神经酰胺脂质部分嵌入质膜的外小叶中,亲水聚糖延伸到细胞外空间2。虽然它们广泛分布在脊椎动物细胞和组织中,但它们在脊椎动物的大脑中特别丰富3,它们在那里首次被发现并命名4。
神经节苷脂聚糖的结构各不相同,是其命名法的基础(图1)。神经节苷脂聚糖由中性糖核组成,具有不同数量和分布的唾液酸。最小的神经节苷脂GM4只有两种糖(唾液酸与半乳糖结合)5。较大的天然神经节苷脂可能含有十几种总糖6 或多达七种唾液酸,单个中性核心7。它们的神经酰胺脂质部分也各不相同,具有不同的鞘氨醇长度和多种脂肪酸酰胺。在脊椎动物的大脑中,有四种神经节苷脂,GM1,GD1a,GD1b和GT1b占主导地位。神经节苷脂表达具有发育调控性、组织特异性和细胞类型特异性。
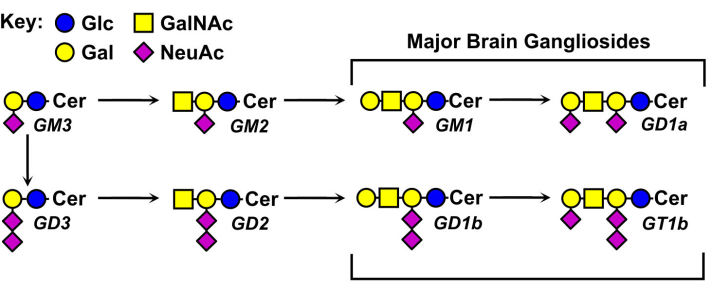
图1:主要的脑神经节苷脂及其生物合成前体。 结构使用聚糖符号命名法显示11。 请点击此处查看此图的放大版本。
神经节苷脂通过在其自身膜中参与和调节蛋白质(顺式调节)或通过在细胞外环境中参与聚糖结合蛋白,包括其他细胞上的细菌毒素和凝集素(反式识别)在分子水平上起作用3。神经节苷脂与调节蛋白的特异性结合和/或与其他分子的自关联转化为脂筏导致细胞行为的变化,从而影响神经系统结构和功能、癌症进展、代谢、炎症、神经元蛋白病和传染病8。由于它们的细胞作用多种多样,它们的分离和分析方法可以增强对生理和病理过程调节的见解。在这里,提供了经过验证的快速小规模提取和分析方法,以及从大脑中分离神经节苷脂的制备性规模。讨论了应用于其他组织的机遇和挑战。
Protocol
Representative Results
Discussion
这里报道的小规模和大尺度神经节苷脂提取和分离方法并非独一无二 – 有许多不同的溶剂提取和纯化方法可提供出色的结果12。这里报道的从Fredman和Svennerholm13中进行小规模纯化的大脑的方法被证明可以优化恢复,并且多年来在我们的实验室中已被证明是强大而直接的。适用于TLC和MS的分离和纯化可以在几个小时内从完整组织到分离的神经节苷脂轻松完成。MS可?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
这项工作得到了美国国立卫生研究院(NIH)糖科学共同基金U01CA241953的支持。MJP得到了约翰霍普金斯大学化学 – 生物学界面计划(T32GM080189)的支持。
Materials
| Bovine brain, stripped | PelFreez | 57105-1 | |
| Ganglioside standards | Matreya | GM1, 1061; GD1a, 1062; GD1b, 1501; GT1b, 1063 | |
| Glass bottle with PTFE-lined cap | Fisher Scientific | 02-911-739 | |
| Glass centrifuge bottle | Fisher Scientific | 05-586B | |
| Glass culture tubes, 16 x 125 mm | VWR | 60825-430 | for collecting HPLC fractions |
| Glass separatory funnel (2 L) | Pyrex | 6400-2L | |
| Injection syringe – Hamilton 1750 gastight 500 µl | Hamilton | 81265 | |
| p-Anisaldehyde, 98% | Sigma-Aldrich | A88107 | |
| Potter-Elvhjem Homogenizer | Fisher Scientific | 08-414-14A | Choose appropriate volume option |
| Reprosil 100 NH2 10µm 5x4mm guard columns | Analytics-Shop | AAVRS1N-100540-5 | |
| Reprospher 100 NH2, 5 μm, 250 mm x 20 mm HPLC column | Analytics-Shop | custom packed | other sizes available |
| Resorcinol | Sigma-Aldrich | 30752-1 | |
| Rotary evaporator | Buchi | R-300 | |
| Sample loop for Model 7725 Injector (5 ml) | Sigma-Aldrich | 57632 | |
| Sep-Pak tC18 Cartidges Vac 35 cc (10 g) | Waters | WAT043350 | |
| Sep-Pak tC18 Plus Short Cartridge, 400 mg | Waters | WAT036810 | |
| Spotting syringe – Hamilton 701N 10 µl | Hamilton | 80300 | |
| Thick-walled 13-mm diameter test tubes with PFTE lined caps | Fisher Scientific | 14-933A | |
| Threaded 2-ml vials with PFTE lined caps | Fisher Scientific | 14-955-323 | For ganglioside storage |
| TLC plates, HPTLC Silica gel 60 F254 Multiformat | Fisher Scientific | M1056350001 | Fluorescence impregnation (F254) stabilizes the sorbent surface |
| TLC reagent sprayer | Fisher Scientific | 05-723-26A | |
| TLC running chamber for 10 x 10 cm plates | Camag | 22.5155 | |
| Waring 1-Liter Stainless Steal Explosion Resistant Blender | Waring | E8520 |
References
- Schnaar, R. L. The Biology of Gangliosides. Advances in Carbohydrate Chemistry and Biochemistry. 76, 113-148 (2019).
- DeMarco, M. L., Woods, R. J. Atomic-resolution conformational analysis of the GM3 ganglioside in a lipid bilayer and its implications for ganglioside-protein recognition at membrane surfaces. Glycobiology. 19 (4), 344-355 (2009).
- Schnaar, R. L. Gangliosides of the vertebrate nervous system. Journal of Molecular Biology. 428, 3325-3336 (2016).
- Klenk, E. Über die Ganglioside, eine neue Gruppe von zuckerhaltigen Gehirnlipoiden [About gangliosides, a new group of sugar-containing brain lipids]. Hoppe-Seyler’s Zeitschrift für Physiologische Chemie. 273, 76-86 (1942).
- Uemura, S., Go, S., Shishido, F., Inokuchi, J. Expression machinery of GM4: the excess amounts of GM3/GM4S synthase (ST3GAL5) are necessary for GM4 synthesis in mammalian cells. Glycoconjugate Journal. 31 (2), 101-108 (2014).
- Nimrichter, L., et al. E-selectin receptors on human leukocytes. Blood. 112 (9), 3744-3752 (2008).
- Saito, M., Kitamura, H., Sugiyama, K. A novel heptasialosyl c-series ganglioside in embryonic chicken brain: its structure and stage-specific expression. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 1571 (1), 18-26 (2002).
- Todeschini, A. R., Hakomori, S. I. Functional role of glycosphingolipids and gangliosides in control of cell adhesion, motility, and growth, through glycosynaptic microdomains. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 1780 (3), 421-433 (2008).
- Sturgill, E. R., et al. Biosynthesis of the major brain gangliosides GD1a and GT1b. Glycobiology. 22, 1289-1301 (2012).
- Cavdarli, S., Delannoy, P., Groux-Degroote, S. O-Acetylated gangliosides as targets for cancer immunotherapy. Cells. 9 (3), (2020).
- Varki, A., et al. Symbol nomenclature for graphical representations of glycans. Glycobiology. 25 (12), 1323-1324 (2015).
- Schnaar, R. L. Isolation of glycosphingolipids. Methods in Enzymology. 230, 348-370 (1994).
- Svennerholm, L., Fredman, P. A procedure for the quantitative isolation of brain gangliosides. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 617, 97-109 (1980).
- Tettamanti, G., Bonali, F., Marchesini, S., Zambotti, V. A new procedure for the extraction, purification and fractionation of brain gangliosides. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 296, 160-170 (1973).
- Gazzotti, G., Sonnino, S., Ghidoni, R. Normal-phase high-performance liquid chromatographic separation of non-derivatized ganglioside mixtures. Journal of Chromatography. 348, 371-378 (1985).
- Schnaar, R. L., Needham, L. K. Thin-layer chromatography of glycosphingolipids. Methods in Enzymology. 230, 371-389 (1994).
- Ledeen, R. W., Yu, R. K. Gangliosides: structure, isolation, and analysis. Methods in Enzymology. 83, 139-191 (1982).
- Lopez, P. H., et al. Mice lacking sialyltransferase ST3Gal-II develop late-onset obesity and insulin resistance. Glycobiology. 27 (2), 129-139 (2017).

