Ganglioside 추출, 정제 및 프로파일링
Summary
강글리오사이드는 시알산 함유 글리코스핑고지질로서 뇌에 특히 풍부하다. 양친매성 성질은 최적의 회수와 정확한 분석을 보장하기 위해 유기/수성 추출 및 정제 기술을 필요로 합니다. 이 기사에서는 분석 및 분취 스케일 강글리오사이드 추출, 정제 및 박층 크로마토그래피 분석에 대한 개요를 제공합니다.
Abstract
강글리오시드는 하나 이상의 시알산 잔기를 함유하는 글리코스핑고지질이다. 그들은 모든 척추 동물 세포와 조직에서 발견되지만 특히 뇌에 풍부합니다. 주로 세포의 원형질막의 외부 전단지에서 발현되며, 측면 연결을 통해 세포 표면 단백질의 활동을 조절하고 세포 – 세포 상호 작용에서 수용체 역할을하며 병원균 및 독소의 표적입니다. 인간에서 강글리오사이드 생합성의 유전적 조절은 심각한 선천성 신경계 장애를 초래한다. 양친매성 특성으로 인해 강글리오사이드의 추출, 정제 및 분석에는 발견 이후 80 년 동안 많은 연구자가 최적화 한 기술이 필요합니다. 여기에서는 몇 시간 안에 완료 할 수있는 조직 및 세포에서 주요 강글리오사이드의 추출, 정제 및 예비 정성 및 정량 분석을위한 벤치 수준의 방법을 설명합니다. 우리는 또한 뇌에서 주요 강글리오사이드 종의 대규모 분리 및 정제를위한 방법을 설명합니다. 함께, 이러한 방법은 생리 활성 분자의이 클래스에 대한 분석 및 준비 규모 액세스를 제공합니다.
Introduction
강글리오시드는 하나 이상의 시알산 잔기를 보유하는 글리코스핑고지질1로 정의된다. 이들은 주로 원형질막의 외부 전단지에 매립된 그들의 소수성 세라미드 지질 모이어티와 세포외 공간으로 연장되는 그들의 친수성 글리칸과 함께 세포 표면에서 발현된다2. 척추 동물 세포와 조직에 널리 분포되어 있지만, 척추 동물의 뇌3에 특히 풍부하며, 처음 발견되어 명명되었습니다4.
강글리오사이드 글리칸의 구조는 다양하며 그 명명법의 기초가 됩니다(그림 1). Ganglioside 글리칸은 시알산의 다른 수와 분포를 지닌 중성 설탕 코어로 구성됩니다. 가장 작은 강글리오사이드인 GM4는 단 두 개의 설탕(갈락토오스에 결합된 시알산)5만을 가지고 있다. 더 큰 자연 발생 신경절은 단일 중성 코어에 수십 개의 총 설탕6 또는 최대 일곱 개의 시알산을 함유할 수 있습니다7. 이들의 세라미드 지질 모이어티는 또한 다양하며, 상이한 스핑고신 길이 및 다양한 지방산 아미드를 갖는다. 척추 동물의 뇌에서 네 개의 강글리오사이드 종, GM1, GD1a, GD1b 및 GT1b가 우세하다. 강글리오시드 발현은 발달적으로 조절되고, 조직 특이적이며, 세포 유형 특이적이다.
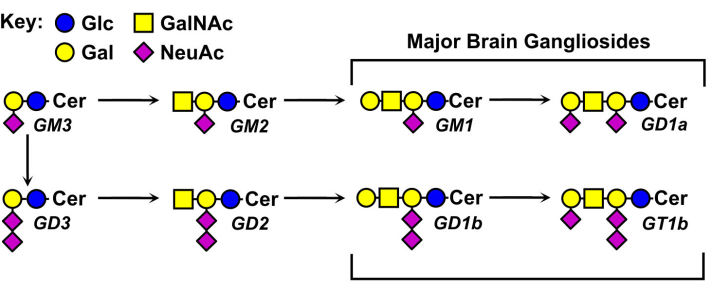
그림 1: 주요 뇌 신경절과 그들의 생합성 전구체. 구조는 Glycans11에 대한 기호 명명법을 사용하여 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
강글리오시드는 자신의 막에 단백질을 결합시키고 조절함으로써(시스 조절) 또는 다른 세포 상의 박테리아 독소 및 렉틴을 포함하는 세포외 환경에서 글리칸 결합 단백질을 결합시킴으로써(트랜스 인식)3 분자 수준에서 기능한다. 조절 단백질에 대한 강글리오사이드의 특이적 결합 및/또는 지질 뗏목으로의 다른 분자와의 자기 연관성은 신경계 구조 및 기능, 암 진행, 신진대사, 염증, 신경 단백질 병증 및 감염성 질환에 영향을 미치는 세포 행동의 변화를 초래한다8. 그들의 다양한 세포 역할 때문에, 그들의 분리 및 분석을위한 방법은 생리 학적 및 병리학 적 과정의 조절에 대한 향상된 통찰력을 제공 할 수 있습니다. 여기에서는 신속한 소규모 추출 및 분석을위한 검증 된 방법과 뇌에서 강글리오사이드의 준비 규모 분리가 제공됩니다. 다른 조직에 적용 할 수있는 기회와 도전이 논의됩니다.
Protocol
Representative Results
Discussion
여기에 보고된 소규모 및 대규모 강글리오시드 추출 및 단리를 위한 방법은 독특하지 않다-우수한 결과를 제공하는 많은 상이한 용매 추출 및 정제 접근법이 있다12. Fredman과 Svennerholm13의 뇌로부터의 소규모 정화를 위해 여기에 보고된 방법은 회복을 최적화하는 것으로 나타났으며 우리 실험실에서 수년 동안 견고하고 직접적인 것으로 입증되었습니다. TLC 및 MS…
Divulgations
The authors have nothing to disclose.
Acknowledgements
이 연구는 국립 보건원 (NIH) 글리코 사이언스 보조금 U01CA241953을위한 공통 기금에 의해 지원되었습니다. MJP는 존스 홉킨스 (T32GM080189)의 화학 생물학 인터페이스 프로그램 (T32GM080189)의 지원을 받았다.
Materials
| Bovine brain, stripped | PelFreez | 57105-1 | |
| Ganglioside standards | Matreya | GM1, 1061; GD1a, 1062; GD1b, 1501; GT1b, 1063 | |
| Glass bottle with PTFE-lined cap | Fisher Scientific | 02-911-739 | |
| Glass centrifuge bottle | Fisher Scientific | 05-586B | |
| Glass culture tubes, 16 x 125 mm | VWR | 60825-430 | for collecting HPLC fractions |
| Glass separatory funnel (2 L) | Pyrex | 6400-2L | |
| Injection syringe – Hamilton 1750 gastight 500 µl | Hamilton | 81265 | |
| p-Anisaldehyde, 98% | Sigma-Aldrich | A88107 | |
| Potter-Elvhjem Homogenizer | Fisher Scientific | 08-414-14A | Choose appropriate volume option |
| Reprosil 100 NH2 10µm 5x4mm guard columns | Analytics-Shop | AAVRS1N-100540-5 | |
| Reprospher 100 NH2, 5 μm, 250 mm x 20 mm HPLC column | Analytics-Shop | custom packed | other sizes available |
| Resorcinol | Sigma-Aldrich | 30752-1 | |
| Rotary evaporator | Buchi | R-300 | |
| Sample loop for Model 7725 Injector (5 ml) | Sigma-Aldrich | 57632 | |
| Sep-Pak tC18 Cartidges Vac 35 cc (10 g) | Waters | WAT043350 | |
| Sep-Pak tC18 Plus Short Cartridge, 400 mg | Waters | WAT036810 | |
| Spotting syringe – Hamilton 701N 10 µl | Hamilton | 80300 | |
| Thick-walled 13-mm diameter test tubes with PFTE lined caps | Fisher Scientific | 14-933A | |
| Threaded 2-ml vials with PFTE lined caps | Fisher Scientific | 14-955-323 | For ganglioside storage |
| TLC plates, HPTLC Silica gel 60 F254 Multiformat | Fisher Scientific | M1056350001 | Fluorescence impregnation (F254) stabilizes the sorbent surface |
| TLC reagent sprayer | Fisher Scientific | 05-723-26A | |
| TLC running chamber for 10 x 10 cm plates | Camag | 22.5155 | |
| Waring 1-Liter Stainless Steal Explosion Resistant Blender | Waring | E8520 |
References
- Schnaar, R. L. The Biology of Gangliosides. Advances in Carbohydrate Chemistry and Biochemistry. 76, 113-148 (2019).
- DeMarco, M. L., Woods, R. J. Atomic-resolution conformational analysis of the GM3 ganglioside in a lipid bilayer and its implications for ganglioside-protein recognition at membrane surfaces. Glycobiology. 19 (4), 344-355 (2009).
- Schnaar, R. L. Gangliosides of the vertebrate nervous system. Journal of Molecular Biology. 428, 3325-3336 (2016).
- Klenk, E. Über die Ganglioside, eine neue Gruppe von zuckerhaltigen Gehirnlipoiden [About gangliosides, a new group of sugar-containing brain lipids]. Hoppe-Seyler’s Zeitschrift für Physiologische Chemie. 273, 76-86 (1942).
- Uemura, S., Go, S., Shishido, F., Inokuchi, J. Expression machinery of GM4: the excess amounts of GM3/GM4S synthase (ST3GAL5) are necessary for GM4 synthesis in mammalian cells. Glycoconjugate Journal. 31 (2), 101-108 (2014).
- Nimrichter, L., et al. E-selectin receptors on human leukocytes. Blood. 112 (9), 3744-3752 (2008).
- Saito, M., Kitamura, H., Sugiyama, K. A novel heptasialosyl c-series ganglioside in embryonic chicken brain: its structure and stage-specific expression. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 1571 (1), 18-26 (2002).
- Todeschini, A. R., Hakomori, S. I. Functional role of glycosphingolipids and gangliosides in control of cell adhesion, motility, and growth, through glycosynaptic microdomains. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 1780 (3), 421-433 (2008).
- Sturgill, E. R., et al. Biosynthesis of the major brain gangliosides GD1a and GT1b. Glycobiology. 22, 1289-1301 (2012).
- Cavdarli, S., Delannoy, P., Groux-Degroote, S. O-Acetylated gangliosides as targets for cancer immunotherapy. Cells. 9 (3), (2020).
- Varki, A., et al. Symbol nomenclature for graphical representations of glycans. Glycobiology. 25 (12), 1323-1324 (2015).
- Schnaar, R. L. Isolation of glycosphingolipids. Methods in Enzymology. 230, 348-370 (1994).
- Svennerholm, L., Fredman, P. A procedure for the quantitative isolation of brain gangliosides. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 617, 97-109 (1980).
- Tettamanti, G., Bonali, F., Marchesini, S., Zambotti, V. A new procedure for the extraction, purification and fractionation of brain gangliosides. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 296, 160-170 (1973).
- Gazzotti, G., Sonnino, S., Ghidoni, R. Normal-phase high-performance liquid chromatographic separation of non-derivatized ganglioside mixtures. Journal of Chromatography. 348, 371-378 (1985).
- Schnaar, R. L., Needham, L. K. Thin-layer chromatography of glycosphingolipids. Methods in Enzymology. 230, 371-389 (1994).
- Ledeen, R. W., Yu, R. K. Gangliosides: structure, isolation, and analysis. Methods in Enzymology. 83, 139-191 (1982).
- Lopez, P. H., et al. Mice lacking sialyltransferase ST3Gal-II develop late-onset obesity and insulin resistance. Glycobiology. 27 (2), 129-139 (2017).

