Gangliosidekstraktion, rensning og profilering
Summary
Gangliosider er sialinsyrebærende glycosphingolipider, der er særligt rigelige i hjernen. Deres amfipatiske natur kræver organiske/vandige ekstraktions- og rensningsteknikker for at sikre optimal genvinding og nøjagtige analyser. Denne artikel indeholder oversigter over analytisk og præparativ skala gangliosidekstraktion, oprensning og tyndtlagskromatografianalyse.
Abstract
Gangliosider er glycosphingolipider, der indeholder en eller flere sialinsyrerester. De findes på alle hvirveldyrceller og væv, men er især rigelige i hjernen. Udtrykt primært på den ydre folder af plasmamembranerne i celler modulerer de aktiviteterne af celleoverfladeproteiner via lateral association, fungerer som receptorer i celle-celleinteraktioner og er mål for patogener og toksiner. Genetisk dysregulering af gangliosidbiosyntese hos mennesker resulterer i alvorlige medfødte nervesystemforstyrrelser. På grund af deres amfipatiske natur kræver ekstraktion, oprensning og analyse af gangliosider teknikker, der er blevet optimeret af mange efterforskere i de 80 år siden deres opdagelse. Her beskriver vi metoder på bænkniveau til ekstraktion, oprensning og foreløbige kvalitative og kvantitative analyser af større gangliosider fra væv og celler, der kan gennemføres på få timer. Vi beskriver også metoder til større skala isolering og oprensning af store gangliosidarter fra hjernen. Tilsammen giver disse metoder analytisk og præparativ skalaadgang til denne klasse af bioaktive molekyler.
Introduction
Gangliosider defineres som glycosphingolipider, der bærer en eller flere sialinsyrerester1. De udtrykkes primært på celleoverfladen med deres hydrofobe ceramidlipidmoiety indlejret i plasmamembranens ydre folder og deres hydrofile glycaner, der strækker sig ind i det ekstracellulære rum2. Selvom de er udbredt i hvirveldyrceller og væv, er de særligt rigelige i hvirveldyrshjernen3, hvor de først blev opdaget og navngivet4.
Strukturerne af gangliosidglycaner varierer og er grundlaget for deres nomenklatur (figur 1). Gangliosidglycaner består af en neutral sukkerkerne med forskellige tal og fordelinger af sialinsyrer. Det mindste gangliosid, GM4, har kun to sukkerarter (sialinsyre bundet til galactose)5. Større naturligt forekommende gangliosider kan indeholde langt over et dusin samlede sukkerarter6 eller op til syv sialinsyrer på en enkelt neutral kerne7. Deres ceramid lipid moieties varierer også, har forskellige sphingosin længder og en række fedtsyre amider. I hvirveldyrhjernen dominerer fire gangliosidarter, GM1, GD1a, GD1b og GT1b. Gangliosidekspression er udviklingsreguleret, vævsspecifik og celletypespecifik.
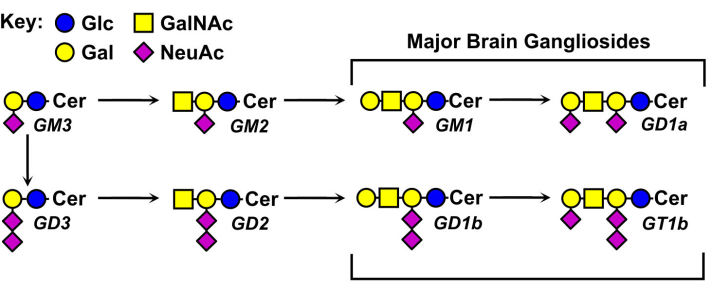
Figur 1: Større hjernegangliosider og deres biosyntetiske forstadier. Strukturer vises ved hjælp af symbolnomenklatur for glykaner11. Klik her for at se en større version af denne figur.
Gangliosider fungerer på molekylært niveau ved at engagere og modulere proteiner i deres egne membraner (cis-regulering) eller ved at engagere glycanbindende proteiner i det ekstracellulære miljø, herunder bakterielle toksiner og lektiner på andre celler (transgenkendelse)3. Specifik binding af gangliosider til regulatoriske proteiner og / eller selvforening med andre molekyler i lipidflåder resulterer i ændringer i celleadfærd, der påvirker nervesystemets struktur og funktion, kræftprogression, metabolisme, inflammation, neuronale proteinopatier og infektionssygdomme8. På grund af deres forskellige cellulære roller kan metoder til deres isolering og analyse give forbedret indsigt i reguleringen af fysiologiske og patologiske processer. Her tilvejebringes validerede metoder til hurtig ekstraktion og analyse i lille skala og præparativ skalaisolering af gangliosider fra hjernen. Muligheder og udfordringer for anvendelse på andre væv diskuteres.
Protocol
Representative Results
Discussion
Metoderne til gangliosidekstraktion og isolering i lille og stor skala, der er rapporteret her, er ikke unikke – der er mange forskellige opløsningsmiddelekstraktions- og oprensningsmetoder, der giver fremragende resultater12. De metoder, der er rapporteret her til rensning i lille skala fra hjernen, fra Fredman og Svennerholm13, viste sig at optimere restitutionen og har vist sig at være robuste og ligetil gennem mange år i vores laboratorium. Isolering og oprensning eg…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Dette arbejde blev støttet af National Institutes of Health (NIH) Common Fund for Glycoscience grant U01CA241953. MJP blev støttet af Chemistry-Biology Interface Program på Johns Hopkins (T32GM080189).
Materials
| Bovine brain, stripped | PelFreez | 57105-1 | |
| Ganglioside standards | Matreya | GM1, 1061; GD1a, 1062; GD1b, 1501; GT1b, 1063 | |
| Glass bottle with PTFE-lined cap | Fisher Scientific | 02-911-739 | |
| Glass centrifuge bottle | Fisher Scientific | 05-586B | |
| Glass culture tubes, 16 x 125 mm | VWR | 60825-430 | for collecting HPLC fractions |
| Glass separatory funnel (2 L) | Pyrex | 6400-2L | |
| Injection syringe – Hamilton 1750 gastight 500 µl | Hamilton | 81265 | |
| p-Anisaldehyde, 98% | Sigma-Aldrich | A88107 | |
| Potter-Elvhjem Homogenizer | Fisher Scientific | 08-414-14A | Choose appropriate volume option |
| Reprosil 100 NH2 10µm 5x4mm guard columns | Analytics-Shop | AAVRS1N-100540-5 | |
| Reprospher 100 NH2, 5 μm, 250 mm x 20 mm HPLC column | Analytics-Shop | custom packed | other sizes available |
| Resorcinol | Sigma-Aldrich | 30752-1 | |
| Rotary evaporator | Buchi | R-300 | |
| Sample loop for Model 7725 Injector (5 ml) | Sigma-Aldrich | 57632 | |
| Sep-Pak tC18 Cartidges Vac 35 cc (10 g) | Waters | WAT043350 | |
| Sep-Pak tC18 Plus Short Cartridge, 400 mg | Waters | WAT036810 | |
| Spotting syringe – Hamilton 701N 10 µl | Hamilton | 80300 | |
| Thick-walled 13-mm diameter test tubes with PFTE lined caps | Fisher Scientific | 14-933A | |
| Threaded 2-ml vials with PFTE lined caps | Fisher Scientific | 14-955-323 | For ganglioside storage |
| TLC plates, HPTLC Silica gel 60 F254 Multiformat | Fisher Scientific | M1056350001 | Fluorescence impregnation (F254) stabilizes the sorbent surface |
| TLC reagent sprayer | Fisher Scientific | 05-723-26A | |
| TLC running chamber for 10 x 10 cm plates | Camag | 22.5155 | |
| Waring 1-Liter Stainless Steal Explosion Resistant Blender | Waring | E8520 |
References
- Schnaar, R. L. The Biology of Gangliosides. Advances in Carbohydrate Chemistry and Biochemistry. 76, 113-148 (2019).
- DeMarco, M. L., Woods, R. J. Atomic-resolution conformational analysis of the GM3 ganglioside in a lipid bilayer and its implications for ganglioside-protein recognition at membrane surfaces. Glycobiology. 19 (4), 344-355 (2009).
- Schnaar, R. L. Gangliosides of the vertebrate nervous system. Journal of Molecular Biology. 428, 3325-3336 (2016).
- Klenk, E. Über die Ganglioside, eine neue Gruppe von zuckerhaltigen Gehirnlipoiden [About gangliosides, a new group of sugar-containing brain lipids]. Hoppe-Seyler’s Zeitschrift für Physiologische Chemie. 273, 76-86 (1942).
- Uemura, S., Go, S., Shishido, F., Inokuchi, J. Expression machinery of GM4: the excess amounts of GM3/GM4S synthase (ST3GAL5) are necessary for GM4 synthesis in mammalian cells. Glycoconjugate Journal. 31 (2), 101-108 (2014).
- Nimrichter, L., et al. E-selectin receptors on human leukocytes. Blood. 112 (9), 3744-3752 (2008).
- Saito, M., Kitamura, H., Sugiyama, K. A novel heptasialosyl c-series ganglioside in embryonic chicken brain: its structure and stage-specific expression. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 1571 (1), 18-26 (2002).
- Todeschini, A. R., Hakomori, S. I. Functional role of glycosphingolipids and gangliosides in control of cell adhesion, motility, and growth, through glycosynaptic microdomains. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 1780 (3), 421-433 (2008).
- Sturgill, E. R., et al. Biosynthesis of the major brain gangliosides GD1a and GT1b. Glycobiology. 22, 1289-1301 (2012).
- Cavdarli, S., Delannoy, P., Groux-Degroote, S. O-Acetylated gangliosides as targets for cancer immunotherapy. Cells. 9 (3), (2020).
- Varki, A., et al. Symbol nomenclature for graphical representations of glycans. Glycobiology. 25 (12), 1323-1324 (2015).
- Schnaar, R. L. Isolation of glycosphingolipids. Methods in Enzymology. 230, 348-370 (1994).
- Svennerholm, L., Fredman, P. A procedure for the quantitative isolation of brain gangliosides. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 617, 97-109 (1980).
- Tettamanti, G., Bonali, F., Marchesini, S., Zambotti, V. A new procedure for the extraction, purification and fractionation of brain gangliosides. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 296, 160-170 (1973).
- Gazzotti, G., Sonnino, S., Ghidoni, R. Normal-phase high-performance liquid chromatographic separation of non-derivatized ganglioside mixtures. Journal of Chromatography. 348, 371-378 (1985).
- Schnaar, R. L., Needham, L. K. Thin-layer chromatography of glycosphingolipids. Methods in Enzymology. 230, 371-389 (1994).
- Ledeen, R. W., Yu, R. K. Gangliosides: structure, isolation, and analysis. Methods in Enzymology. 83, 139-191 (1982).
- Lopez, P. H., et al. Mice lacking sialyltransferase ST3Gal-II develop late-onset obesity and insulin resistance. Glycobiology. 27 (2), 129-139 (2017).

