La respirométrie à haute résolution pour évaluer la bioénergétique dans les cellules et les tissus à l’aide de respiromètres à chambre et à plaques
Summary
L’évaluation de la phosphorylation oxydative à l’aide de respiromètres à haute résolution est devenue une partie intégrante de l’analyse fonctionnelle des mitochondries et du métabolisme énergétique cellulaire. Ici, nous présentons des protocoles pour l’analyse du métabolisme énergétique cellulaire à l’aide de respiromètres haute résolution à chambre et à microplaques et discutons des principaux avantages de chaque appareil.
Abstract
La respirométrie à haute résolution (HRR) permet de surveiller la phosphorylation oxydative en temps réel pour l’analyse des états énergétiques cellulaires individuels et l’évaluation des complexes respiratoires à l’aide de protocoles diversifiés de titrage substrat-découpleur-inhibiteur (SUIT). Ici, l’utilisation de deux appareils de respirométrie à haute résolution est démontrée, et une collection de base de protocoles applicables à l’analyse des cellules cultivées, des fibres musculaires squelettiques et cardiaques et des tissus mous tels que le cerveau et le foie sont présentés. Des protocoles pour les cellules et tissus cultivés sont fournis pour un respiromètre à chambre et des cellules cultivées pour un respiromètre à microplaques, tous deux englobant les protocoles de respiration standard. À des fins de comparaison, des cellules HEK293 conçues par CRISPR et déficientes en traduction mitochondriale provoquant une déficience multiple du système respiratoire sont utilisées avec les deux appareils pour démontrer des défauts cellulaires dans la respiration. Les deux respiromètres permettent une mesure complète de la respiration cellulaire avec leurs mérites techniques respectifs et leur adéquation en fonction de la question de recherche et du modèle à l’étude.
Introduction
Les mitochondries remplissent la fourniture clé d’énergie et sont un organite compartimenté contribuant aux processus bioénergétiques et métaboliques cellulaires essentiels tels que l’anabolisme des nucléotides, des lipides et des acides aminés, la biogenèse des amas fer-soufre et sont impliquées dans la signalisation telle que la mort cellulaire contrôlée 1,2,3 . La bioénergétique mitochondriale par phosphorylation oxydative contribue à presque tous les processus cellulaires au sein de la cellule et, par conséquent, les dysfonctionnements mitochondriaux d’origine primaire ou secondaire sont associés à un large éventail de maladies 4,5. Le dysfonctionnement mitochondrial implique non seulement des altérations de la structure ou de la densité mitochondriale, mais aussi de la qualité et de la régulation du système respiratoire6. Cet élément qualitatif englobe le contrôle du substrat, les caractéristiques de couplage, les modifications post-traductionnelles, la dynamique des cristae et les supercomplexes respiratoires 7,8. Par conséquent, une analyse précise de la bioénergétique mitochondriale pour des approches expérimentales et diagnostiques visant à évaluer le métabolisme énergétique de la cellule est importante pour la santé et la maladie.
La phosphorylation oxydative mitochondriale (OXPHOS) est une séquence de réactions au sein du système respiratoire ou du système de transfert d’électrons (ETS) pour la génération d’énergie cellulaire par l’adénosine triphosphate (ATP)9. L’étape multi-enzymatique visant à exploiter l’énergie du flux d’électrons à travers les complexes I et II vers le complexe IV génère un gradient électrochimique de protons à travers la membrane mitochondriale interne, utilisé par la suite pour la phosphorylation de l’adénosine diphosphate (ADP) en ATP via le complexe V (F1FO ATP synthase) (Figure 1A).
Tout d’abord, des transporteurs à deux électrons sont générés au cours du cycle tricarboxylique (TCA), de la glycolyse et de l’oxydation du pyruvate : nicotinamide adénine dinucléotide (NADH) et dihydroflavine adénine dinucléotide (FADH2). Le NADH est oxydé au niveau du complexe I (NADH déshydrogénase), au cours duquel deux électrons sont transférés à la coenzyme Q (la quinone est réduite en quinol), tandis que les protons sont pompés dans l’espace intermembranaire (IMS). Deuxièmement, le complexe II (Succinate déshydrogénase) oxyde le FADH2 et alimente les électrons en coenzyme Q sans pomper de protons. Troisièmement, au complexe III (cytochrome c oxydoréductase), les électrons de la coenzyme Q sont transférés au cytochrome c tandis que les protons sont pompés dans l’IMS. Quatrièmement, le cytochrome c transfère les électrons au complexe IV (Cytochrome c oxydase), le complexe final pour pomper les protons, et où l’oxygène fonctionne comme un accepteur d’électrons pour assimiler les protons, formant finalement de l’eau. C’est cet oxygène que les mitochondries consomment qui peut être mesuré par un oxygraphe. Enfin, les protons générés à partir des complexes I, III et IV sont utilisés pour faire tourner le complexe V, générant ainsi de l’ATP9.
Il est important de noter que le transfert d’électrons ne se produit pas seulement de manière linéaire, autrement désigné comme la chaîne de transport d’électrons. Au lieu de cela, les électrons peuvent être transférés au pool de coenzyme Q par de multiples voies respiratoires et faciliter le flux d’électrons convergents. Les substrats de NADH et le succinate, par exemple, peuvent entrer par les complexes I et II, respectivement. Les électrons issus de l’oxydation des acides gras peuvent être donnés via le complexe flavoprotéique de transfert d’électrons. En effet, une analyse complète d’OXPHOS nécessite une approche holistique avec des substrats de combustible appropriés (Figure 1A).
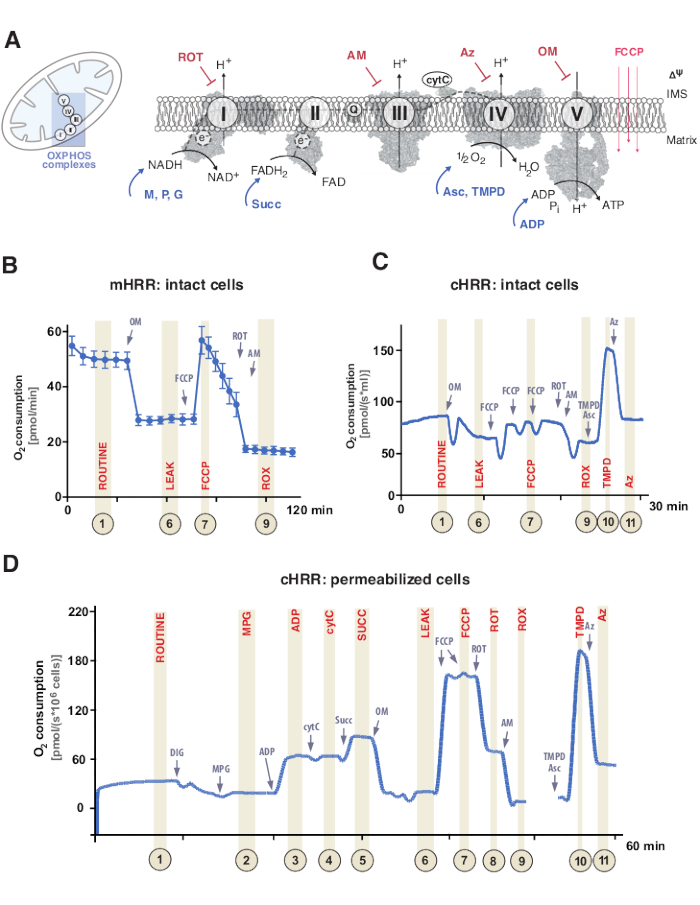
Figure 1 : Phosphorylation oxydative mitochondriale et protocoles spécifiques de substrat et d’inhibiteur. (A) Mitochondrie et schéma du système de transfert d’électrons (CI-CIV) et de la F1F0 ATP synthase mitochondriale (CV). Toutes les structures sont de PDB. Les figures ne représentent que les substrats et les inhibiteurs décrits dans cette étude). (B) Échantillon de trace de flux d’oxygène dans des cellules HEK293 intactes utilisant un protocole standard dans un dispositif mHRR. (C) Échantillon de trace de flux d’oxygène dans des cellules HEK293 intactes utilisant un protocole standard dans un dispositif cHRR. (D) Échantillon de trace de flux d’oxygène dans des fibroblastes humains perméabilisés provenant d’un donneur sain avec le protocole SUIT respectif. Abréviations : 1 = Respiration de routine des cellules intactes; 2 = État 2; 3 = État 3(I); 4 = État 3(I) avec cytC; 5 = État 3 (I+II); 6 = Fuite (OM); 7 = capacité du SEQE; 8 = S(ROT); 9 = ROX; 10 = TMPD; 11 = Az. ROT = Roténone, AM = Antimycine, ATP = Adénosine triphosphate, Az = Azide, OM = Oligomycine, FCCP = Cyanure de carbonyle p-trifluoro-méthoxyphényl-hydrazone; Asc = Ascorbate, TMPD = N,N,N′,N′-tétraméthyl-p-phénylènediamine, Succ = Succinate, M = Malate, P = Pyruvate, ADP = Adénosine diphosphate, NAD = Nicotinamide adénine dinucléotide, IMS = Espace intermembranaire, FAD = Flavine adénine dinucléotide. Veuillez cliquer ici pour voir une version agrandie de cette figure.
L’analyse de la capacité OXPHOS mitochondriale à l’aide de HRR est devenue une méthode biochimique instrumentale de valeur diagnostique non seulement pour les défauts mitochondriaux primaires10,11, mais s’étendant à tous les autres domaines de la biologie tels que le cancer et le vieillissement12. HRR permet la détermination de la respiration cellulaire par l’analyse de la capacité mitochondriale OXPHOS, qui reflète directement une déficience individuelle ou combinée du complexe respiratoire mitochondrial, et est indirectement associée à un dysfonctionnement cellulaire et à une altération du métabolisme énergétique9. Sur le plan méthodologique, les mesures de la respiration sont effectuées à l’aide de cellules, detissus ou de mitochondries isolées 11,13,14, le matériel congelé ne convenant que partiellement15,16. Il est démontré que les tissus congelés ont un ETS intact avec une stabilité supercomplexe maintenue15. Ainsi, contrairement aux intermédiaires TCA traditionnels, les substrats respectifs sont directement introduits dans l’ETS. Cependant, le couplage entre la synthèse de l’ETS et de l’ATP est perdu car l’intégrité de la membrane est compromise par les dommages causés par le gel (formation de cristaux de glace).
Les expériences de respiration ont normalement lieu à une température physiologique de 37 °C pour les endothermes dans des cellules ou des tissus non perméabilisés ou perméabilisés. Alors que le premier considère le contexte métabolique cytosolique, le second fournit la contribution énergétique des complexes OXPHOS individuels et de l’ATPase par l’ajout de substrats spécifiques (et d’inhibiteurs). La séquence et la variation des substrats et des inhibiteurs ont conduit au développement d’un large éventail de protocoles SUIT17 etde tests 18 pour répondre à diverses questions scientifiques de la fonction OXPHOS (examinés sous12). Le protocole de base de la respiration cellulaire évalue quatre états différents: i) la respiration de routine – la respiration dans un milieu respiratoire respectif sans aucun ajout de substrats ou d’inhibiteurs consommant mais endogènes. Cet état peut révéler des OXPHOS généraux ou des défauts respiratoires induits secondaires causés, par exemple, par des profils de métabolites modifiés. Ensuite, l’ajout de l’inhibiteur de l’ATPase oligomycine révèle la perméabilité de la membrane mitochondriale interne aux protons, définie comme ii) la respiration des fuites. Le titrage ultérieur d’un protonophore tel que le décupleur cyanure de carbonyle p-trifluoro-méthoxyphényl-hydrazone (FCCP) permet de déterminer l’état auquel la capacité ETS est maximale dans un mode de circuit proton transmembranaire ouvert, défini comme iii) respiration non couplée. Il est important de noter qu’un état non couplé peut également se produire par des interventions expérimentales par des dommages mécaniques excessifs aux membranes mitochondriales. Inversement, l’état non couplé fait référence au découplage respiratoire par un mécanisme intrinsèque qui est physiologiquement contrôlé. Enfin, l’inhibition complète de l’ETS par addition de l’inhibiteur du complexe III antimycine et de l’inhibiteur du complexe I roténone détermine la consommation résiduelle d’oxygène (ROX) des processus non mitochondriaux consommant de l’oxygène (Figure 1A-C).
La bioénergétique mitochondriale se compose de cinq états respiratoires distincts19,20. La respiration de l’état 1 est sans substrats supplémentaires ni ADP, à l’exception de ce qui est disponible de manière endogène. Après l’ajout d’ADP, mais toujours, pas de substrats, la respiration de l’état 2 est atteinte. Lorsque des substrats sont ajoutés, permettant le transfert d’électrons et la synthèse de l’ATP, la respiration de l’état 3 est atteinte. Dans cet état, la capacité OXPHOS peut être définie à des concentrations saturantes d’ADP, de phosphate inorganique, d’oxygène, de substrats liés au NADH et au succinate. La respiration d’état 4 ou respiration LEAK peut être définie comme un état sans ADP ou ATP synthases inhibées chimiquement tout en ayant suffisamment de substrats. Enfin, lorsque tout l’oxygène est épuisé (anoxique) dans un cadre à chambre fermée, la respiration de l’état 5 est observée.
Plusieurs méthodes existent pour évaluer les états d’énergie cellulaire14 avec deux dispositifs dominant l’évaluation actuelle en temps réel d’OXPHOS par l’analyse de la consommation d’oxygène, mesurée comme la fonction de la diminution de l’oxygène au fil du temps dans un système à chambre fermée avec une applicabilité différente en fonction du modèle expérimental et de la question de recherche: le respiromètre haute résolution Oroboros 2k et l’analyseur de flux extracellulaire Seahorse XF. Les deux appareils enregistrent les taux de consommation d’oxygène sous forme de diminution des picomoles (pmol) d’oxygène (O2) par seconde en tant que valeur absolue dans la chambre ou le puits de microplaque. La consommation spécifique d’oxygène par masse est obtenue en normalisant la consommation d’oxygène respective dans une recette tampon spécifique par nombre de cellules (millions), poids tissulaire (mg) ou quantité de protéines.
L’O2k (Oroboros Instruments) est un système fermé à deux chambres équipé d’un capteur d’oxygène polarographique (abrégé en respiromètre haute résolution à chambre: cHRR). Chaque chambre expérimentale contient 2 mL de liquide qui est maintenu homogène par des agitateurs magnétiques. Le capteur d’oxygène polarographique utilise une approche ampérométrique pour mesurer l’oxygène: il contient une cathode d’or, une anode argent/chlorure d’argent et entre les deux une solution KCI créant une cellule électrochimique sur laquelle une tension (0,8 V) est appliquée. L’oxygène du milieu d’essai diffuse à travers une membrane d’éthylène propylène fluoré de 25 μm (perméable àL’O2) et subit une réduction à la cathode, produisant du peroxyde d’hydrogène. À l’anode, l’argent est oxydé par le peroxyde d’hydrogène, générant un courant électrique. Ce courant électrique (ampère) est linéairement lié à la pression partielle d’oxygène. La pression partielle de l’oxygène et le facteur de solubilité en oxygène du milieu d’essai sont utilisés pour calculer la concentration en oxygène. Étant donné que la pression partielle d’oxygène dépend de la température expérimentale et que les mesures polarographiques sont sensibles à la température, les fluctuations de température nécessitent une régulation précise (±0,002 °C) par un bloc chauffant Peltier. La température peut être contrôlée dans une plage de 4 °C et 47 °C.
L’analyseur de flux extracellulaire Seahorse XF (Agilent) est un système à base de plaques au format microplaque à 24 ou 96 puits dans lequel trois électrodes de fluorescence mesurent la consommation d’oxygène au fil du temps dans chaque puits (abrégé en respiromètre haute résolution à base de microplaques: mHRR). Un maximum de quatre ports dans la cartouche de dosage sont disponibles pour l’injection automatisée pendant le test. Un essai contient plusieurs cycles, chacun avec trois phases: 1) mélange, 2) attente et 3) mesure. Pendant la phase de mesure, les sondes de capteur sont abaissées dans la microplaque, créant une chambre temporairement fermée contenant un volume de 7 à 10 μL pour mesurer la lumière émise. Cette lumière est émise par des fluorophores incorporés dans des polymères à l’extrémité des sondes du capteur, qui détectentO2 en fonction de la trempe par phosphorescence. L’intensité du signal de fluorescence est proportionnelle àO2 et influencée par la température du capteur et du milieu d’essai. Par conséquent, une estimation précise de l’oxygène nécessite une approche relative avec un puits de fond sans aucun échantillon. La restauration de la concentration en oxygène se produit pendant la phase de mélange lorsque le capteur se déplace de haut en bas pour mélanger le volume au-dessus de la chambre temporaire. Chaque cycle calcule un taux de consommation d’oxygène. La température peut être contrôlée dans une plage de 16 °C et 42 °C.
HRR est l’étalon-or pour évaluer la bioénergétique cellulaire dans les maladies primaires et associées aux mitochondries et le métabolisme cellulaire général. Dans cette étude, des protocoles de base pour hrr sont fournis pour évaluer la fonction OXPHOS dans les cellules et les tissus.
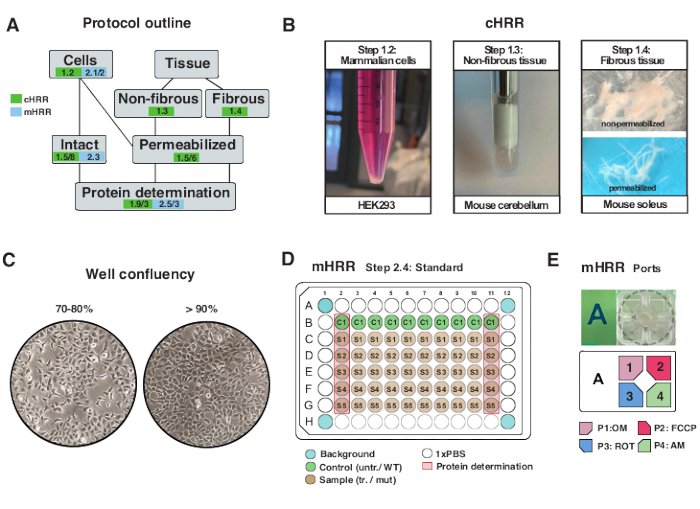
Figure 2 : Flux de travail pour les préparations cellulaires et tissulaires pour la RDH et préparation cellulaire pour la respirométrie mHRR. (A) Aperçu des protocoles fournis. (B) Cellules de mammifères (étape 1.2) : pastille HEK293 égale à 3 x 106 cellules (panneau de gauche). Tissu non fibreux (étape 1.3) : Préparation du lysat de cervelet murin dans 2 mL de potier en téflon (panneau central). Perméabilisation musculaire squelettique induite par la saponine (étape 1.4) panneau de droite) pour la respirométrie cHRR. (C) Schéma standard d’ensemencement des microplaques (étape 2.4) et contrôle de la confluence pour l’analyse des cellules eucaryotes (HEK293) pour la respirométrie mHRR. (D, E) Schéma de chargement de l’orifice d’injection pour la respirométrie mHRR (étape 2.4). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocol
Representative Results
Discussion
Traditionnellement, la bioénergétique mitochondriale a été étudiée avec des électrodes d’oxygène de type Clark. Un manque de résolution et de débit, cependant, justifiait le progrès technologique. À ce jour, l’O2k (appelé cHRR) et l’analyseur de flux Seahorse XF96 (appelé mHRR) ont été largement adoptés dans le domaine de la bioénergétique cellulaire. Ici, nous présentons une collection compréhensible de protocoles pour l’analyse du métabolisme énergétique cellulaire via l’évaluation de…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Ce travail a été soutenu par un financement de l’Académie de Finlande (C.B.J), de la Fondation Magnus Ehrnroot (C.B.J) et d’une bourse de doctorat de l’Integrated Life Sciences Graduate School (R.A.).
Materials
| 2 mL Potter-Elvehjem Glass/PTFE Tissue Grinder/Homogenizer | Omni International | 07-358029 | |
| 95% O2, 5% CO2 medical gas mixture | Potter for tissue grinding | ||
| ADP | Sigma | A 4386 | |
| Antimycin A | Sigma | A 8674 | Chemical |
| Ascorbate | Merck | PHR1279-1G | Chemical, dissolve in ethanol |
| BSA (fatty accid free) | Sigma | A 6003 | Chemical |
| CaCO3 | Sigma | C 4830 | Chemical |
| Cytochrome c | Sigma | C 7752 | Chemical |
| Digitonin | Sigma | D 5628 | Chemical |
| Dithiothreitol | Sigma | D 0632 | Chemical, dissolve in DMSO |
| D-Sucrose | Roth | 4621.1 | Chemical |
| Dulbecco’s modified Eagle’s medium (High glucose) | Fisher Scientific | 41965-039 | Chemical |
| Dulbecco’s modified Eagle’s medium (No Glucose) | Fisher Scientific | A14430-01 | |
| EGTA | Sigma | E 4378 | |
| Etomoxir | Sigma | E1905 | Chemical |
| Falcon 15 ml Conical Centrifuge Tubes | Fisher Scientific | AM12500 | Chemical |
| Falcon 50 ml Conical Centrifuge Tubes | Fisher Scientific | AM12501 | |
| FCCP | Sigma | C 2920 | |
| Glucose | Sigma | G7021 | Chemical, dissolve in ethanol |
| Glutamate | Sigma | G 1626 | Chemical |
| GlutaMax (100x) (200 nM L-alanyl-L-glutamine dipeptide) | Fisher Scientific | 35050061 | Chemical |
| HEK293 cells | ATTC | CRL-1573 | |
| Hemocytometer | Fisher Scientific | 0267151B | Instrument for cell counting |
| Hepes | Sigma | H 7523 | Chemical |
| Imidazole | Fluka | 56750 | Chemical |
| KCl | Merck | 1.04936 | Chemical |
| L-carnitine | Sigma | C0283 | Chemical |
| Malate | Sigma | M 1000 | Chemical |
| MES hydrate | Sigma | M8250 | Chemical |
| MgCl2 | Sigma | M 9272 | Chemical |
| Na2ATP | Sigma | A 2383 | Chemical |
| Na2Phosphocreatine | Sigma | P 7936 | Chemical |
| Na-pyruvate (100 mM) (100x) | Fisher Scientific | 11360070 | |
| NEAA (Non-essential amino acids) 100x | Fisher Scientific | 11140035 | |
| Normal FBS (10x) | Fisher Scientific | 10500064 | |
| O2k-Core: Oxygraph-2k | Oroboros Instruments | 10000-02 | High-resolution respirometry instrument |
| O2k-Titration Set | Oroboros Instruments | 20820-03 | Hamilton syringes for chemical injections |
| Oligomycin | Sigma | O 4876 | Chemical, dissolve in ethanol |
| Palmitoylcarnitine | Sigma | P 4509 | Chemical |
| Penicillin-Streptomycin | Fisher Scientific | 15140122 | |
| Pierce BCA Protein Assay Kit | Fisher Scientific | 23227 | |
| Pyruvate | Sigma | P 2256 | Chemical |
| RIPA-Buffer | Fisher Scientific | 89900 | Chemical |
| Rotenone | Sigma | R 8875 | Chemical, dissolve in ethanol |
| Saponin | Sigma | S7900 | Chemical |
Seahorse XF DMEM assay medium pack, pH 7.4 |
Agilent, Santa Clara, CA |
103680-100 | |
| Seahorse XFe96 Extracellular Flux Analyzer | Agilent, Santa Clara, CA |
High-throughput respirometry instrument | |
| Seahorse XFe96 FluxPak | Agilent, Santa Clara, CA |
Includes assay plates, cartridges, loading guides for transferring compounds to the assay cartridge, and calibrant solution. |
|
| Small scissors | Fisher Scientific | 08-951-20 | |
| Sodium azide | Sigma | S2002 | Chemical |
| Succinate | Sigma | S 2378 | Chemical |
| Taurine | Sigma | T 8691 | Chemical |
| TMPD | Sigma | T 3134 | Chemical |
| Trypan Blue solution | Merck | 72-57-1 | Chemical |
| Trypsin 0.25% EDTA | Fisher Scientific | 25200056 | |
| Two thin-edged forceps | Fisher Scientific | 12-000-122 | |
| Uridine stock (500x) | Sigma | U3750 | Chemical |
References
- McBride, H. M., Neuspiel, M., Wasiak, S. Mitochondria: More than just a powerhouse. Current Biology. 16 (14), 551-560 (2006).
- Mehta, M. M., Weinberg, S. E., Chandel, N. S. Mitochondrial control of immunity. Beyond ATP. Nature Reviews Immunology. 17 (10), 608-620 (2017).
- Spinelli, J. B., Haigis, M. C. The multifaceted contributions of mitochondria to cellular metabolism. Nature Cell Biology. 20 (7), 745-754 (2018).
- Gnaiger, E. Capacity of oxidative phosphorylation in human skeletal muscle. New perspectives of mitochondrial physiology. International Journal of Biochemistry and Cell Biology. 41 (10), 1837-1845 (2009).
- Gorman, G. S., et al. Mitochondrial diseases. Nature Reviews Disease Primers. 2, 1-23 (2016).
- Boushel, R., Gnaiger, E., Schjerling, P., Skovbro, M., Kraunsøe, R., Dela, F. Patients with type 2 diabetes have normal mitochondrial function in skeletal muscle. Diabetologia. 50 (4), 790-796 (2007).
- Cogliati, S., et al. Mitochondrial cristae shape determines respiratory chain supercomplexes assembly and respiratory efficiency. Cell. 155 (1), 160-171 (2013).
- Kühlbrandt, W. Structure and function of mitochondrial membrane protein complexes. BMC Biology. 13, 1-11 (2015).
- Gnaiger, E. Mitochondrial pathways and Respiratory control. An introduction to OXPHOS analysis. Bioenergetics communications. 5th ed. , (2020).
- Jackson, C. B., et al. Mutations in SDHD lead to autosomal recessive encephalomyopathy and isolated mitochondrial complex II deficiency. Journal of Medical Genetics. 51 (3), 170-175 (2014).
- Pesta, D., Gnaiger, E. High-resolution respirometry: OXPHOS protocols for human cells and permeabilized fibers from small biopsies of human muscle. Methods in Molecular Biology. 810, 25-58 (2012).
- Horan, M. P., Pichaud, N., Ballard, J. W. O. Review: Quantifying mitochondrial dysfunction in complex diseases of aging. Journals of Gerontology – Series A Biological Sciences and Medical Sciences. 67 (10), 1022-1035 (2012).
- Doerrier, C., Garcia-Souza, L. F., Krumschnabel, G., Wohlfarter, Y., Mészáros, A. T., Gnaiger, E. High-resolution fluorespirometry and oxphos protocols for human cells, permeabilized fibers from small biopsies of muscle, and isolated mitochondria. Methods in Molecular Biology. 1782, 31-70 (2018).
- Zhang, J., et al. Measuring energy metabolism in cultured cells, including human pluripotent stem cells and differentiated cells. Nature Protocols. 7 (6), 1068-1085 (2012).
- García-Roche, M., Casal, A., Carriquiry, M., Radi, R., Quijano, C., Cassina, A. Respiratory analysis of coupled mitochondria in cryopreserved liver biopsies. Redox Biology. 17, 207-212 (2018).
- Acin-Perez, R., et al. A novel approach to measure mitochondrial respiration in frozen biological samples. The EMBO Journal. 39 (13), 1-18 (2020).
- Cell metabolism assay kits. Seahorse assay kits and media Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-lits-reagents-cell-assay-media (2021)
- Chance, B., Williams, G. R. A method for the localization of sites for oxidative phosphorylation. Nature. 176 (4475), 250-254 (1955).
- Gnaiger, E., et al. Mitochondrial respiratory states and rates. MitoFit Preprint Arch. , (2019).
- Gnaiger, E. O2k-procedures: SOP O2k quality control 1: Polarographic oxygen sensors and accuracy of calibration Section Page. Oroboros. 03 (18), 1-21 (2020).
- Robinson, B. H., Petrova-Benedict, R., Buncic, J. R., Wallace, D. C. Nonviability of cells with oxidative defects in galactose medium: A screening test for affected patient fibroblasts. Biochemical Medicine and Metabolic Biology. 48 (2), 122-126 (1992).
- King, M. P., Attardi, G. Human cells lacking mtDNA: Repopulation with exogenous mitochondria by complementation. Science. 246 (4929), 500-503 (1989).
- Makrecka-Kuka, M., Krumschnabel, G., Gnaiger, E. High-resolution respirometry for simultaneous measurement of oxygen and hydrogen peroxide fluxes in permeabilized cells, tissue homogenate and isolated mitochondria. Biomolecules. 5 (3), 1319-1338 (2015).
- Fasching, M., Gnaiger, E. O2k quality control 2: Instrumental oxygen background correction and accuracy of oxygen flux. Mitochondrial Physiology Network. 14 (06), 1-14 (2016).
- Gnaiger, E., Lassnig, B., Kuznetsov, A., Rieger, G., Margreiter, R. Excess capacity of cytochrome c oxidase. Journal of Experimental Biology. 1139, 1129-1139 (1998).
- Gnaiger, E., et al. Mitochondria in the Cold. Life in the Cold. , 431-442 (2000).
- Fontana-Ayoub, M., Fasching, E., Gnaiger, Selected media and chemicals for respirometry with mitochondrial preparations. Mitochondrial Physiology Network. 02 (17), 1-9 (2014).
- Gerencser, A. A., et al. Quantitative microplate-based respirometry with correction for oxygen diffusion. Analytical Chemistry. 81 (16), 6868-6878 (2009).
- Krumschnabel, G., Eigentler, A., Fasching, M., Gnaiger, E. Use of safranin for the assessment of mitochondrial membrane potential by high-resolution respirometry and fluorometry. Methods in Enzymology. 542, 163-181 (2014).
- Nászai, A., Terhes, E., Kaszaki, J., Boros, M., Juhász, L. Ca(2+)N it be measured? Detection of extramitochondrial calcium movement with high-resolution fluorespirometry. Scientific Reports. 9 (1), 1-13 (2019).
- Pajak, B., et al. 2-Deoxy-d-Glucose and its analogs: From diagnostic to therapeutic agents. International Journal of Molecular Sciences. 21 (1), 234 (2019).
- Mercier-Letondal, P., Marton, C., Godet, Y., Galaine, J. Validation of a method evaluating T cell metabolic potential in compliance with ICH Q2 (R1). Journal of Translational Medicine. 19 (1), 1-15 (2021).
- Sauerbeck, A., et al. Analysis of regional brain mitochondrial bioenergetics and susceptibility to mitochondrial inhibition utilizing a microplate based system. Journal of Neuroscience Methods. 198 (1), 36-43 (2011).
- Jackman, M. R., Willis, W. T. Characteristics of mitochondria isolated from type I and type IIb skeletal muscle. American Journal of Physiology – Cell Physiology. 270 (2), 673-678 (1996).
- Ponsot, E., et al. Mitochondrial tissue specificity of substrates utilization in rat cardiac and skeletal muscles. Journal of Cellular Physiology. 203 (3), 479-486 (2005).
- Schönfeld, P., Reiser, G. Why does brain metabolism not favor burning of fatty acids to provide energy-Reflections on disadvantages of the use of free fatty acids as fuel for brain. Journal of Cerebral Blood Flow and Metabolism. 33 (10), 1493-1499 (2013).
- Calderon-Dominguez, M., Mir, J. F., Fucho, R., Weber, M., Serra, D., Herrero, L. Fatty acid metabolism and the basis of brown adipose tissue function. Adipocyte. 5 (2), 98-118 (2016).
- Divakaruni, A. S., Rogers, G. W., Murphy, A. N. Measuring mitochondrial function in permeabilized cells using the seahorse XF analyzer or a clark-type oxygen electrode. Current Protocols in Toxicology. 2014, 1-16 (2014).
- Iuso, A., Repp, B., Biagosch, C., Terrile, C., Prokisch, H. Assessing mitochondrial bioenergetics in isolated mitochondria from various mouse tissues using Seahorse XF96 analyzer. Methods in Molecular Biology. 1567, 217-230 (2017).
- Rogers, G. W., et al. High throughput microplate respiratory measurements using minimal quantities of isolated mitochondria. PLoS ONE. 6 (7), 21746 (2011).
- Jordá, A., Zaragozá, R., Portolés, M., Báguena-Cervellera, R., Renau-Piqueras, J. Long-term high-protein diet induces biochemical and ultrastructural changes in rat liver mitochondria. Archives of Biochemistry and Biophysics. 265 (2), 241-248 (1988).
- Jackson, C. B., Gallati, S., Schaller, A. QPCR-based mitochondrial DNA quantification: Influence of template DNA fragmentation on accuracy. Biochemical and Biophysical Research Communications. 423 (3), 441-447 (2012).
- Hirsch, H. M. Tissue autoxidation inhibitors: II. The presence of inhibitor in intact cells; Assay of liver and hepatoma effect on radio-oxidations. Recherche en cancérologie. 16 (11), 1076-1082 (1956).
- Picard, M., et al. Mitochondrial structure and function are disrupted by standard Isolation methods. PLoS ONE. 6 (3), 18317 (2011).
- Tanumihardja, E., Slaats, R. H., Van Der Meer, A. D., Passier, R., Olthuis, W., Van Den Berg, A. Measuring both pH and O2 with a single On-Chip sensor in cultures of human pluripotent stem cell-derived cardiomyocytes to track induced changes in cellular metabolism. ACS Sensors. 6 (1), 267-274 (2021).
- Harms, F., Stolker, R. J., Mik, E. Cutaneous respirometry as novel technique to monitor mitochondrial function: A feasibility study in healthy volunteers. PLoS ONE. 11 (7), 159544 (2016).
- Levitsky, Y., et al. Micro-respirometry of whole cells and isolated mitochondria. RSC Advances. 9 (57), 33257-33267 (2019).

