Respirometría de alta resolución para evaluar la bioenergética en células y tejidos utilizando respirómetros basados en cámaras y placas
Summary
La evaluación de la fosforilación oxidativa utilizando respirómetros de alta resolución se ha convertido en una parte integral del análisis funcional de las mitocondrias y el metabolismo energético celular. Aquí, presentamos protocolos para el análisis del metabolismo energético celular utilizando respirómetros de alta resolución basados en cámaras y microplacas y discutimos los beneficios clave de cada dispositivo.
Abstract
La respirometría de alta resolución (HRR) permite monitorear la fosforilación oxidativa en tiempo real para el análisis de estados de energía celular individuales y la evaluación de complejos respiratorios utilizando protocolos diversificados de titulación de sustrato-desacoplador-inhibidor (SUIT). Aquí, se demuestra el uso de dos dispositivos de respirometría de alta resolución, y se presenta una colección básica de protocolos aplicables para el análisis de células cultivadas, fibras esqueléticas y del músculo cardíaco, y tejidos blandos como el cerebro y el hígado. Se proporcionan protocolos para células y tejidos cultivados para un respirómetro basado en cámara y células cultivadas para un respirómetro basado en microplacas, ambos que abarcan protocolos de respiración estándar. Para fines comparativos, las células HEK293 diseñadas por CRISPR deficientes en la traducción mitocondrial que causan deficiencia múltiple del sistema respiratorio se utilizan con ambos dispositivos para demostrar defectos celulares en la respiración. Ambos respirómetros permiten una medición integral de la respiración celular con sus respectivos méritos técnicos e idoneidad dependiendo de la pregunta de investigación y el modelo en estudio.
Introduction
Las mitocondrias cumplen con la provisión clave de energía y son un orgánulo compartimentado que contribuye a procesos bioenergéticos y metabólicos celulares esenciales como el anabolismo de nucleótidos, lípidos y aminoácidos, la biogénesis del grupo hierro-azufre y están implicadas en la señalización como la muerte celular controlada 1,2,3 . La bioenergética mitocondrial a través de la fosforilación oxidativa contribuye a casi todos los procesos celulares dentro de la célula, y en consecuencia, las disfunciones mitocondriales de origen primario o secundario se asocian con un amplio espectro de condiciones de enfermedad 4,5. La disfunción mitocondrial no sólo implica alteraciones en la estructura o densidad mitocondrial sino también en la calidad y regulación del sistema respiratorio6. Este elemento cualitativo abarca el control del sustrato, las características de acoplamiento, las modificaciones post-traduccionales, la dinámica cristae y los supercomplejos respiratorios 7,8. Por lo tanto, el análisis preciso de la bioenergética mitocondrial para enfoques experimentales y diagnósticos para evaluar el metabolismo energético de la célula es importante en la salud y la enfermedad.
La fosforilación oxidativa mitocondrial (OXPHOS) es una secuencia de reacciones dentro del sistema respiratorio o sistema de transferencia de electrones (ETS) para la generación de energía celular a través del trifosfato de adenosina (ATP)9. El paso multienzimático para aprovechar la energía del flujo de electrones a través de los complejos I y II al complejo IV genera un gradiente electroquímico de protones a través de la membrana mitocondrial interna, posteriormente utilizado para la fosforilación de adenosina difosfato (ADP) a ATP a través del complejo V (F1FO ATP sintasa) (Figura 1A).
En primer lugar, se generan portadores de dos electrones durante el ciclo tricarboxílico (TCA), la glucólisis y la oxidación de piruvatos: nicotinamida adenina dinucleótido (NADH) y dihidroflavina adenina dinucleótido (FADH2). El NADH se oxida en el complejo I (NADH deshidrogenasa), durante el cual dos electrones se transfieren a la coenzima Q (la quinona se reduce a quinol), mientras que los protones se bombean al espacio intermembrana (IMS). En segundo lugar, el complejo II (succinato deshidrogenasa) oxida FADH2 y alimenta los electrones a la coenzima Q sin bombear protones. En tercer lugar, en el complejo III (citocromo c oxidorreductasa), los electrones de la coenzima Q se transfieren al citocromo c, mientras que los protones se bombean al IMS. Cuarto, el citocromo c transfiere los electrones al complejo IV (citocromo c oxidasa), el complejo final para bombear protones, y donde el oxígeno funciona como un aceptor de electrones para asimilar protones, formando finalmente agua. Es este oxígeno el que consumen las mitocondrias el que se puede medir mediante un oxígrafo. Finalmente, los protones generados a partir de los complejos I, III y IV se utilizan para rotar el complejo V, generando así ATP9.
Es importante destacar que la transferencia de electrones ocurre no solo de manera lineal, también denotada como la cadena de transporte de electrones. En cambio, los electrones se pueden transferir al grupo de coenzima Q a través de múltiples vías respiratorias y facilitar el flujo convergente de electrones. Los sustratos de NADH y succinato, por ejemplo, pueden entrar a través del complejo I y el complejo II, respectivamente. Los electrones de la oxidación de ácidos grasos se pueden donar a través del complejo de flavoproteína de transferencia de electrones. De hecho, un análisis exhaustivo de OXPHOS requiere un enfoque holístico con sustratos de combustible apropiados (Figura 1A).
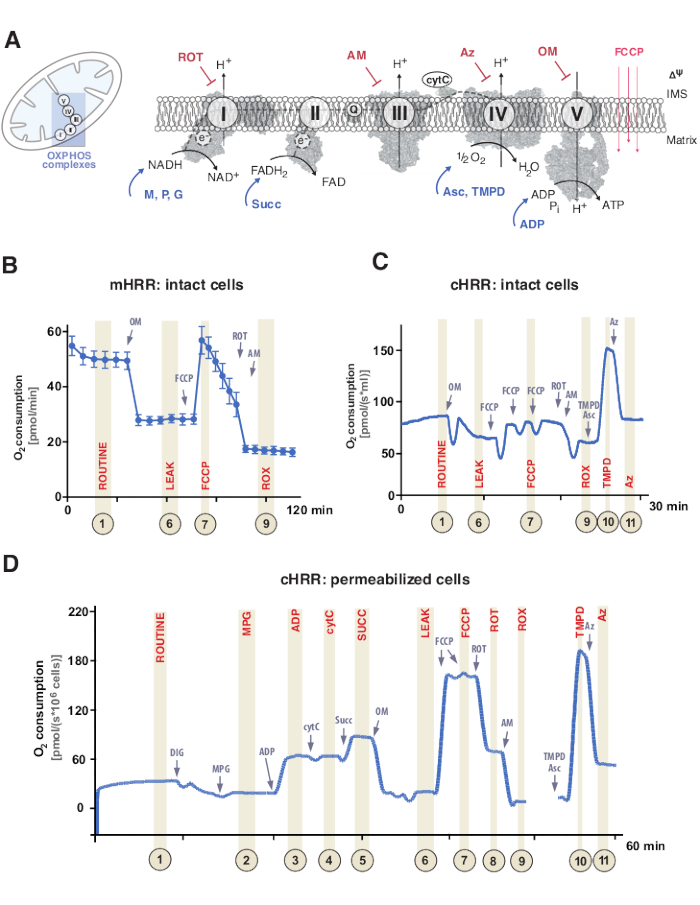
Figura 1: Fosforilación oxidativa mitocondrial y sustrato específico y protocolos inhibidores. (A) Mitocondria y esquema del sistema de transferencia de electrones (CI-CIV) y mitocondrial F1F0 ATP sintasa (CV). Todas las estructuras son de PDB. Las figuras solo representan sustratos e inhibidores descritos en este estudio). (B) Traza de muestra de flujo de oxígeno en células HEK293 intactas utilizando el protocolo estándar en un dispositivo mHRR. (C) Traza de muestra de flujo de oxígeno en células HEK293 intactas utilizando el protocolo estándar en un dispositivo cHRR. (D) Muestra de rastro de flujo de oxígeno en fibroblastos humanos permeabilizados de un donante sano con el protocolo SUIT respectivo. Abreviaturas: 1 = Respiración rutinaria de células intactas; 2 = Estado 2; 3 = Estado 3(I); 4 = Estado 3(I) con cytC; 5 = Estado 3 (I+II); 6 = Fuga (OM); 7 = capacidad del RCDE; 8 = S(ROT); 9 = ROX; 10 = TMPD; 11 = Az. ROT = Rotenona, AM = Antimicina, ATP = Trifosfato de adenosina, Az = Azida, OM = Oligomicina, FCCP = Cianuro de carbonilo p-trifluoro-metoxifenil-hidrazona; Asc = Ascorbato, TMPD = N,N,N′,N′-tetrametil-p-fenilendiamina, Succ = Succinato, M = Malato, P = Piruvato, ADP = Adenosina difosfato, NAD = Nicotinamida adenina dinucleótido, IMS = Espacio intermembrana, FAD = Flavina adenina dinucleótido. Haga clic aquí para ver una versión más grande de esta figura.
El análisis de la capacidad mitocondrial de OXPHOS utilizando HRR se ha convertido en un método bioquímico instrumental de valor diagnóstico no solo para defectos mitocondriales primarios10,11, sino que se extiende a todos los demás ámbitos de la biología, como el cáncer y el envejecimiento12. La HRR permite la determinación de la respiración celular mediante el análisis de la capacidad mitocondrial de OXPHOS, que refleja directamente la deficiencia del complejo respiratorio mitocondrial individual o combinada, e indirectamente se asocia con disfunción celular y metabolismo energético alterado9. Metodológicamente, las mediciones de la respiración se realizan utilizando células, tejidos o mitocondrias aisladas 11,13,14, con material congelado solo parcialmente adecuado15,16. Se ha demostrado que el tejido congelado tiene un ETS intacto con una estabilidad supercompleja mantenida15. Por lo tanto, a diferencia de los intermedios tradicionales de TCA, los sustratos respectivos se introducen directamente en el ETS. Sin embargo, el acoplamiento entre el ETS y la síntesis de ATP se pierde a medida que la integridad de la membrana se ve comprometida por el daño por congelación (formación de cristales de hielo).
Los experimentos de respiración normalmente tienen lugar a una temperatura fisiológica de 37 °C para endotermas en células o tejidos no permeabilizados o permeabilizados. Mientras que el primero considera el contexto metabólico citosólico, el segundo proporciona la contribución energética de los complejos OXPHOS individuales y la ATPasa a través de la adición de sustratos específicos (e inhibidores). La secuencia y la variación de sustratos e inhibidores han llevado al desarrollo de una amplia gama de protocolos SUIT17 y ensayos18 para abordar diversas cuestiones científicas de la función oxphos (revisados bajo12). El protocolo básico de la respiración celular evalúa cuatro estados diferentes: i) respiración de rutina: la respiración en un medio respiratorio respectivo sin ninguna adición de sustratos o inhibidores que consuman sino sustratos endógenos. Este estado puede revelar OXPHOS general o defectos respiratorios inducidos secundariamente causados, por ejemplo, por perfiles de metabolitos alterados. A continuación, la adición del inhibidor de la ATPasa oligomicina revela la permeabilidad de la membrana mitocondrial interna a los protones, definida como ii) respiración por fuga. La titulación posterior de un protonóforo como el cianuro de carbonilo no acoplado p-trifluoro-metoxifenil-hidrazona (FCCP) permite determinar el estado en el que la capacidad de ETS es máxima en un modo de circuito de protones transmembrana abierta, definido como iii) respiración desacoplada. Es importante destacar que un estado desacoplado también puede ocurrir por intervenciones experimentales a través de un daño mecánico excesivo a las membranas mitocondriales. Por el contrario, el estado no acoplado se refiere al desacoplamiento respiratorio por un mecanismo intrínseco que está fisiológicamente controlado. Finalmente, la inhibición completa del ETS mediante la adición del inhibidor del complejo III antimicina y el inhibidor del complejo I rotenona determina el consumo residual de oxígeno (ROX) de procesos no mitocondriales que consumen oxígeno (Figura 1A-C).
La bioenergética mitocondrial consta de cinco estados respiratorios distintos19,20. La respiración de estado 1 es sin sustratos adicionales o ADP, excepto por lo que está disponible endógenamente. Después de la adición de ADP, pero aún así, sin sustratos, se logra la respiración del estado 2. Cuando se agregan sustratos, lo que permite la transferencia de electrones y la síntesis de ATP, se alcanza la respiración del estado 3. En este estado, la capacidad de OXPHOS se puede definir a concentraciones saturadoras de ADP, fosfato inorgánico, oxígeno, sustratos ligados a NADH y succinato. La respiración de estado 4 o respiración LEAK se puede definir como un estado sin ADP o ATP sintasas inhibidas químicamente mientras que tiene sustratos suficientes. Por último, cuando todo el oxígeno se agota (anóxico) en un entorno de cámara cerrada, se observa la respiración de estado 5.
Existen varios métodos para evaluar los estados de energía celular14 con dos dispositivos que dominan la evaluación actual en tiempo real de OXPHOS a través del análisis del consumo de oxígeno, medido como la función de la disminución de oxígeno a lo largo del tiempo en un sistema de cámara cerrada con diferente aplicabilidad dependiendo del modelo experimental y la pregunta de investigación: el respirómetro de alta resolución Oroboros 2k y el analizador de flujo extracelular Seahorse XF. Ambos dispositivos registran las tasas de consumo de oxígeno como una disminución en picomoles (pmol) de oxígeno (O2) por segundo como un valor absoluto dentro de la cámara o microplaca del pozo. El consumo específico de oxígeno por masa se obtiene normalizando el consumo de oxígeno respectivo en una receta tampón específica por número de células (millones), peso tisular (mg) o cantidad de proteína.
El O2k (Oroboros Instruments) es un sistema cerrado de dos cámaras equipado con un sensor polarográfico de oxígeno (abreviado como respirómetro de alta resolución basado en cámara: cHRR). Cada cámara experimental contiene 2 ml de líquido que se mantiene homogéneo por agitadores magnéticos. El sensor polarográfico de oxígeno utiliza un enfoque amperométrico para medir el oxígeno: contiene un cátodo de oro, un ánodo de cloruro de plata / plata y, entre una solución KCI, crea una celda electroquímica sobre la cual se aplica un voltaje (0.8 V). El oxígeno del medio de ensayo se difunde a través de una membrana de etileno propileno fluorado de 25 μm (O 2-permeable) y sufre una reducción en el cátodo, produciendo peróxido de hidrógeno. En el ánodo, la plata es oxidada por peróxido de hidrógeno, generando una corriente eléctrica. Esta corriente eléctrica (amperio) está linealmente relacionada con la presión parcial de oxígeno. La presión parcial de oxígeno y el factor de solubilidad de oxígeno del medio de ensayo se utilizan para calcular la concentración de oxígeno. Dado que la presión parcial de oxígeno depende de la temperatura experimental y las mediciones polarográficas son sensibles a la temperatura, las fluctuaciones de temperatura necesitan una regulación precisa (±0,002 °C) mediante un bloque de calentamiento Peltier. La temperatura se puede controlar dentro de un rango de 4 ° C y 47 ° C.
El analizador de flujo extracelular Seahorse XF (Agilent) es un sistema basado en placas con formato de microplaca de 24 o 96 pocillos en el que tres electrodos de fluorescencia miden el consumo de oxígeno a lo largo del tiempo en cada pozo (abreviado como respirómetro de alta resolución basado en microplacas: mHRR). Un máximo de cuatro puertos en el cartucho de ensayo están disponibles para la inyección automatizada durante el ensayo. Un ensayo contiene múltiples ciclos, cada uno con tres fases: 1) mezcla, 2) espera y 3) medición. Durante la fase de medición, las sondas del sensor se bajan a la microplaca creando una cámara temporalmente cerrada que contiene un volumen de 7-10 μL para medir la luz emitida. Esta luz es emitida por fluoróforos incrustados en polímeros en la punta de las sondas del sensor, que detectan O2 en función del enfriamiento de fosforescencia. La intensidad de la señal de fluorescencia es proporcional a O2 e influenciada por la temperatura del sensor y el medio de ensayo. Por lo tanto, la estimación precisa del oxígeno requiere un enfoque relativo con un pozo de fondo sin ninguna muestra. La restauración de la concentración de oxígeno ocurre durante la fase de mezcla cuando el sensor se mueve hacia arriba y hacia abajo para mezclar el volumen por encima de la cámara temporal. Cada ciclo calcula una tasa de consumo de oxígeno. La temperatura se puede controlar dentro de un rango de 16 ° C y 42 ° C.
HrR es el estándar de oro para evaluar la bioenergética celular en enfermedades primarias y asociadas a las mitocondrias y el metabolismo celular general. En este estudio, se proporcionan protocolos básicos para la HRR para evaluar la función de OXPHOS en células y tejidos.
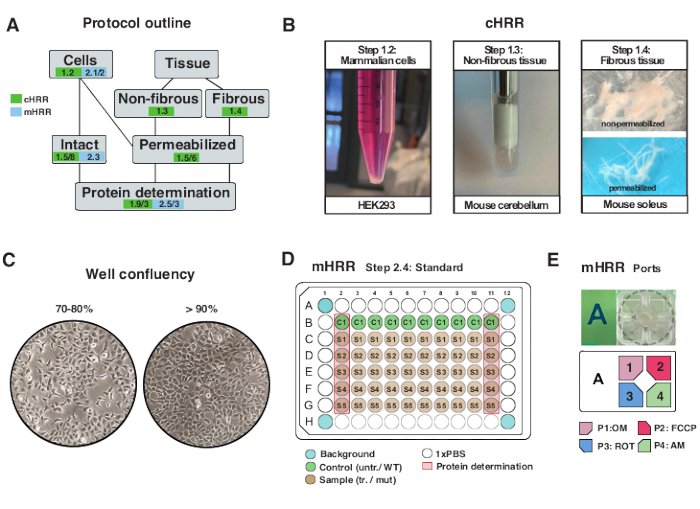
Figura 2: Flujo de trabajo para preparaciones celulares y tisulares para la RCH, y preparación celular para la respirometría de RMH. (A) Esquema de los protocolos proporcionados. (B) Células de mamíferos (paso 1.2): pellet HEK293 igual a 3 x 106 celdas (panel izquierdo). Tejido no fibroso (paso 1.3): Preparación de lisado de cerebelo murino en alfarero de teflón de 2 ml (panel medio). Permeabilización del músculo esquelético inducida por saponina (paso 1.4) panel derecho) para la respirometría de RCH. (C) Diseño estándar de siembra de microplacas (paso 2.4) y verificación de confluencia para el análisis de células eucariotas (HEK293) para la respirometría mHRR. (D, E) Esquema de carga del puerto de inyección para respirometría mHRR (paso 2.4). Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
Tradicionalmente, la bioenergética mitocondrial se ha estudiado con electrodos de oxígeno tipo Clark. Sin embargo, la falta de resolución y rendimiento justificaba el avance tecnológico. Hasta la fecha, el O2k (conocido como cHRR) y el seahorse XF96 Flux Analyzer (conocido como mHRR) han sido ampliamente adoptados en el campo de la bioenergética celular. Aquí, presentamos una colección comprensible de protocolos para el análisis del metabolismo energético celular a través de la evaluación de la respiración mi…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Este trabajo fue apoyado por fondos de la Academia de Finlandia (C.B.J), la Fundación Magnus Ehrnroot (C.B.J)), y una beca de doctorado de la Escuela de Graduados de Ciencias de la Vida Integrada (R.A.).
Materials
| 2 mL Potter-Elvehjem Glass/PTFE Tissue Grinder/Homogenizer | Omni International | 07-358029 | |
| 95% O2, 5% CO2 medical gas mixture | Potter for tissue grinding | ||
| ADP | Sigma | A 4386 | |
| Antimycin A | Sigma | A 8674 | Chemical |
| Ascorbate | Merck | PHR1279-1G | Chemical, dissolve in ethanol |
| BSA (fatty accid free) | Sigma | A 6003 | Chemical |
| CaCO3 | Sigma | C 4830 | Chemical |
| Cytochrome c | Sigma | C 7752 | Chemical |
| Digitonin | Sigma | D 5628 | Chemical |
| Dithiothreitol | Sigma | D 0632 | Chemical, dissolve in DMSO |
| D-Sucrose | Roth | 4621.1 | Chemical |
| Dulbecco’s modified Eagle’s medium (High glucose) | Fisher Scientific | 41965-039 | Chemical |
| Dulbecco’s modified Eagle’s medium (No Glucose) | Fisher Scientific | A14430-01 | |
| EGTA | Sigma | E 4378 | |
| Etomoxir | Sigma | E1905 | Chemical |
| Falcon 15 ml Conical Centrifuge Tubes | Fisher Scientific | AM12500 | Chemical |
| Falcon 50 ml Conical Centrifuge Tubes | Fisher Scientific | AM12501 | |
| FCCP | Sigma | C 2920 | |
| Glucose | Sigma | G7021 | Chemical, dissolve in ethanol |
| Glutamate | Sigma | G 1626 | Chemical |
| GlutaMax (100x) (200 nM L-alanyl-L-glutamine dipeptide) | Fisher Scientific | 35050061 | Chemical |
| HEK293 cells | ATTC | CRL-1573 | |
| Hemocytometer | Fisher Scientific | 0267151B | Instrument for cell counting |
| Hepes | Sigma | H 7523 | Chemical |
| Imidazole | Fluka | 56750 | Chemical |
| KCl | Merck | 1.04936 | Chemical |
| L-carnitine | Sigma | C0283 | Chemical |
| Malate | Sigma | M 1000 | Chemical |
| MES hydrate | Sigma | M8250 | Chemical |
| MgCl2 | Sigma | M 9272 | Chemical |
| Na2ATP | Sigma | A 2383 | Chemical |
| Na2Phosphocreatine | Sigma | P 7936 | Chemical |
| Na-pyruvate (100 mM) (100x) | Fisher Scientific | 11360070 | |
| NEAA (Non-essential amino acids) 100x | Fisher Scientific | 11140035 | |
| Normal FBS (10x) | Fisher Scientific | 10500064 | |
| O2k-Core: Oxygraph-2k | Oroboros Instruments | 10000-02 | High-resolution respirometry instrument |
| O2k-Titration Set | Oroboros Instruments | 20820-03 | Hamilton syringes for chemical injections |
| Oligomycin | Sigma | O 4876 | Chemical, dissolve in ethanol |
| Palmitoylcarnitine | Sigma | P 4509 | Chemical |
| Penicillin-Streptomycin | Fisher Scientific | 15140122 | |
| Pierce BCA Protein Assay Kit | Fisher Scientific | 23227 | |
| Pyruvate | Sigma | P 2256 | Chemical |
| RIPA-Buffer | Fisher Scientific | 89900 | Chemical |
| Rotenone | Sigma | R 8875 | Chemical, dissolve in ethanol |
| Saponin | Sigma | S7900 | Chemical |
Seahorse XF DMEM assay medium pack, pH 7.4 |
Agilent, Santa Clara, CA |
103680-100 | |
| Seahorse XFe96 Extracellular Flux Analyzer | Agilent, Santa Clara, CA |
High-throughput respirometry instrument | |
| Seahorse XFe96 FluxPak | Agilent, Santa Clara, CA |
Includes assay plates, cartridges, loading guides for transferring compounds to the assay cartridge, and calibrant solution. |
|
| Small scissors | Fisher Scientific | 08-951-20 | |
| Sodium azide | Sigma | S2002 | Chemical |
| Succinate | Sigma | S 2378 | Chemical |
| Taurine | Sigma | T 8691 | Chemical |
| TMPD | Sigma | T 3134 | Chemical |
| Trypan Blue solution | Merck | 72-57-1 | Chemical |
| Trypsin 0.25% EDTA | Fisher Scientific | 25200056 | |
| Two thin-edged forceps | Fisher Scientific | 12-000-122 | |
| Uridine stock (500x) | Sigma | U3750 | Chemical |
References
- McBride, H. M., Neuspiel, M., Wasiak, S. Mitochondria: More than just a powerhouse. Current Biology. 16 (14), 551-560 (2006).
- Mehta, M. M., Weinberg, S. E., Chandel, N. S. Mitochondrial control of immunity. Beyond ATP. Nature Reviews Immunology. 17 (10), 608-620 (2017).
- Spinelli, J. B., Haigis, M. C. The multifaceted contributions of mitochondria to cellular metabolism. Nature Cell Biology. 20 (7), 745-754 (2018).
- Gnaiger, E. Capacity of oxidative phosphorylation in human skeletal muscle. New perspectives of mitochondrial physiology. International Journal of Biochemistry and Cell Biology. 41 (10), 1837-1845 (2009).
- Gorman, G. S., et al. Mitochondrial diseases. Nature Reviews Disease Primers. 2, 1-23 (2016).
- Boushel, R., Gnaiger, E., Schjerling, P., Skovbro, M., Kraunsøe, R., Dela, F. Patients with type 2 diabetes have normal mitochondrial function in skeletal muscle. Diabetologia. 50 (4), 790-796 (2007).
- Cogliati, S., et al. Mitochondrial cristae shape determines respiratory chain supercomplexes assembly and respiratory efficiency. Cell. 155 (1), 160-171 (2013).
- Kühlbrandt, W. Structure and function of mitochondrial membrane protein complexes. BMC Biology. 13, 1-11 (2015).
- Gnaiger, E. Mitochondrial pathways and Respiratory control. An introduction to OXPHOS analysis. Bioenergetics communications. 5th ed. , (2020).
- Jackson, C. B., et al. Mutations in SDHD lead to autosomal recessive encephalomyopathy and isolated mitochondrial complex II deficiency. Journal of Medical Genetics. 51 (3), 170-175 (2014).
- Pesta, D., Gnaiger, E. High-resolution respirometry: OXPHOS protocols for human cells and permeabilized fibers from small biopsies of human muscle. Methods in Molecular Biology. 810, 25-58 (2012).
- Horan, M. P., Pichaud, N., Ballard, J. W. O. Review: Quantifying mitochondrial dysfunction in complex diseases of aging. Journals of Gerontology – Series A Biological Sciences and Medical Sciences. 67 (10), 1022-1035 (2012).
- Doerrier, C., Garcia-Souza, L. F., Krumschnabel, G., Wohlfarter, Y., Mészáros, A. T., Gnaiger, E. High-resolution fluorespirometry and oxphos protocols for human cells, permeabilized fibers from small biopsies of muscle, and isolated mitochondria. Methods in Molecular Biology. 1782, 31-70 (2018).
- Zhang, J., et al. Measuring energy metabolism in cultured cells, including human pluripotent stem cells and differentiated cells. Nature Protocols. 7 (6), 1068-1085 (2012).
- García-Roche, M., Casal, A., Carriquiry, M., Radi, R., Quijano, C., Cassina, A. Respiratory analysis of coupled mitochondria in cryopreserved liver biopsies. Redox Biology. 17, 207-212 (2018).
- Acin-Perez, R., et al. A novel approach to measure mitochondrial respiration in frozen biological samples. The EMBO Journal. 39 (13), 1-18 (2020).
- Cell metabolism assay kits. Seahorse assay kits and media Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-lits-reagents-cell-assay-media (2021)
- Chance, B., Williams, G. R. A method for the localization of sites for oxidative phosphorylation. Nature. 176 (4475), 250-254 (1955).
- Gnaiger, E., et al. Mitochondrial respiratory states and rates. MitoFit Preprint Arch. , (2019).
- Gnaiger, E. O2k-procedures: SOP O2k quality control 1: Polarographic oxygen sensors and accuracy of calibration Section Page. Oroboros. 03 (18), 1-21 (2020).
- Robinson, B. H., Petrova-Benedict, R., Buncic, J. R., Wallace, D. C. Nonviability of cells with oxidative defects in galactose medium: A screening test for affected patient fibroblasts. Biochemical Medicine and Metabolic Biology. 48 (2), 122-126 (1992).
- King, M. P., Attardi, G. Human cells lacking mtDNA: Repopulation with exogenous mitochondria by complementation. Science. 246 (4929), 500-503 (1989).
- Makrecka-Kuka, M., Krumschnabel, G., Gnaiger, E. High-resolution respirometry for simultaneous measurement of oxygen and hydrogen peroxide fluxes in permeabilized cells, tissue homogenate and isolated mitochondria. Biomolecules. 5 (3), 1319-1338 (2015).
- Fasching, M., Gnaiger, E. O2k quality control 2: Instrumental oxygen background correction and accuracy of oxygen flux. Mitochondrial Physiology Network. 14 (06), 1-14 (2016).
- Gnaiger, E., Lassnig, B., Kuznetsov, A., Rieger, G., Margreiter, R. Excess capacity of cytochrome c oxidase. Journal of Experimental Biology. 1139, 1129-1139 (1998).
- Gnaiger, E., et al. Mitochondria in the Cold. Life in the Cold. , 431-442 (2000).
- Fontana-Ayoub, M., Fasching, E., Gnaiger, Selected media and chemicals for respirometry with mitochondrial preparations. Mitochondrial Physiology Network. 02 (17), 1-9 (2014).
- Gerencser, A. A., et al. Quantitative microplate-based respirometry with correction for oxygen diffusion. Analytical Chemistry. 81 (16), 6868-6878 (2009).
- Krumschnabel, G., Eigentler, A., Fasching, M., Gnaiger, E. Use of safranin for the assessment of mitochondrial membrane potential by high-resolution respirometry and fluorometry. Methods in Enzymology. 542, 163-181 (2014).
- Nászai, A., Terhes, E., Kaszaki, J., Boros, M., Juhász, L. Ca(2+)N it be measured? Detection of extramitochondrial calcium movement with high-resolution fluorespirometry. Scientific Reports. 9 (1), 1-13 (2019).
- Pajak, B., et al. 2-Deoxy-d-Glucose and its analogs: From diagnostic to therapeutic agents. International Journal of Molecular Sciences. 21 (1), 234 (2019).
- Mercier-Letondal, P., Marton, C., Godet, Y., Galaine, J. Validation of a method evaluating T cell metabolic potential in compliance with ICH Q2 (R1). Journal of Translational Medicine. 19 (1), 1-15 (2021).
- Sauerbeck, A., et al. Analysis of regional brain mitochondrial bioenergetics and susceptibility to mitochondrial inhibition utilizing a microplate based system. Journal of Neuroscience Methods. 198 (1), 36-43 (2011).
- Jackman, M. R., Willis, W. T. Characteristics of mitochondria isolated from type I and type IIb skeletal muscle. American Journal of Physiology – Cell Physiology. 270 (2), 673-678 (1996).
- Ponsot, E., et al. Mitochondrial tissue specificity of substrates utilization in rat cardiac and skeletal muscles. Journal of Cellular Physiology. 203 (3), 479-486 (2005).
- Schönfeld, P., Reiser, G. Why does brain metabolism not favor burning of fatty acids to provide energy-Reflections on disadvantages of the use of free fatty acids as fuel for brain. Journal of Cerebral Blood Flow and Metabolism. 33 (10), 1493-1499 (2013).
- Calderon-Dominguez, M., Mir, J. F., Fucho, R., Weber, M., Serra, D., Herrero, L. Fatty acid metabolism and the basis of brown adipose tissue function. Adipocyte. 5 (2), 98-118 (2016).
- Divakaruni, A. S., Rogers, G. W., Murphy, A. N. Measuring mitochondrial function in permeabilized cells using the seahorse XF analyzer or a clark-type oxygen electrode. Current Protocols in Toxicology. 2014, 1-16 (2014).
- Iuso, A., Repp, B., Biagosch, C., Terrile, C., Prokisch, H. Assessing mitochondrial bioenergetics in isolated mitochondria from various mouse tissues using Seahorse XF96 analyzer. Methods in Molecular Biology. 1567, 217-230 (2017).
- Rogers, G. W., et al. High throughput microplate respiratory measurements using minimal quantities of isolated mitochondria. PLoS ONE. 6 (7), 21746 (2011).
- Jordá, A., Zaragozá, R., Portolés, M., Báguena-Cervellera, R., Renau-Piqueras, J. Long-term high-protein diet induces biochemical and ultrastructural changes in rat liver mitochondria. Archives of Biochemistry and Biophysics. 265 (2), 241-248 (1988).
- Jackson, C. B., Gallati, S., Schaller, A. QPCR-based mitochondrial DNA quantification: Influence of template DNA fragmentation on accuracy. Biochemical and Biophysical Research Communications. 423 (3), 441-447 (2012).
- Hirsch, H. M. Tissue autoxidation inhibitors: II. The presence of inhibitor in intact cells; Assay of liver and hepatoma effect on radio-oxidations. Recherche en cancérologie. 16 (11), 1076-1082 (1956).
- Picard, M., et al. Mitochondrial structure and function are disrupted by standard Isolation methods. PLoS ONE. 6 (3), 18317 (2011).
- Tanumihardja, E., Slaats, R. H., Van Der Meer, A. D., Passier, R., Olthuis, W., Van Den Berg, A. Measuring both pH and O2 with a single On-Chip sensor in cultures of human pluripotent stem cell-derived cardiomyocytes to track induced changes in cellular metabolism. ACS Sensors. 6 (1), 267-274 (2021).
- Harms, F., Stolker, R. J., Mik, E. Cutaneous respirometry as novel technique to monitor mitochondrial function: A feasibility study in healthy volunteers. PLoS ONE. 11 (7), 159544 (2016).
- Levitsky, Y., et al. Micro-respirometry of whole cells and isolated mitochondria. RSC Advances. 9 (57), 33257-33267 (2019).

