Подвижность одиночных молекул и кластеров двунаправленного кинезина-5 Cin8, очищенного из клеток S. cerevisiae
Summary
Двунаправленный митотический кинезин-5 Cin8 накапливается в кластерах, которые расщепляются и сливаются во время их подвижности. Накопление в кластерах также изменяет скорость и направленность Cin8. Здесь описан протокол анализа подвижности с очищенным Cin8-GFP и анализа подвижных свойств отдельных молекул и кластеров Cin8.
Abstract
Митотические биполярные двигатели кинезин-5 выполняют важные функции в динамике шпинделя. Эти двигатели демонстрируют гомотетрамерную структуру с двумя парами каталитических моторных доменов, расположенных на противоположных концах активного комплекса. Эта уникальная архитектура позволяет двигателям кинезина-5 сшивать и раздвигать антипараллельные шпиндельные микротрубочки (МТ), обеспечивая тем самым направленную наружу силу, которая разделяет полюса шпинделя друг от друга. Ранее считалось, что двигатели кинезин-5 направлены исключительно с плюс-концом. Однако недавние исследования показали, что несколько грибковых двигателей кинезин-5 направлены на уровень одной молекулы и могут переключать направленность в различных экспериментальных условиях. Saccharomyces cerevisiae kinesin-5 Cin8 является примером такого двунаправленного моторного белка: в условиях высокой ионной прочности отдельные молекулы Cin8 движутся в направлении минус-конца MTs. Также было показано, что Cin8 образует подвижные кластеры, преимущественно на минусовом конце МТ, и такая кластеризация позволяет Cin8 переключать направленность и подвергаться медленной, плюс-конечной направленной подвижности. В этой статье представлен подробный протокол для всех этапов работы с GFP-меченым кинезином-5 Cin8, от гиперэкспрессии белка в клетках S. cerevisiae и его очистки до анализа подвижности одной молекулы in vitro . Недавно разработанный метод, описанный здесь, помогает дифференцировать отдельные молекулы и кластеры Cin8 на основе их интенсивности флуоресценции. Этот метод позволяет проводить раздельный анализ подвижности отдельных молекул и кластеров Cin8, обеспечивая тем самым характеристику зависимости подвижности Cin8 от размера кластера.
Introduction
Большое количество событий подвижности в эукариотических клетках опосредовано функцией молекулярных моторных белков. Эти двигатели движутся вдоль цитоскелетных нитей, актиновых нитей и микротрубочек (МТ) и преобразуют химическую энергию гидролиза АТФ в кинетические и механические силы, необходимые для управления биологической подвижностью внутри клеток. S. cerevisiae Cin8 на основе MT представляет собой биполярный гомотетрамерный моторный белок кинезин-5, который сшивает и скользит веретено MTs друг отдруга 1. Cin8 выполняет важнейшие функции при митозе, в веретенообразном сборе 2,3,4 и удлинении шпинделя при анафазе 5,6,7. Ранее было продемонстрировано, что Cin8 является двунаправленным двигателем, который переключает направленность в разных экспериментальных условиях. Например, в условиях высокой ионной прочности одиночные двигатели Cin8 движутся к минусовому концу MT, в то время как в кластерах, в многомоторных скользящих анализах MT и между противопараллельными MT двигатели Cin8 движутся в основном к плюсовым концам MTs 8,9,10,11,12 . Эти результаты были весьма неожиданными по нескольким причинам. Во-первых, Cin8 несет свой каталитический двигательный домен на амино-конце, и ранее считалось, что такие двигатели направлены исключительно плюс-конец, тогда как Cin8 был показан как минус-конец, направленный на уровень одной молекулы. Во-вторых, кинезиновые двигатели считались однонаправленными, либо минусовыми, либо плюс-концевыми, тогда как Cin8 был показан двунаправленным, в зависимости от условий эксперимента. Наконец, из-за ориентации МТ на митотическом шпинделе классическая роль двигателей кинезин-5 в разделении полюсов шпинделя при сборке шпинделя и анафазы B может быть объяснена только их направленной подвижностью на МТ, которые они сшивают 1,13. После первых сообщений о двунаправленности Cin8 было продемонстрировано, что несколько других кинезиновых двигателей являются двунаправленными 14,15,16, что указывает на то, что двунаправленная подвижность кинезиновых двигателей может быть более распространенной, чем считалось ранее.
Ранее сообщалось, что в клетках Cin8 также движется двунаправленным образом8, поддерживая представление о том, что двунаправленная подвижность некоторых двигателей кинезина-5 важна для их внутриклеточных функций. Кроме того, поскольку три двигателя кинезин-5, которые, как сообщалось, являются двунаправленными, получены из грибковых клеток, в таких клетках10 недавно была предложена возможная роль двунаправленности двигателей кинезин-5. Согласно этой модели, при закрытом митозе грибковых клеток, где ядерная оболочка не разрушается во время митоза, двигатели кинезина-5 обеспечивают начальную силу, которая разделяет полюса шпинделя друг от друга до сборки шпинделя. Для выполнения этой задачи до разделения полюсов шпинделя двигатели кинезин-5 локализуются вблизи полюсов шпинделя своей направленной подвижностью на одиночных ядерных МТ. Оказавшись в этом положении, двигатели кинезин-5 группируются, переключают направленность, захватывают и сшивают МТ с соседних полюсов шпинделя. Впоследствии двигатели кинезин-5 обеспечивают начальное разделение полюсов за счет плюсовой направленной подвижности на МТ, которые они сшивают. В соответствии с этой моделью как направленная подвижность на одиночных МТ, так и направленная подвижность на сшитых МТ во время антипараллельного скольжения необходимы для выполнения грибковых двигателей кинезин-5 для выполнения своих ролей в сборке шпинделя 1,13.
Общей целью описанного способа является получение высокочистого грибка GFP-меченого кинезина-5 Cin8 и выполнение анализа подвижности одной молекулы (рисунок 1) при отдельном анализе подвижности отдельных молекул и кластеров Cin8. Разделение между отдельными молекулами и кластерами важно, поскольку одним из факторов, которые, как было продемонстрировано, влияют на направленность Cin8, является его накопление в кластерах на MTs10,12. Альтернативные анализы подвижности, такие как поверхностное скольжение MT и скользящие анализы MT, не дают информации об активности одиночных моторных белков17,18. Надежные одномолекулярные методы анализа подвижности и анализа, описанные здесь, были успешно применены для характеристики различных аспектов двигателей кинезин-5, Cin8 и Kip1 10,11,12,14,19,20.
Здесь представлен подробный протокол для сверхэкспрессии и очистки Cin8, полимеризации МТ и анализа подвижности одной молекулы. Кроме того, описаны анализы для дифференциации отдельных молекул и кластеров Cin8, а также для определения одиночных моторных и кластерных скоростей с помощью анализа среднего смещения (MD) и среднего квадратного смещения (MSD). Этот протокол призван помочь исследователям визуализировать все этапы процедур и помочь в устранении неполадок этого типа анализов.
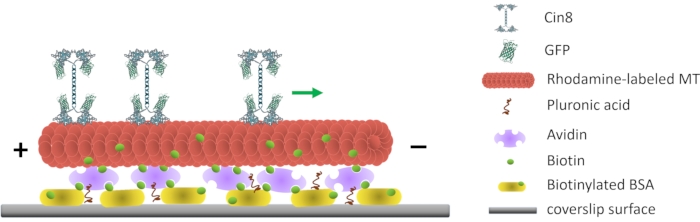
Рисунок 1: Схематическое представление анализа подвижности одной молекулы. Биотинилированные флуоресцентные МТ прикреплены к поверхности стекла, покрытой авидином, который взаимодействует с поверхностно присоединенным биотинилированным BSA. Зеленая стрелка представляет направление движения отдельных молекул Cin8 в условиях высокой ионной прочности. +/- представляют полярность MT. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Protocol
Representative Results
Discussion
В данной работе представлен протокол анализа подвижности одной молекулы с двунаправленным кинезином-5 Cin8 и анализа подвижности. Полноразмерный Cin818 , включая сигнал собственной ядерной локализации (NLS) на С-терминале, был очищен от собственного хозяина S. cerevisiae. Посколь?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Это исследование было частично поддержано грантом Израильского научного фонда (ISF-386/18) и грантом Израильского двустороннего научного фонда (BSF-2019008), присужденным L.G.
Materials
| Adenine | FORMEDIUM | DOC0230 | |
| ATP | Sigma | A7699 | |
| Biotinylated-BSA | Sigma | A8549 | |
| Casein | Sigma | C7078 | |
| Catalase (C40) | Sigma | C40 | |
| Creatine-Kinase | Sigma | C3755 | |
| Dithiothreitol (DTT) | Sigma | D0632 | |
| EDTA | Sigma | E5134 | |
| EGTA | Sigma | E4378 | |
| Fluorescence filter set for GFP | Chroma | 49002: ET-EGFP (FITC/Cy2) | |
| Fluorescence filter set for Rhodamine | Chroma | 49004: ET-CY3/TRITC | |
| Fluorescence inverted microscope | Zeiss | Axiovert 200M | |
| Galactose | Tivan Biotech | GAL02 | |
| Glucose | Sigma | G8270 | |
| Glucose Oxidase | Sigma | G7141 | |
| Glycerol | Sigma | G5516 | |
| GlycylGlycine | Merck | G0674 | |
| GMPCPP | Jana Bioscience | Nu-405L | |
| GTB | Cytoskeleton | BST01-010 | |
| GTP | Sigma | G8877 | |
| Histidine | Duchefa Biochemie | H0710.0100 | |
| ImageJ-FIJI software | https://imagej.net/plugins/trackmate/ | version 2.1.0/1.53c; Java 1.8.0_172 [64-bit] for Windows 10 | |
| Imidazole | Sigma | I0125 | |
| InstantBlue Coomassie Protein Stain | Abcam | ab119211 | |
| Lens | Zeiss | 100x/1.4 oil DIC objective | |
| Lysine | FORMEDIUM | DOC0161 | |
| Magnesium Chloride | Sigma | M8266 | |
| Methionine | Duchefa Biochemie | M0715.0100 | |
| Neo | Andor Technologies | sCMOS camera | |
| NeutraAvidin | Life | A2666 | |
| Ni-NTA Agarose | Invitrogen | R901-15 | |
| Phospho-Creatine | Sigma | P1937 | |
| Pipes | Sigma | P1851 | |
| Pluronic acid F-127 (poloxamer) | Sigma | P2443 | |
| Potassium Chloride | Sigma | P9541 | |
| Raffinose | Tivan Biotech | RAF01 | |
| Size Exclusion chromatography instument | GE Healthcare | AKTA Pure | |
| Spectrophotometer | ThermoFisher Scientific | NanoDrop | |
| Superose-6 10/300 GL | GE Healthcare | 17-5172-01 | |
| Tris | Roshe | 10708976001 | |
| Triton X-100 | Sigma | T8787 | |
| Tryptophan | Duchefa Biochemie | T0720.0100 | |
| Tubulin protein | Cytoskeleton | T240 | |
| Tubulin, biotinylated | Cytoskeleton | T333P | |
| Tubulin, TRITC Rhodamine | Cytoskeleton | TL530M | |
| Uracil | Sigma | U0750-100G | |
| Yeast nitrogen base | FORMEDIUM | CYN0401S | |
| α-GFP antibody | Santa Cruz Biotechnology | SC8036 | |
| β-mercaptoethanol | Sigma | M3148 |
References
- Singh, S. K., Pandey, H., Al-Bassam, J., Gheber, L. Bidirectional motility of kinesin-5 motor proteins: structural determinants, cumulative functions and physiological roles. Cellular and Molecular Life Sciences. 75 (10), 1757-1771 (2018).
- Hoyt, M. A., He, L., Totis, L., Saunders, W. S. Loss of function of Saccharomyces cerevisiae kinesin-related CIN8 and KIP1 is suppressed by KAR3 motor domain mutations. Génétique. 135 (1), 35-44 (1993).
- Saunders, W. S., Hoyt, M. A. Kinesin-related proteins required for structural integrity of the mitotic spindle. Cell. 70 (3), 451-458 (1992).
- Hoyt, M. A., He, L., Loo, K. K., Saunders, W. S. Two Saccharomyces cerevisiae kinesin-related gene products required for mitotic spindle assembly. Journal of Cell Biology. 118 (1), 109-120 (1992).
- Gerson-Gurwitz, A., et al. Mid-anaphase arrest in S. cerevisiae cells eliminated for the function of Cin8 and dynein. Cellular and Molecular Life Sciences. 66 (2), 301-313 (2009).
- Fridman, V., Gerson-Gurwitz, A., Movshovich, N., Kupiec, M., Gheber, L. Midzone organization restricts interpolar microtubule plus-end dynamics during spindle elongation. EMBO Reports. 10 (4), 387-393 (2009).
- Movshovich, N., et al. Slk19-dependent mid-anaphase pause in kinesin-5-mutated cells. Journal of Cell Science. 121 (15), 2529-2539 (2008).
- Gerson-Gurwitz, A., et al. Directionality of individual kinesin-5 Cin8 motors is modulated by loop 8, ionic strength and microtubule geometry. Embo Journal. 30 (24), 4942-4954 (2011).
- Roostalu, J., et al. Directional switching of the kinesin Cin8 through motor coupling. Science. 332 (6025), 94-99 (2011).
- Shapira, O., Goldstein, A., Al-Bassam, J., Gheber, L. A potential physiological role for bi-directional motility and motor clustering of mitotic kinesin-5 Cin8 in yeast mitosis. Journal of Cell Science. 130 (4), 725-734 (2017).
- Goldstein-Levitin, A., Pandey, H., Allhuzaeel, K., Kass, I., Gheber, L. Intracellular functions and motile properties of bi-directional kinesin-5 Cin8 are regulated by neck linker docking. eLife. 10, 71036 (2021).
- Pandey, H., et al. Drag-induced directionality switching of kinesin-5 Cin8 revealed by cluster-motility analysis. Science Advances. 7 (6), 1687 (2021).
- Pandey, H., Popov, M., Goldstein-Levitin, A., Gheber, L. Mechanisms by which kinesin-5 motors perform their multiple intracellular functions. International Journal of Molecular Sciences. 22 (12), 6420 (2021).
- Fridman, V., et al. Kinesin-5 Kip1 is a bi-directional motor that stabilizes microtubules and tracks their plus-ends in vivo. Journal of Cell Science. 126, 4147-4159 (2013).
- Edamatsu, M. Bidirectional motility of the fission yeast kinesin-5, Cut7. Biochemical and Biophysical Research Communications. 446 (1), 231-234 (2014).
- Popchock, A. R., et al. The mitotic kinesin-14 KlpA contains a context-dependent directionality switch. Nature Communications. 8, 13999 (2017).
- Bodrug, T., et al. The kinesin-5 tail domain directly modulates the mechanochemical cycle of the motor domain for anti-parallel microtubule sliding. eLife. 9 (9), 51131 (2020).
- Gheber, L., Kuo, S. C., Hoyt, M. A. Motile properties of the kinesin-related Cin8p spindle motor extracted from Saccharomyces cerevisiae cells. Journal of Biological Chemistry. 274 (14), 9564-9572 (1999).
- Pandey, H., et al. Flexible microtubule anchoring modulates the bi-directional motility of the kinesin-5 Cin8. Cellular and Molecular Life Sciences. 78 (16), 6051-6068 (2021).
- Shapira, O., Gheber, L. Motile properties of the bi-directional kinesin-5 Cin8 are affected by phosphorylation in its motor domain. Scientific Reports. 6, 25597 (2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Britto, M., et al. Schizosaccharomyces pombe kinesin-5 switches direction using a steric blocking mechanism. Proceedings of the National Academy of Sciences of the United States of America. 113 (47), 7483-7489 (2016).
- Kapitein, L. C., et al. Microtubule cross-linking triggers the directional motility of kinesin-5. Journal of Cell Biology. 182 (3), 421-428 (2008).
- Furuta, K., Edamatsu, M., Maeda, Y., Toyoshima, Y. Y. Diffusion and directed movement in vitro motile properties of fission yeast kinesin-14 Pkl1. Journal of Biological Chemistry. 283 (52), 36465-36473 (2008).
- Katrukha, E. A., et al. Probing cytoskeletal modulation of passive and active intracellular dynamics using nanobody-functionalized quantum dots. Nature Communications. 8, 14772 (2017).
- Tinevez, J. Y., et al. TrackMate: An open and extensible platform for single-particle tracking. Methods. 115, 80-90 (2017).
- Jakobs, M. A. H., Dimitracopoulos, A., Franze, K. KymoBulter, a deep learning software for automated kymograph analysis. eLife. 8, 42288 (2019).

