Riboflavin-5′- Fosfatın Görünür Işık Fotolizi ile Patojenlerin İnaktivasyonu
Summary
Burada, düşük yoğunluklu mavi ve mor ışık ışınlaması altında flavin mononükleotidin (FMN) fotolizi sırasında üretilen reaktif oksijen türleri ile patojenik bakterileri inaktive etmek için bir protokol sunuyoruz. FMN fotolizinin sıhhi işlemler için basit ve güvenli bir yöntem olduğu gösterilmiştir.
Abstract
Riboflavin-5′-fosfat (veya flavin mononükleotid; FMN) görünür ışığa duyarlıdır. Reaktif oksijen türleri (ROS) de dahil olmak üzere çeşitli bileşikler, görünür ışıkla ışınlama üzerine FMN fotolizinden üretilebilir. FMN fotolizinden üretilen ROS, Staphylococcus aureus (S. aureus) gibi patojenik bakteriler de dahil olmak üzere mikroorganizmalara zararlıdır. Bu makale, örnek olarak, görünür ışık ışınlaması altında FMN’yi içeren fotokimyasal reaksiyonlar yoluyla S. aureus’u devre dışı bırakmak için bir protokol sunmaktadır. FMN fotolizi sırasında üretilen süperoksit radikal anyonu (), nitro mavi tetrazolyum (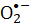 NBT) indirgemesi ile değerlendirilir. Reaktif
NBT) indirgemesi ile değerlendirilir. Reaktif 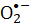 türlere atfedilen S. aureus’un mikrobiyal canlılığı, sürecin etkinliğini belirlemek için kullanılmıştır. Bakteriyel inaktivasyon oranı FMN konsantrasyonu ile orantılıdır. Mor ışık, S. aureus’u inaktive etmede mavi ışık ışınlamasından daha etkilidir, kırmızı veya yeşil ışık ise FMN fotolizini tetiklemez. Bu makalede, FMN fotolizi sıhhi işlemler için basit ve güvenli bir yöntem olarak gösterilmektedir.
türlere atfedilen S. aureus’un mikrobiyal canlılığı, sürecin etkinliğini belirlemek için kullanılmıştır. Bakteriyel inaktivasyon oranı FMN konsantrasyonu ile orantılıdır. Mor ışık, S. aureus’u inaktive etmede mavi ışık ışınlamasından daha etkilidir, kırmızı veya yeşil ışık ise FMN fotolizini tetiklemez. Bu makalede, FMN fotolizi sıhhi işlemler için basit ve güvenli bir yöntem olarak gösterilmektedir.
Introduction
Riboflavin-5′-fosfat (FMN), ribityl yan zincirinin riboflavin 5′-pozisyonunda fosforilasyon ile oluşur ve enerji üretmek için çok sayıda hücresel işlem için tüm flavoproteinler tarafından gereklidir. Aynı zamanda insan vücudundaki bazı fonksiyonlar için vitamin rolünü oynar1. FMN, suda riboflavin 2’den yaklaşık200 kat daha fazla çözünür.
Bakterilerin antibakteriyel fotodinamik inaktivasyonu (aPDI), bakteri direncini kontrol etmenin etkili bir yoludur 3,4 çünkü bakteriyel direnç moduna bağlı değildir. Klinik olarak aPDI yumuşak doku enfeksiyonlarını tedavi etmek için çok dirençli bakterilere bağlı hastane derisi enfeksiyonunu azaltmak amacıyla kullanılır 5,6,7,8,9. aPDI ayrıca reaktif oksijen türleri (ROS) üreterek hücre ölümü üretir. Süperoksit radikalleri (), singlet oksijen, hidroksil radikalleri ( •OH) ve peroksil radikalleri gibi ROS, reaktif oksijen10,11,12 içeren ve normalde reaktif olan serbest radikaller veya moleküllerdir13. ROS’un neden olduğu DNA hasarına benzer şekilde, membran peroksidasyonu ve endotel hücrelerinin tahrip edilmesi de hücrelerde ROS’a atfedilen olumsuz biyokimyasal reaksiyonlardır12.
•OH) ve peroksil radikalleri gibi ROS, reaktif oksijen10,11,12 içeren ve normalde reaktif olan serbest radikaller veya moleküllerdir13. ROS’un neden olduğu DNA hasarına benzer şekilde, membran peroksidasyonu ve endotel hücrelerinin tahrip edilmesi de hücrelerde ROS’a atfedilen olumsuz biyokimyasal reaksiyonlardır12.
Patojenik bakteriler için aPDI kullanımı, metiltioninyum klorür 14, PEI-c e6 konjugat15, porfirin16, titanyum dioksit 17, toluidin mavisi O18 ve çinko oksit nanopartikülleri 19 gibi kimyasal bileşiklerin varlığında mikroorganizmaları inaktive etmek için görünür veya UV ışık kaynağını içerir. Toluidin mavisi O ve metilen mavisi fenotiyazinyum boyalarıdır ve metilen mavisi toksik özelliklere sahiptir. Çinko oksit nanopartikülleri ve UV ışınlaması, olumsuz sağlık ve çevresel etkilerle bağlantılıdır. Bu nedenle, görünür ışınlama altında fotoliz yoluyla güvenilir, güvenli ve basit bir fotosensitizörün kullanılması daha fazla çalışmayı hak etmektedir.
Mikro besin maddesi, riboflavin veya FMN, toksik değildir ve gerçekten de gıda üretimi veya beslenmesi için kullanılır20. Hem FMN hem de riboflavin, ışık ışınlamasına karşı oldukça hassastır2. UV 1,2,21,22,23 ve mavi ışık ışınlaması 10,24 altında, bu iki bileşik uyarılmış bir duruma ulaşır. Fotoliz ile üretilen aktif riboflavin veya FMN, üçlü durumuna terfi ettirilir ve ROS aynı anda2,25 üretilir. Kumar ve ark., UV ışığı tarafından aktive edilen riboflavinin, patojenik mikroorganizmalarda DNA’nın guanin moiety’sinde artmış yaralanmaya neden olduğunu seçici olarak bildirmiştir26. UV ışığı ile ışınlama altında, fotodinamik olarak aktive edilmiş riboflavinin, çift sarmallı DNA27’de oksidatif stres için bir biyobelirteç olan 8-OH-dG’nin üretimini teşvik ettiği gösterilmiştir. S. aureus ve E. coli’nin riboflavin veya FMN fotolizi 10,24,28 sırasında ROS tarafından devre dışı bırakıldığı bildirilmiştir. Yazarlar tarafından yapılan önceki bir çalışma, riboflavin ve FMN içeren fotolitik reaksiyonların kristal menekşe, bir triarilmetan boyası ve üreten  bir antibakteriyel ajanı azalttığını ve kristal menekşe28’in antimikrobiyal kapasitesinin çoğunu ortadan kaldırdığını göstermiştir. Flavin adenin dinükleotid veya FMN mavi ışıkla ışınlandığında, ortaya çıkan ROS, in vitro29 zehirlenmesi için HeLa hücrelerinde apoptoz üretir. Riboflavin varlığında fotokimyasal tedavi kullanarak, Cui ve ark. proliferasyonlarını ve sitokin üretimini inhibe ederek lenfositleri inaktive ettiler30.
bir antibakteriyel ajanı azalttığını ve kristal menekşe28’in antimikrobiyal kapasitesinin çoğunu ortadan kaldırdığını göstermiştir. Flavin adenin dinükleotid veya FMN mavi ışıkla ışınlandığında, ortaya çıkan ROS, in vitro29 zehirlenmesi için HeLa hücrelerinde apoptoz üretir. Riboflavin varlığında fotokimyasal tedavi kullanarak, Cui ve ark. proliferasyonlarını ve sitokin üretimini inhibe ederek lenfositleri inaktive ettiler30.
Riboflavinin fotolizi, kan patojeninin UV 10,24 tarafından inaktive edilmesi için kullanılır, ancak UV ışık ışınlaması altında kan bileşenleri bozulabilir30. Ayrıca, UV’ye maruz kalan trombositlerin, membranlarındaki P-selectin ve LIMP-CD63 aktivasyon belirteçlerinin performansını giderek arttırdığı bildirilmektedir. UV ve yüksek yoğunluklu ışınlamanın sitotoksisitesinin araştırılması gerekir ve görünür ışığı içeren bir FMN fotoreaksiyonu sırasında karmaşık olmayan ve güvenli bir fotosensitizör çok faydalı olacaktır.
Daha kısa dalga boylarındaki ışık daha fazla enerjiye sahiptir ve hücrelere ciddi zararlar verme olasılığı çok daha yüksektir. Bununla birlikte, uygun bir fotosensitizörün varlığında, düşük yoğunluklu mor ışıkla ışınlama patojenik mikroorganizmaları inhibe edebilir. Mor ışıkla ışınlandığında FMN’nin  ışığa duyarlı hale getirilmesi ve üretilmesi, FMN fotolizinden ROS’un bakterilerin inaktivasyonunu arttırdığı yolu belirlemek için çalışmak için önemlidir.
ışığa duyarlı hale getirilmesi ve üretilmesi, FMN fotolizinden ROS’un bakterilerin inaktivasyonunu arttırdığı yolu belirlemek için çalışmak için önemlidir.
Antimikrobiyal kontrol yaygın bir konudur ve yeni antibiyotiklerin geliştirilmesi sıklıkla on yıllar alır. Menekşe ışıkla ışınlamadan sonra, FMN tarafından aracılık edilen fotoinaktivasyon, çevresel patojenik bakterileri yok edebilir. Bu çalışma, FMN fotolizini sürmek ve böylece PDI için üretmek  için mor ışık kullanan etkili bir antimikrobiyal protokolü in vitro olarak sunmaktadır. S. aureus’un mikrobiyal canlılığı, FMN kaynaklı aPDI’nın fizibilitesini belirlemek için kullanılır.
için mor ışık kullanan etkili bir antimikrobiyal protokolü in vitro olarak sunmaktadır. S. aureus’un mikrobiyal canlılığı, FMN kaynaklı aPDI’nın fizibilitesini belirlemek için kullanılır.
Protocol
Representative Results
Discussion
Bir fotosensitizör, ROS üretmek için kimyasal bileşiklerin fotokimyasal reaksiyonunu arttırır. Patojenik mikroorganizmalar, fotosensitizörlerin varlığında hafif ışınlama ile inaktive edilebilir. Bu çalışma, eksojen bir fotosensitizör olan FMN’nin mor ışık ışınlaması ile üretilen ROS’a bağlı olarak S. aureus’un aPDI değerini belirlemektedir.
Şekil 3’te gösterildiği gibi, FMN için, 444 nm’deki absorbans, mor veya mavi ışık…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Yazarlar, deneylere verdikleri destek için Dr. Tak-Wah Wong ve Bay Zong-Jhe Hsieh’e minnettardır.
Materials
| Blue, green and red LED lights | Vita LED Technologies Co., Tainan, Taiwan | DC 12 V 5050 | |
| Dimethyl Sulfoxide | Sigma-Aldrich, St. Louis, MO | 190186 | |
| Infrared thermometer | Raytek Co. Santa Cruz, CA | MT4 | |
| LB broth | Difco Co., NJ | ||
| L-Methionine | Sigma-Aldrich, St. Louis, MO | 1.05707 | |
| NBT | Bio Basic, Inc. Markham, Ontario, Canada | ||
| Power supply | China tech Co., New Taipei City, Taiwan | YP30-3-2 | |
| Riboflavin 5′-phosphate | Sigma-Aldrich, St. Louis, MO | R7774 | |
| RNase | New England BioLabs, Inc. Ipswich, MA | ||
| Solar power meter | Tenmars Electronics Co., Taipei, Taiwan | TM-207 | |
| Staphylococcus aureus subsp. aureus | Bioresource Collection and Research Center (BCRC), Hsinchu, Taiwan | 10451 | |
| UV-Vis optical spectrometer | Ocean Optics, Dunedin, FL | USB4000 | |
| UV-Vis spectrophotometer | Hitachi High-Tech Science Corporation,Tokyo, Japan | U-2900 | |
| Violet LED | Long-hui Electronic Co., LTD, Dongguan, China |
References
- Jian, H. L., Cheng, C. W., Chen, L. Y., Liang, J. Y. The photochemistry of riboflavin. MC-Transaction on Biotechnology. 3, 1-11 (2011).
- Lin, Y., Eitenmiller, R. R., Landen, W. O. Riboflavin. Vitamin analysis for the health and food sciences. , 329-360 (2008).
- Xie, L. J., Wang, R. L., Wang, D., Liu, L., Cheng, L. Visible-light-mediated oxidative demethylation of N(6)-methyl adenines. Chemical Communications. 53 (77), 10734-10737 (2017).
- Tim, M. Strategies to optimize photosensitizers for photodynamic inactivation of bacteria. Journal of Photochemistry and Photobiology B: Biology. 150, 2-10 (2015).
- Maisch, T., et al. Photodynamic inactivation of multi-resistant bacteria (PIB) – a new approach to treat superficial infections in the 21st century. Journal of the German Society of Dermatology. 9 (5), 360-366 (2011).
- Hamblin, M. R. Antimicrobial photodynamic inactivation: a bright new technique to kill resistant microbes. Current Opinion in Microbiology. 33, 67-73 (2016).
- Del Rosso, J. Q. Oral Doxycycline in the management of acne vulgaris: Current perspectives on clinical use and recent findings with a new double-scored small tablet formulation. The Journal of Clinical and Aesthetic Dermatology. 8 (5), 19-26 (2015).
- Wong, T. W., et al. Photodynamic inactivation of methicillin-resistant Staphylococcus aureus by indocyanine green and near infrared light. Dematologica Sinica. 36 (1), 8-15 (2018).
- Yuann, J. M. P., et al. Effects of free radicals from doxycycline hyclate and minocycline hydrochloride under blue light irradiation on the deactivation of Staphylococcus aureus, including a methicillin-resistant strain. Journal of Photochemistry and Photobiology B: Biology. 226, 112370 (2022).
- Liang, J. Y., Cheng, C. W., Yu, C. H., Chen, L. Y. Investigations of blue light-induced reactive oxygen species from flavin mononucleotide on inactivation of E. coli. Journal of Photochemistry and Photobiology B: Biology. 143, 82-88 (2015).
- Yang, M. J., et al. Effects of blue-light-induced free radical formation from catechin hydrate on the inactivation of Acinetobacter baumannii, Including a carbapenem-resistant strain. Molecules. 23 (7), 1631 (2018).
- Yuann, J. M. P., et al. A study of catechin photostability using photolytic processing. Processes. 9 (2), 293 (2021).
- Yuann, J. M. P., Wang, J. S., Jian, H. L., Lin, C. C., Liang, J. Y. Effects of Clinacanthus nutans (Burm. f) Lindau leaf extracts on protection of plasmid DNA from riboflavin photoreaction. MC-Transaction on Biotechnology. 4 (1), 45-59 (2012).
- Rineh, A., et al. Attaching NorA efflux pump inhibitors to methylene blue enhances antimicrobial photodynamic inactivation of Escherichia coli and Acinetobacter baumannii in vitro and in vivo. Bioorganic and Medicinal Chemistry Letters. 28 (16), 2736-2740 (2018).
- Dai, T., et al. Photodynamic therapy for Acinetobacter baumannii burn infections in mice. Antimicrobial Agents and Chemotherapy. 53 (9), 3929-3934 (2009).
- Nitzan, Y., Ashkenazi, H. Photoinactivation of Acinetobacter baumannii and Escherichia coli B by a cationic hydrophilic porphyrin at various light wavelengths. Current Microbiology. 42 (6), 408-414 (2001).
- Tseng, C. C., et al. Altered susceptibility to the bactericidal effect of photocatalytic oxidation by TiO2 is related to colistin resistance development in Acinetobacter baumannii. Applied Microbiology and Biotechnology. 100 (19), 8549-8561 (2016).
- Boluki, E., et al. Antimicrobial activity of photodynamic therapy in combination with colistin against a pan-drug resistant Acinetobacter baumannii isolated from burn patient. Photodiagnosis and Photodynamic Therapy. 18, 1-5 (2017).
- Yang, M. Y., et al. Blue light irradiation triggers the antimicrobial potential of ZnO nanoparticles on drug-resistant Acinetobacter baumannii. Journal of Photochemistry and Photobiology B, Biology. 180, 235-242 (2018).
- . Code of Federal Regulations Available from: https://www.gpo.gov/fdsys/pkg/CFR-2009-title21-vol6/pdf/CFR-2009-title21-vol6-sec582-5695.pdf (2022)
- Lu, C. Y., et al. Generation and photosensitization properties of the oxidized radical of riboflavin: a laser flash photolysis study. Journal of Photochemistry and Photobiology B, Biology. 52 (1-3), 111-116 (1999).
- Sato, K., et al. The primary cytotoxicity in ultraviolet-a-irradiated riboflavin solution is derived from hydrogen peroxide. The Journal of Investigative Dermatology. 105 (4), 608-612 (1995).
- Tripathi, A. K., et al. Attenuated neuroprotective effect of riboflavin under UV-B irradiation via miR-203/c-Jun signaling pathway in vivo and in vitro. Journal of Biomedical Science. 21 (1), 39 (2014).
- Liang, J. Y., et al. Blue light induced free radicals from riboflavin on E. coli DNA damage. Journal of Photochemistry and Photobiology B, Biology. 119, 60-64 (2013).
- Ottaway, P. B. . The Technology of Vitamins in Food. , 233-244 (1993).
- Kumar, V., et al. Riboflavin and UV-light based pathogen reduction: extent and consequence of DNA damage at the molecular level. Photochemistry and Photobiology. 80 (1), 15-21 (2004).
- Ito, K., Inoue, S., Yamamoto, K., Kawanishi, S. 8-Hydroxydeoxyguanosine formation at the 5’site of 5′-GG-3’sequences in double-stranded DNA by UV radiation with riboflavin. Journal of Biological Chemistry. 268 (18), 13221-13227 (1993).
- Liang, J. Y., Yuann, J. M. P., Hsie, Z. J., Huang, S. T., Chen, C. C. Blue light induced free radicals from riboflavin in degradation of crystal violet by microbial viability evaluation. Journal of Photochemistry and Photobiology B, Biology. 174, 355-363 (2017).
- Yang, M. Y., Chang, C. J., Chen, L. Y. Blue light induced reactive oxygen species from flavin mononucleotide and flavin adenine dinucleotide on lethality of HeLa cells. Journal of Photochemistry and Photobiology B, Biology. 173, 325-332 (2017).
- Cui, Z., Huang, Y., Mo, Q., Wang, X., Qian, K. Inactivation of lymphocytes in blood products using riboflavin photochemical treatment with visible light. Photochemistry and Photobiology. 84 (5), 1195-1200 (2008).
- Wong, T. W., Cheng, C. W., Hsieh, Z. J., Liang, J. Y. Effects of blue or violet light on the inactivation of Staphylococcus aureus by riboflavin-5′-phosphate photolysis. Journal of Photochemistry and Photobiology B: Biology. 173, 672-680 (2017).
- Russell, L. F., Vanderslice, J. T. Comprehensive review of vitamin B2 analytical methodology. Journal of Micronutrient Analysis. 8, 257-310 (1990).
- Cheng, C. W., Chen, L. Y., Chou, C. W., Liang, J. Y. Investigations of riboflavin photolysis via coloured light in the nitro blue tetrazolium assay for superoxide dismutase activity. Journal of Photochemistry and Photobiology B: Biology. 148, 262-267 (2015).
- Huang, S. T., et al. Effects of 462 nm light-emitting diode on the inactivation of Escherichia coli and a multidrug-resistant by tetracycline photoreaction. Journal of Clinical Medicine. 7 (9), 278 (2018).
- Barua, M. G., Escalada, J. P., Bregliani, M., Pajares, A., Criado, S. Antioxidant capacity of (+)-catechin visible-light photoirradiated in the presence of vitamin B2. Redox Report: Communications in Free Radical Research. 22 (6), 282-289 (2017).
- Castillo, C., Criado, S., Díaz, M., García, N. A. Riboflavin as a sensitiser in the photodegradation of tetracyclines. Kinetics, mechanism and microbiological implications. Dyes and Pigments. 72 (2), 178-184 (2007).
- Huvaere, K., Sinnaeve, B., Van Bocxlaer, J., Skibsted, L. H. Flavonoid deactivation of excited state flavins: reaction monitoring by mass spectrometry. Journal of Agricultural and Food Chemistry. 60 (36), 9261-9272 (2012).
- Massad, W. A., Bertolotti, S., Garcia, N. A. Kinetics and mechanism of the vitamin B2-sensitized photooxidation of isoproterenol. Photochemistry and Photobiology. 79 (5), 428-433 (2004).
- Maclean, M., MacGregor, S. J., Anderson, J. G., Woolsey, G. High-intensity narrow-spectrum light inactivation and wavelength sensitivity of Staphylococcus aureus. FEMS Microbiology Letters. 285 (2), 227-232 (2008).
- Huang, S. T., et al. The influence of the degradation of tetracycline by free radicals from riboflavin-5′-phosphate photolysis on microbial viability. Microorganisms. 7 (11), 500 (2019).
- Maisch, T., et al. Fast and effective photodynamic inactivation of multiresistant bacteria by cationic riboflavin derivatives. PLoS One. 9 (12), 111792 (2014).
- Grijzenhout, M., et al. Ultraviolet-B irradiation of platelets induces a dose-dependent increase in the expression of platelet activation markers with storage. British Journal of Haematology. 83 (4), 627-632 (1993).

