Inactivación de patógenos mediante fotólisis con luz visible de riboflavina-5′-fosfato
Summary
Aquí, presentamos un protocolo para inactivar bacterias patógenas con especies reactivas de oxígeno producidas durante la fotólisis del mononucleótido de flavina (FMN) bajo irradiación de luz azul y violeta de baja intensidad. Se ha demostrado que la fotólisis FMN es un método simple y seguro para procesos sanitarios.
Abstract
Riboflavina-5′-fosfato (o mononucleótido de flavina; FMN) es sensible a la luz visible. Se pueden generar varios compuestos, incluidas las especies reactivas de oxígeno (ROS), a partir de la fotólisis FMN tras la irradiación con luz visible. Las ROS generadas a partir de la fotólisis FMN son perjudiciales para los microorganismos, incluidas las bacterias patógenas como Staphylococcus aureus (S. aureus). Este artículo presenta un protocolo para desactivar S. aureus, como ejemplo, a través de reacciones fotoquímicas que involucran FMN bajo irradiación de luz visible. El anión radical superóxido () generado durante la fotólisis FMN se evalúa mediante la reducción de nitro azul tetrazolio (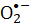 NBT). La viabilidad microbiana de S. aureus que se atribuye a especies reactivas
NBT). La viabilidad microbiana de S. aureus que se atribuye a especies reactivas 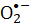 se utilizó para determinar la efectividad del proceso. La tasa de inactivación bacteriana es proporcional a la concentración de FMN. La luz violeta es más eficiente para inactivar S. aureus que la irradiación de luz azul, mientras que la luz roja o verde no impulsa la fotólisis FMN. El presente artículo demuestra la fotólisis FMN como un método simple y seguro para procesos sanitarios.
se utilizó para determinar la efectividad del proceso. La tasa de inactivación bacteriana es proporcional a la concentración de FMN. La luz violeta es más eficiente para inactivar S. aureus que la irradiación de luz azul, mientras que la luz roja o verde no impulsa la fotólisis FMN. El presente artículo demuestra la fotólisis FMN como un método simple y seguro para procesos sanitarios.
Introduction
La riboflavina-5′-fosfato (FMN) se forma por fosforilación en la posición de riboflavina 5′ de la cadena lateral ribitil y es requerida por todas las flavoproteínas para numerosos procesos celulares para generar energía. También desempeña el papel de vitamina para algunas funciones en el cuerpo humano1. FMN es aproximadamente 200 veces más soluble en agua que la riboflavina2.
La inactivación fotodinámica antibacteriana (aPDI) de las bacterias es una forma eficiente de controlar la resistencia a las bacterias 3,4 porque no depende del modo de resistencia bacteriana. Clínicamente, aPDI se utiliza para tratar infecciones de tejidos blandos con el fin de disminuir la infección de la piel nosocomial debido a bacterias multirresistentes 5,6,7,8,9. aPDI también produce muerte celular mediante la generación de especies reactivas de oxígeno (ROS). Las ROS, como los radicales superóxido (), el oxígeno singlete, los radicales hidroxilo ( •OH) y los radicales peroxilo, son radicales libres o moléculas que contienen oxígeno reactivo 10,11,12 y normalmente son reactivas 13. Al igual que el daño del ADN causado por ROS, la peroxidación de la membrana y la destrucción de las células endoteliales también son reacciones bioquímicas adversas que se atribuyen a ROS en las células12.
•OH) y los radicales peroxilo, son radicales libres o moléculas que contienen oxígeno reactivo 10,11,12 y normalmente son reactivas 13. Al igual que el daño del ADN causado por ROS, la peroxidación de la membrana y la destrucción de las células endoteliales también son reacciones bioquímicas adversas que se atribuyen a ROS en las células12.
El uso de aPDI para bacterias patógenas implica una fuente de luz visible o UV para inactivar microorganismos en presencia de compuestos químicos, como cloruro de metiltioninio 14, PEI-ce6 conjugado 15, porfirina 16, dióxido de titanio17, azul de toluidina O 18 y nanopartículas de óxido de zinc 19. El azul de toluidina O y el azul de metileno son colorantes de fenotiazinio y el azul de metileno tiene propiedades tóxicas. Las nanopartículas de óxido de zinc y la irradiación UV están relacionadas con efectos adversos para la salud y el medio ambiente. Como tal, la explotación de un fotosensibilizador confiable, seguro y simple a través de fotólisis bajo irradiación visible merece un estudio más profundo.
El micronutriente, riboflavina o FMN, no es tóxico y de hecho se utiliza para la fabricación de alimentos o la alimentación20. Tanto la FMN como la riboflavina son altamente sensibles a la irradiación lumínica2. Bajo UV 1,2,21,22,23 e irradiación de luz azul10,24, estos dos compuestos alcanzan un estado excitado. La riboflavina activada o FMN que se produce por fotólisis es promovida a su estado triplete y se generan ROS simultáneamente 2,25. Kumar et al. informaron que la riboflavina activada por la luz UV selectivamente causa un aumento de la lesión a la fracción guanina del ADN en microorganismos patógenos26. Bajo irradiación por luz UV, se ha demostrado que la riboflavina activada fotodinámicamente promueve la generación de 8-OH-dG, que es un biomarcador para el estrés oxidativo, en el ADN bicatenario27. Se reporta que S. aureus y E. coli son desactivadas por ROS durante la fotólisis de riboflavina o FMN 10,24,28. Un estudio previo realizado por los autores mostró que las reacciones fotolíticas que involucran riboflavina y FMN reducen el cristal violeta, un colorante triarilmetano y un agente antibacteriano que genera , y eliminan la mayor parte de la capacidad antimicrobiana del cristal violeta28. Cuando el dinucleótido de flavina adenina o FMN es irradiado por luz azul, los ROS resultantes producen apoptosis en las células HeLa para su envenenamiento in vitro29. Utilizando tratamiento fotoquímico en presencia de riboflavina, Cui et al. inactivaron linfocitos inhibiendo su proliferación y producción de citoquinas30.
, y eliminan la mayor parte de la capacidad antimicrobiana del cristal violeta28. Cuando el dinucleótido de flavina adenina o FMN es irradiado por luz azul, los ROS resultantes producen apoptosis en las células HeLa para su envenenamiento in vitro29. Utilizando tratamiento fotoquímico en presencia de riboflavina, Cui et al. inactivaron linfocitos inhibiendo su proliferación y producción de citoquinas30.
La fotólisis de la riboflavina se utiliza para la inactivación del patógeno sanguíneo por UV 10,24, pero los componentes sanguíneos pueden verse afectados bajo la irradiación de luz UV30. También se informa que las plaquetas expuestas a UV mejoran progresivamente el rendimiento de los marcadores de activación P-selectina y LIMP-CD63 en sus membranas. Es necesario investigar la citotoxicidad de la radiación UV y de alta intensidad y sería de gran utilidad un fotosensibilizador que no sea complicado y seguro durante una fotorreacción FMN que involucre luz visible.
La luz de longitudes de onda más cortas tiene más energía y es mucho más probable que cause daños graves a las células. Sin embargo, en presencia de un fotosensibilizador adecuado, la irradiación con luz violeta de baja intensidad puede inhibir los microorganismos patógenos. Por lo tanto, es importante estudiar la fotosensibilización y la generación de FMN cuando se irradia con luz violeta, para determinar la vía por la cual las ROS de la fotólisis de FMN aumentan la inactivación de  las bacterias.
las bacterias.
El control antimicrobiano es un problema común y el desarrollo de nuevos antibióticos con frecuencia lleva décadas. Después de la irradiación con luz violeta, la fotoinactivación intermediada por FMN puede aniquilar bacterias patógenas ambientales. Este estudio presenta un protocolo antimicrobiano efectivo in vitro utilizando luz violeta para conducir la fotólisis FMN y así generar  para aPDI. La viabilidad microbiana de S. aureus se utiliza para determinar la viabilidad de la aPDI inducida por FMN.
para aPDI. La viabilidad microbiana de S. aureus se utiliza para determinar la viabilidad de la aPDI inducida por FMN.
Protocol
Representative Results
Discussion
Un fotosensibilizador aumenta la reacción fotoquímica de los compuestos químicos para generar ROS. Los microorganismos patógenos pueden ser inactivados por irradiación de luz en presencia de fotosensibilizadores. Este estudio determina la aPDI de S. aureus debido a ROS generadas por irradiación de luz violeta de un fotosensibilizador exógeno, FMN.
Como se muestra en la Figura 3, para FMN, la absorbancia a 444 nm se reduce significativamente despué…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Los autores agradecen al Dr. Tak-Wah Wong y al Sr. Zong-Jhe Hsieh por su apoyo con los experimentos.
Materials
| Blue, green and red LED lights | Vita LED Technologies Co., Tainan, Taiwan | DC 12 V 5050 | |
| Dimethyl Sulfoxide | Sigma-Aldrich, St. Louis, MO | 190186 | |
| Infrared thermometer | Raytek Co. Santa Cruz, CA | MT4 | |
| LB broth | Difco Co., NJ | ||
| L-Methionine | Sigma-Aldrich, St. Louis, MO | 1.05707 | |
| NBT | Bio Basic, Inc. Markham, Ontario, Canada | ||
| Power supply | China tech Co., New Taipei City, Taiwan | YP30-3-2 | |
| Riboflavin 5′-phosphate | Sigma-Aldrich, St. Louis, MO | R7774 | |
| RNase | New England BioLabs, Inc. Ipswich, MA | ||
| Solar power meter | Tenmars Electronics Co., Taipei, Taiwan | TM-207 | |
| Staphylococcus aureus subsp. aureus | Bioresource Collection and Research Center (BCRC), Hsinchu, Taiwan | 10451 | |
| UV-Vis optical spectrometer | Ocean Optics, Dunedin, FL | USB4000 | |
| UV-Vis spectrophotometer | Hitachi High-Tech Science Corporation,Tokyo, Japan | U-2900 | |
| Violet LED | Long-hui Electronic Co., LTD, Dongguan, China |
References
- Jian, H. L., Cheng, C. W., Chen, L. Y., Liang, J. Y. The photochemistry of riboflavin. MC-Transaction on Biotechnology. 3, 1-11 (2011).
- Lin, Y., Eitenmiller, R. R., Landen, W. O. Riboflavin. Vitamin analysis for the health and food sciences. , 329-360 (2008).
- Xie, L. J., Wang, R. L., Wang, D., Liu, L., Cheng, L. Visible-light-mediated oxidative demethylation of N(6)-methyl adenines. Chemical Communications. 53 (77), 10734-10737 (2017).
- Tim, M. Strategies to optimize photosensitizers for photodynamic inactivation of bacteria. Journal of Photochemistry and Photobiology B: Biology. 150, 2-10 (2015).
- Maisch, T., et al. Photodynamic inactivation of multi-resistant bacteria (PIB) – a new approach to treat superficial infections in the 21st century. Journal of the German Society of Dermatology. 9 (5), 360-366 (2011).
- Hamblin, M. R. Antimicrobial photodynamic inactivation: a bright new technique to kill resistant microbes. Current Opinion in Microbiology. 33, 67-73 (2016).
- Del Rosso, J. Q. Oral Doxycycline in the management of acne vulgaris: Current perspectives on clinical use and recent findings with a new double-scored small tablet formulation. The Journal of Clinical and Aesthetic Dermatology. 8 (5), 19-26 (2015).
- Wong, T. W., et al. Photodynamic inactivation of methicillin-resistant Staphylococcus aureus by indocyanine green and near infrared light. Dematologica Sinica. 36 (1), 8-15 (2018).
- Yuann, J. M. P., et al. Effects of free radicals from doxycycline hyclate and minocycline hydrochloride under blue light irradiation on the deactivation of Staphylococcus aureus, including a methicillin-resistant strain. Journal of Photochemistry and Photobiology B: Biology. 226, 112370 (2022).
- Liang, J. Y., Cheng, C. W., Yu, C. H., Chen, L. Y. Investigations of blue light-induced reactive oxygen species from flavin mononucleotide on inactivation of E. coli. Journal of Photochemistry and Photobiology B: Biology. 143, 82-88 (2015).
- Yang, M. J., et al. Effects of blue-light-induced free radical formation from catechin hydrate on the inactivation of Acinetobacter baumannii, Including a carbapenem-resistant strain. Molecules. 23 (7), 1631 (2018).
- Yuann, J. M. P., et al. A study of catechin photostability using photolytic processing. Processes. 9 (2), 293 (2021).
- Yuann, J. M. P., Wang, J. S., Jian, H. L., Lin, C. C., Liang, J. Y. Effects of Clinacanthus nutans (Burm. f) Lindau leaf extracts on protection of plasmid DNA from riboflavin photoreaction. MC-Transaction on Biotechnology. 4 (1), 45-59 (2012).
- Rineh, A., et al. Attaching NorA efflux pump inhibitors to methylene blue enhances antimicrobial photodynamic inactivation of Escherichia coli and Acinetobacter baumannii in vitro and in vivo. Bioorganic and Medicinal Chemistry Letters. 28 (16), 2736-2740 (2018).
- Dai, T., et al. Photodynamic therapy for Acinetobacter baumannii burn infections in mice. Antimicrobial Agents and Chemotherapy. 53 (9), 3929-3934 (2009).
- Nitzan, Y., Ashkenazi, H. Photoinactivation of Acinetobacter baumannii and Escherichia coli B by a cationic hydrophilic porphyrin at various light wavelengths. Current Microbiology. 42 (6), 408-414 (2001).
- Tseng, C. C., et al. Altered susceptibility to the bactericidal effect of photocatalytic oxidation by TiO2 is related to colistin resistance development in Acinetobacter baumannii. Applied Microbiology and Biotechnology. 100 (19), 8549-8561 (2016).
- Boluki, E., et al. Antimicrobial activity of photodynamic therapy in combination with colistin against a pan-drug resistant Acinetobacter baumannii isolated from burn patient. Photodiagnosis and Photodynamic Therapy. 18, 1-5 (2017).
- Yang, M. Y., et al. Blue light irradiation triggers the antimicrobial potential of ZnO nanoparticles on drug-resistant Acinetobacter baumannii. Journal of Photochemistry and Photobiology B, Biology. 180, 235-242 (2018).
- . Code of Federal Regulations Available from: https://www.gpo.gov/fdsys/pkg/CFR-2009-title21-vol6/pdf/CFR-2009-title21-vol6-sec582-5695.pdf (2022)
- Lu, C. Y., et al. Generation and photosensitization properties of the oxidized radical of riboflavin: a laser flash photolysis study. Journal of Photochemistry and Photobiology B, Biology. 52 (1-3), 111-116 (1999).
- Sato, K., et al. The primary cytotoxicity in ultraviolet-a-irradiated riboflavin solution is derived from hydrogen peroxide. The Journal of Investigative Dermatology. 105 (4), 608-612 (1995).
- Tripathi, A. K., et al. Attenuated neuroprotective effect of riboflavin under UV-B irradiation via miR-203/c-Jun signaling pathway in vivo and in vitro. Journal of Biomedical Science. 21 (1), 39 (2014).
- Liang, J. Y., et al. Blue light induced free radicals from riboflavin on E. coli DNA damage. Journal of Photochemistry and Photobiology B, Biology. 119, 60-64 (2013).
- Ottaway, P. B. . The Technology of Vitamins in Food. , 233-244 (1993).
- Kumar, V., et al. Riboflavin and UV-light based pathogen reduction: extent and consequence of DNA damage at the molecular level. Photochemistry and Photobiology. 80 (1), 15-21 (2004).
- Ito, K., Inoue, S., Yamamoto, K., Kawanishi, S. 8-Hydroxydeoxyguanosine formation at the 5’site of 5′-GG-3’sequences in double-stranded DNA by UV radiation with riboflavin. Journal of Biological Chemistry. 268 (18), 13221-13227 (1993).
- Liang, J. Y., Yuann, J. M. P., Hsie, Z. J., Huang, S. T., Chen, C. C. Blue light induced free radicals from riboflavin in degradation of crystal violet by microbial viability evaluation. Journal of Photochemistry and Photobiology B, Biology. 174, 355-363 (2017).
- Yang, M. Y., Chang, C. J., Chen, L. Y. Blue light induced reactive oxygen species from flavin mononucleotide and flavin adenine dinucleotide on lethality of HeLa cells. Journal of Photochemistry and Photobiology B, Biology. 173, 325-332 (2017).
- Cui, Z., Huang, Y., Mo, Q., Wang, X., Qian, K. Inactivation of lymphocytes in blood products using riboflavin photochemical treatment with visible light. Photochemistry and Photobiology. 84 (5), 1195-1200 (2008).
- Wong, T. W., Cheng, C. W., Hsieh, Z. J., Liang, J. Y. Effects of blue or violet light on the inactivation of Staphylococcus aureus by riboflavin-5′-phosphate photolysis. Journal of Photochemistry and Photobiology B: Biology. 173, 672-680 (2017).
- Russell, L. F., Vanderslice, J. T. Comprehensive review of vitamin B2 analytical methodology. Journal of Micronutrient Analysis. 8, 257-310 (1990).
- Cheng, C. W., Chen, L. Y., Chou, C. W., Liang, J. Y. Investigations of riboflavin photolysis via coloured light in the nitro blue tetrazolium assay for superoxide dismutase activity. Journal of Photochemistry and Photobiology B: Biology. 148, 262-267 (2015).
- Huang, S. T., et al. Effects of 462 nm light-emitting diode on the inactivation of Escherichia coli and a multidrug-resistant by tetracycline photoreaction. Journal of Clinical Medicine. 7 (9), 278 (2018).
- Barua, M. G., Escalada, J. P., Bregliani, M., Pajares, A., Criado, S. Antioxidant capacity of (+)-catechin visible-light photoirradiated in the presence of vitamin B2. Redox Report: Communications in Free Radical Research. 22 (6), 282-289 (2017).
- Castillo, C., Criado, S., Díaz, M., García, N. A. Riboflavin as a sensitiser in the photodegradation of tetracyclines. Kinetics, mechanism and microbiological implications. Dyes and Pigments. 72 (2), 178-184 (2007).
- Huvaere, K., Sinnaeve, B., Van Bocxlaer, J., Skibsted, L. H. Flavonoid deactivation of excited state flavins: reaction monitoring by mass spectrometry. Journal of Agricultural and Food Chemistry. 60 (36), 9261-9272 (2012).
- Massad, W. A., Bertolotti, S., Garcia, N. A. Kinetics and mechanism of the vitamin B2-sensitized photooxidation of isoproterenol. Photochemistry and Photobiology. 79 (5), 428-433 (2004).
- Maclean, M., MacGregor, S. J., Anderson, J. G., Woolsey, G. High-intensity narrow-spectrum light inactivation and wavelength sensitivity of Staphylococcus aureus. FEMS Microbiology Letters. 285 (2), 227-232 (2008).
- Huang, S. T., et al. The influence of the degradation of tetracycline by free radicals from riboflavin-5′-phosphate photolysis on microbial viability. Microorganisms. 7 (11), 500 (2019).
- Maisch, T., et al. Fast and effective photodynamic inactivation of multiresistant bacteria by cationic riboflavin derivatives. PLoS One. 9 (12), 111792 (2014).
- Grijzenhout, M., et al. Ultraviolet-B irradiation of platelets induces a dose-dependent increase in the expression of platelet activation markers with storage. British Journal of Haematology. 83 (4), 627-632 (1993).

