L’Evoked Potential Operant Conditioning System (EPOCS) : un outil de recherche et une thérapie émergente pour les maladies neuromusculaires chroniques
Summary
Le système de conditionnement opérant potentiel évoqué facilite l’investigation scientifique de la fonction sensorimotrice et peut administrer un entraînement neurocomportemental ciblé qui peut avoir un impact sur la réadaptation sensorimotrice dans les troubles neuromusculaires. Cet article décrit ses capacités et illustre son application dans la modification d’un simple réflexe rachidien pour obtenir une amélioration durable de la fonction motrice.
Abstract
L’Evoked Potential Operant Conditioning System (EPOCS) est un outil logiciel qui met en œuvre des protocoles pour conditionner de manière opérante les réponses musculaires déclenchées par un stimulus chez les personnes atteintes de troubles neuromusculaires, ce qui peut à son tour améliorer la fonction sensorimotrice lorsqu’il est appliqué de manière appropriée. EPOCS surveille l’état de muscles cibles spécifiques – par exemple, à partir de l’électromyographie de surface (EMG) en position debout ou des mesures du cycle de marche en marchant sur un tapis roulant – et déclenche automatiquement une stimulation calibrée lorsque des conditions prédéfinies sont remplies. Il fournit deux formes de rétroaction qui permettent à une personne d’apprendre à moduler l’excitabilité de la voie ciblée. Tout d’abord, il surveille en permanence l’activité EMG en cours dans le muscle cible, guidant la personne pour produire un niveau constant d’activité adapté au conditionnement. Deuxièmement, il fournit une rétroaction immédiate de la taille de la réponse après chaque stimulation et indique si elle a atteint la valeur cible.
Pour illustrer son utilisation, cet article décrit un protocole par lequel une personne peut apprendre à diminuer la taille du réflexe d’Hoffmann – l’analogue électriquement provoqué du réflexe d’étirement de la colonne vertébrale – dans le muscle soléaire. Le conditionnement de l’excitabilité de cette voie peut améliorer la marche chez les personnes ayant une démarche spastique en raison d’une lésion incomplète de la moelle épinière. L’article montre comment configurer l’équipement; comment placer des électrodes stimulantes et d’enregistrement; et comment utiliser le logiciel libre pour optimiser le placement des électrodes, mesurer la courbe de recrutement des réponses motrices et réflexes directes, mesurer la réponse sans conditionnement opérant, conditionner le réflexe et analyser les données résultantes. Il illustre comment le réflexe change au fil des séances multiples et comment la marche s’améliore. Il traite également de la façon dont le système peut être appliqué à d’autres types de réponses évoquées et à d’autres types de stimulation, par exemple, les potentiels évoqués moteurs à la stimulation magnétique transcrânienne; comment il peut traiter divers problèmes cliniques; et comment il peut soutenir les études de recherche sur la fonction sensorimotrice dans la santé et la maladie.
Introduction
Au cours de la dernière décennie, des stratégies ciblées de neuroplasticité ont émergé comme une nouvelle approche pour la réhabilitation des déficiences neurologiques 1,2. L’une de ces stratégies est le conditionnement opérant d’un potentiel évoqué. Cela implique de provoquer à plusieurs reprises des réponses électrophysiologiques qui peuvent être mesurées de manière non invasive – par exemple, par électroencéphalographie (EEG) ou électromyographie de surface (EMG) – et de donner à la personne une rétroaction immédiate sur la taille de chaque réponse par rapport à un niveau de critère fixé par le thérapeute ou l’investigateur. Au fil du temps, ce protocole entraîne la personne à augmenter ou à diminuer sa réponse et peut, par conséquent, cibler un changement bénéfique sur un site du système nerveux central qui est important dans un comportement tel que la locomotion ou la portée. Le changement ciblé améliore la performance et, en outre, permet une meilleure pratique qui conduit à un changement bénéfique généralisé qui améliore l’ensemble du comportement. Par exemple, chez les personnes atteintes d’une lésion médullaire incomplète (SICi) chez qui le clonus altère la locomotion, le conditionnement opérant qui réduit le réflexe de Hoffmann dans le muscle soléaire d’une jambe améliore l’activité musculaire locomotrice dans les deux jambes, augmentant ainsi la vitesse de marche et rétablissant la symétrie de pas droit / gauche 1,3,4,5 . Un autre exemple est celui de la stimulation par impulsions appariées, qui peut augmenter durablement la taille du potentiel évoqué moteur (MEP) à la stimulation magnétique transcrânienne, améliorant ainsi la fonction de portée et de préhension chez les personnes atteintes d’une déficience chronique des mains et des bras après iSCI6.
La mise en œuvre de tels protocoles nécessite un logiciel spécial qui doit exécuter plusieurs fonctions. Plus précisément, il doit continuellement acquérir, traiter et enregistrer des signaux électrophysiologiques; il doit surveiller en permanence l’état du système nerveux et déclencher une stimulation appropriée dans des contraintes strictes en temps réel; il doit fournir une rétroaction continue moment par moment, une rétroaction essai par essai et une rétroaction session par session; il doit fournir une interface utilisateur pour guider la configuration et le réglage par l’investigateur ou le thérapeute; et, enfin, il doit stocker et organiser les données de signal et les méta-informations dans un format normalisé.
Le système de conditionnement opérant potentiel évoqué (EPOCS) est notre réponse à ce besoin exceptionnel. Sous le capot, le logiciel est basé sur BCI2000, une plate-forme neurotechnologique open source utilisée dans des centaines de laboratoires à travers le monde 7,8. Dans EPOCS, l’interface utilisateur habituelle de BCI2000 est masquée et remplacée par une interface simplifiée optimisée pour les protocoles de conditionnement opérationnels potentiels évoqués.
Le présent article et la vidéo qui l’accompagne illustrent l’utilisation d’EPOCS dans un protocole particulier: le conditionnement opérant pour réduire la taille du réflexe de Hoffmann (H-) dans le muscle soléaire. Cette réponse est l’analogue électriquement provoqué du réflexe d’étirement instinctif. Il a été démontré que le conditionnement du réflexe H réduit l’impact du clonus sur, et améliore ainsi, la locomotion chez les animaux atteints d’iSCI 9,10,11,12,13 et chez les humains atteints d’iSIC, de sclérose en plaques ou d’accident vasculaire cérébral 5,14,15. Il peut être appliqué sans effets secondaires indésirables chez les animaux et les personnes avec ou sans lésion neurologique16,17.
Le protocole de conditionnement opérant fonctionne en effectuant plusieurs essais, chacun d’une durée de plusieurs secondes. La séquence des événements d’un essai est représentée schématiquement à la figure 1, avec des nombres désignant les fonctions suivantes :
1. L’EMG de fond continu est enregistré à partir d’électrodes de surface bipolaires sur le muscle cible (soléaire) et son antagoniste (tibial antérieur). Le niveau de fond est évalué comme la valeur moyenne rectifiée du signal filtré passe-haut dans une fenêtre coulissante.
2. Le niveau EMG de fond dans le muscle cible est affiché comme la hauteur d’une barre, continuellement mise à jour sur l’écran du participant. Cela aide le participant à maintenir l’activité dans une plage spécifiée (région hachurée).
3. Le logiciel juge le moment approprié pour la stimulation électrique et déclenche le stimulateur en conséquence. Les critères principaux sont qu’au moins 5 s doivent s’être écoulés depuis la stimulation précédente et que le niveau EMG de fond doit être resté dans la plage spécifiée de manière continue pendant 2 s.
4. Un stimulateur à courant constant délivre une impulsion électrique transcutanée au nerf tibial (généralement monophasique, avec une durée de 1 ms).
5. La réponse bloquée par stimulus qui en résulte est enregistrée. Le logiciel calcule la taille de deux composants particulièrement intéressants: l’onde M antérieure, qui reflète l’activation musculaire résultant de la stimulation directe de l’axone moteur; et le réflexe H ultérieur, qui reflète le signal relayé par un arc réflexe dans la moelle épinière 18,19,20,21,22. EPOCS les désigne comme la réponse de référence et la réponse cible, respectivement.
6. La taille du réflexe H pour l’essai en cours est affichée comme la hauteur d’une deuxième barre, par rapport à un niveau de critère souhaité qui définit un essai réussi ou infructueux. Pour le down-conditioning, la barre est vert foncé si la taille H-reflex est inférieure au critère, ou rouge vif si elle ne l’a pas fait (vice versa pour le conditionnement ascendant). Simultanément, l’affichage numérique du taux de réussite cumulé est mis à jour en conséquence. Ensemble, ces éléments d’affichage graphique fournissent le renforcement positif ou négatif immédiat sur lequel repose le conditionnement opérant23.
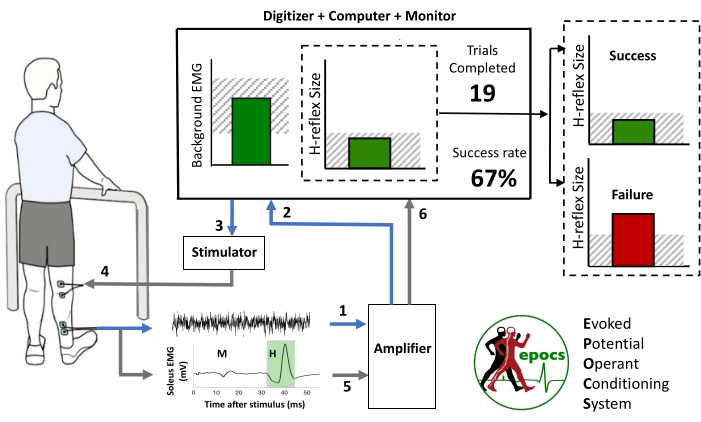
Figure 1 : Illustration schématique de la fonctionnalité de base d’EPOCS lors du conditionnement négatif du réflexe H du soléaire. Le participant voit un grand écran de moniteur qui montre le niveau EMG de fond, la taille H-reflex la plus récente, le nombre d’essais terminés jusqu’à présent dans la course actuelle de 75 et la proportion d’essais réussis pour la course. La séquence des événements dans un essai est indiquée par les chiffres 1 à 6, comme décrit dans l’introduction. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Un protocole de conditionnement H-reflex humain se compose généralement de 6 séances de base, suivies de 24 à 30 séances de conditionnement réparties sur 10 semaines à raison de 3 séances / semaine, et de plusieurs séances de suivi au cours des 3 à 6 mois suivants14,16. Chaque séance dure 60-90 min.
Pour prendre en charge ce protocole ainsi que d’autres protocoles connexes, EPOCS dispose de cinq modes de fonctionnement distincts, chacun servi par l’un des onglets de sa fenêtre principale, intitulé Test de stimulus, Contraction volontaire, Courbe de recrutement, Essais de contrôle et Essais de formation.
En mode Test de stimulation, le logiciel déclenche un stimulus toutes les quelques secondes, pas nécessairement en fonction de l’état du muscle cible. Les signaux de réponse sont affichés à l’écran après chaque stimulus. Cela permet à l’opérateur de vérifier la qualité des connexions d’électrodes et du signal EMG; optimiser la position des électrodes de stimulation et d’enregistrement; et d’établir la morphologie de la réponse de l’individu.
En mode Contraction volontaire, le logiciel mesure et affiche le niveau d’EMG de fond tandis que le participant est encouragé à contracter le muscle autant que possible, en l’absence de stimulation électrique. Dans certains protocoles, le niveau EMG à la contraction volontaire maximale (MVC) est une référence utile pour définir les critères EMG de base. Dans le protocole démontré ici, cela n’est pas nécessaire, car une posture debout stable standardise suffisamment l’activité du muscle soléaire.
En mode Courbe de recrutement, la stimulation dépend du niveau EMG de fond (affiché en continu à l’écran) restant dans la bonne plage ; les signaux de réponse sont affichés à l’écran après chaque stimulus; et la séquence des réponses peut être analysée à la fin d’une course. Cela permet à l’opérateur de déterminer le début et la fin des intervalles de temps dans lesquels les réponses d’intérêt apparaissent; déterminer la relation entre l’intensité de la stimulation et la taille de la réponse, avant et après les cycles de conditionnement; et de déterminer l’intensité de stimulation à utiliser pour le conditionnement.
En mode Essais témoins, la stimulation dépend du niveau EMG de fond (affiché en continu à l’écran), mais aucun retour n’est donné sur la taille de réponse cible. La séquence et la distribution des tailles de réponse peuvent être analysées. Ce mode peut être utilisé pour recueillir des mesures de base de l’ampleur de la réponse, ou comme condition de contrôle pour la comparaison avec le conditionnement opérant dans un plan expérimental croisé ou entre sujets. Il peut servir de base à la définition du critère de performance pour le conditionnement opérant au début de chaque session.
Enfin, en mode Essais d’entraînement, la stimulation dépend du niveau EMG de fond (affiché en continu à l’écran), et le renforcement essai par essai est également fourni en montrant la taille de réponse cible, comme décrit ci-dessus et illustré à la figure 1. C’est le mode dans lequel le conditionnement opérant est effectué.
La section suivante guidera le lecteur à travers les cinq modes en démontrant le protocole de conditionnement négatif du réflexe H soléaire chez un participant adulte sans lésion neurologique.
Protocol
Representative Results
Discussion
Le protocole décrit ci-dessus convient pour démontrer le conditionnement du réflexe H soléaire chez un adulte typique sans déficience neurologique. Les valeurs précises des paramètres peuvent varier d’une personne à l’autre et en particulier en fonction de la déficience. Alors que la courbe de recrutement du participant a atteint Mmax à un courant stimulant d’environ 25 mA dans la vidéo, une autre personne pourrait avoir besoin de 50 mA ou plus, de sorte que le courant serait augmenté par étapes plus importantes lors de la mesure de la courbe de recrutement. Ils peuvent également nécessiter une durée d’impulsion plus longue. Une troisième personne peut être plus sensible et nécessiter des réglages de courant plus petits. Le protocole doit également être adapté en fonction du muscle conditionné. Par exemple, lorsque l’on cible le muscle fléchisseur carpi radialis24,25, un réglage de courant plus faible est généralement utilisé; le mode de contraction volontaire devrait être utilisé pour établir une échelle pour les limites de l’EMG de fond; Et une plus grande prudence doit être prise à la fois lors de l’optimisation du placement des électrodes et lors de l’optimisation de la posture, qui doit ensuite être maintenue constante tout au long des essais.
Le protocole est sensible aux variations de la relation entre le réglage du courant du stimulateur et la quantité de courant réellement délivrée au nerf – cela peut être affecté par de petites variations de posture, l’hydratation du participant et le dessèchement du gel d’électrode adhésive. Dans le conditionnement H-reflex, ce problème peut être atténué en utilisant la taille de l’onde M comme indicateur de l’intensité de stimulation efficace. Il reflète le nombre d’axones efférents du motoneurone soléaire excités par le stimulus. Ainsi, si la taille de l’onde M est maintenue constante, cela implique que le nombre d’axones afférents primaires excités par le stimulus, c’est-à-dire les axones qui provoquent le réflexe H, est également maintenu constant (voir aussi Crone et al.26). Par conséquent, cette onde M est appelée réponse de référence dans le logiciel. Pour cette raison, l’étape 4.5.12. mentionne que la taille cible de l’onde M doit être enregistrée. Il est en fait plus important de garder cette taille de réponse à peu près constante que de maintenir le courant nominal strictement constant. L’onglet Séquence de la fenêtre d’analyse permet de vérifier rétrospectivement la constance de l’onde M à chaque exécution ; pour le conditionnement réflexe H soléaire, cela suffit souvent à corriger les problèmes. Pour un meilleur contrôle, un deuxième moniteur peut être connecté à l’ordinateur pour afficher des analyses d’ondes M en temps réel qui guident le réglage manuel essai par essai. L’automatisation de cette tâche de contrôle est un projet en cours27.
La variation diurne peut également affecter les réponses électrophysiologiques d’une personne 28,29,30,31. Pour cette raison, il est recommandé que toutes les séances soient effectuées au même moment de la journée, c’est-à-dire dans la même fenêtre de temps de 3 heures.
Le succès du conditionnement opérant peut être sensible à la précision de l’intervalle de temps choisi par l’opérateur pour définir le réflexe H ; En particulier, l’intervalle ne doit pas être trop large. Les directives détaillées pour une définition correcte de l’intervalle dépassent le cadre de l’article actuel. Il s’agit également d’une fonction qui sera automatisée dans les futures versions du logiciel.
Une étape critique du protocole est l’étape 4.5.6., dans laquelle l’opérateur augmente manuellement le courant du stimulateur à plusieurs reprises après chaque nombre fixe d’essais. Un mauvais comptage des essais ici ou un mauvais ajustement du cadran actuel peut entraîner une distorsion de la courbe de recrutement qui en résulte. Cette possibilité d’erreur de l’utilisateur peut être atténuée en activant l’option Digitimer Link, qui permet d’automatiser le réglage actuel pour un modèle de stimulateur particulier.
Cet article s’est concentré sur le conditionnement H-reflex, car il s’agit de la plus développée des applications cliniques potentielles d’EPOCS. Le logiciel existant aide les chercheurs dans leurs efforts continus pour affiner ce protocole en vue d’une large diffusion clinique32. Au-delà du conditionnement H-reflex, EPOCS peut également être appliqué sous sa forme actuelle à une plus grande variété de méthodes de stimulation et de réponses évoquées. Par exemple, il peut tout aussi bien déclencher un dispositif mécanique qui provoque un réflexe d’étirement, qui peut également être conditionné33,34,35. L’approche est adaptable aux déficiences d’une personne; chez une personne, le conditionnement négatif du réflexe H du soléaire améliore la locomotion en réduisant l’hyperréflexie spastique14; dans un autre, le conditionnement du tibial antérieur MEP améliore la locomotion en atténuant la chutedu pied 36.
Alors que des efforts sont en cours pour produire une mise en œuvre commerciale du protocole, le logiciel original sera maintenu en parallèle en tant qu’outil de recherche pour fournir la flexibilité nécessaire pour élargir le domaine de la neuroplasticité ciblée. Cette flexibilité est rendue possible par la modularité et l’extensibilité de la plate-forme logicielle BCI2000, largement répandue et bien établie, sur laquelle EPOCS est basé. Cela signifie qu’avec une intervention minimale d’un ingénieur logiciel, le système est reconfigurable pour une plus grande variété d’objectifs de recherche. Par exemple, il peut être configuré pour enregistrer des canaux de biosignal supplémentaires ou des capteurs supplémentaires pour une analyse ultérieure (par exemple, des pédales de commande et des capteurs de suivi de mouvement) pour le conditionnement pendant la locomotion. Il peut également être programmé pour considérer des critères de déclenchement supplémentaires pour la stimulation (par exemple, déclencher la stimulation seulement à une partie particulière du cycle de marche) ou pour déclencher des stimuli de renforcement supplémentaires lors d’essais réussis ou infructueux. Des exemples de fichiers de personnalisation sont fournis.
La neuroplasticité ciblée en est encore à ses balbutiements. Ses avenues encore inexplorées devraient offrir de grands avantages à la fois pour le développement de nouvelles approches thérapeutiques (comme discuté ci-dessus) et pour élucider l’histoire naturelle de la maladie et les mécanismes de la fonction du système nerveux central dans la santé et la maladie 2,32,37. Nous nous engageons donc à maintenir et à soutenir EPOCS en tant qu’outil clé pour réaliser ce potentiel thérapeutique et scientifique.
Divulgations
The authors have nothing to disclose.
Acknowledgements
Ce travail a été soutenu par NIH (NIBIB) P41EB018783 (JRW), NIH (NINDS) R01NS114279 (AKT), NIH (NINDS) U44NS114420 (I. Clements, AKT, JRW), NYS SCIRB C33279GG & C32236GG (JRW), NIH (NICHD) P2C HD086844 (S. Kautz), The Doscher Neurorehabilitation Research Program (AKT) et Stratton Albany VA Medical Center.
Materials
| Alcohol swabs | any | For application to skin | |
| BNC cable (long) x 1 | any | Male BNC to male BNC, long enough to reach from digitizer to stimulator | |
| BNC cable (medium) x 2 | any | Male BNC to male BNC, long enough to reach from amplifier to digitizer | |
| BNC cable (short) x 1 | any | Male BNC to male BNC, short (to patch between two digitizer ports) | |
| BNC tee connector | any | Female-male-female BNC splitter | |
| Computer | Lenovo | ThinkStation P340 | A wide range of computing hardware is suitable, especially if using a USB digitizer (no PCI slots needed). Must run Windows 7+. Include standard keyboard & mouse. |
| Constant-current stimulator | Digitimer Ltd. | DS8R | The DS8R enjoys EPOCS automation support. If controlled manually, other constant-current stimulators may be used provided they have an external TTL trigger and can achieve a pulse duration of 1 ms or more. |
| Digitizer (option A) | National Instruments | USB-6212 | USB digitizer with integrated BNC connectors. |
| Digitizer (option B) | National Instruments | PCIe-6321 | PCIe digitizer—requires desktop computer with a free PCI slot, also cable and BNC terminal block (below) |
| Digitizer cable (for option B only) | National Instruments | SHC68-68-EPM | Connects PCIe digitizer to BNC terminal block |
| Digitizer terminal block (for option B only) | National Instruments | BNC-2090A | 19-inch-rack-mountable BNC terminal block |
| EMG amplifier system | Bortec Biomedical Ltd. | AMT-8 | Analog amplifier + portable unit + long transmission cable + battery pack + two 500-gain active electrode leads (1 bipolar, 1 bipolar with ground) |
| Monitor | any | Large enough for the participant to see clearly from the intended viewing distance. | |
| NeuroPlus electrodes (22 x 22 mm) x 6 | Vermont Medical Inc. | A10040-60 | Disposable self-adhesive silver/silver-chloride 22 x 22 mm surface-EMG electrodes. 6 needed per session (11 on participant's first session) |
| NeuroPlus electrode (22 x 35 mm) x 1 | Vermont Medical Inc. | A10041-60 | Disposable self-adhesive silver/silver-chloride 22 x 35 mm surface-EMG electrode. 1 needed per session. |
| Snap lead x 2 | any | EDR1220 | Leads for stimulating electrodes: 1.5mm DIN to button snap |
| Wire | any | 8–10 cm length of single-core insulated wire |
References
- Thompson, A. K., Wolpaw, J. R. Targeted neuroplasticity for rehabilitation. Progress in Brain Research. 218, 157-172 (2015).
- Wolpaw, J. R. What can the spinal cord teach us about learning and memory. Neuroscientist. 16 (5), 532-549 (2010).
- Thompson, A. K., Pomerantz, F. R., Wolpaw, J. R. Operant conditioning of a spinal reflex can improve locomotion after spinal cord injury in humans. Journal of Neuroscience. 33 (6), 2365-2375 (2013).
- Chen, Y., et al. Locomotor impact of beneficial or nonbeneficial H-reflex conditioning after spinal cord injury. Journal of Neurophysiology. 111 (6), 1249-1258 (2014).
- Thompson, A. K., Wolpaw, J. R. H-reflex conditioning during locomotion in people with spinal cord injury. Journal of Physiology. 599 (9), 2453-2469 (2021).
- Bunday, K. L., Perez, M. A. Motor recovery after spinal cord injury enhanced by strengthening corticospinal synaptic transmission. Current Biology. 22 (24), 2355-2361 (2012).
- Schalk, G., McFarland, D., Hinterberger, T., Birbaumer, N., Wolpaw, J. BCI2000: a general-purpose brain-computer interface (BCI) system. IEEE Transactions on Biomedical Engineering. 51 (6), 1034-1043 (2004).
- Schalk, G., Mellinger, J. . A Practical Guide to Brain-Computer Interfacing with BCI2000. , (2010).
- Wolpaw, J. R., Braitman, D. J., Seegal, R. F. Adaptive plasticity in primate spinal stretch reflex: initial development. Journal of Neurophysiology. 50 (6), 1296-1311 (1983).
- Wolpaw, J. R. Operant conditioning of primate spinal reflexes: The H-reflex. Journal of Neurophysiology. 57 (2), 443-459 (1987).
- Chen, X. Y., Wolpaw, J. R. Operant conditioning of H-reflex in freely moving rats. Journal of Neurophysiology. 73 (1), 411-415 (1995).
- Chen, Y., et al. Operant conditioning of H-reflex can correct a locomotor abnormality after spinal cord injury in rats. Journal of Neuroscience. 26 (48), 12537-12543 (2006).
- Chen, X. Y., Chen, L., Chen, Y., Wolpaw, J. R. Operant conditioning of reciprocal inhibition in rat soleus muscle. Journal of Neurophysiology. 96 (4), 2144-2150 (2006).
- Thompson, A. K., Pomerantz, F. R., Wolpaw, J. R. Operant conditioning of a spinal reflex can improve locomotion after spinal cord injury in humans. Journal of Neuroscience. 33 (6), 2365-2375 (2013).
- Thompson, A. K., Favale, B. M., Velez, J., Falivena, P. Operant up-conditioning of the tibialis anterior motor-evoked potential in multiple sclerosis: feasibility case studies. Neural Plasticity. , 4725393 (2018).
- Thompson, A. K., Chen, X. Y., Wolpaw, J. R. Acquisition of a simple motor skill: Task-dependent adaptation plus long-term change in the human soleus H-reflex. Journal of Neuroscience. 29 (18), 5784-5792 (2009).
- Makihara, Y., Segal, R. L., Wolpaw, J. R., Thompson, A. K. Operant conditioning of the soleus H-reflex does not induce long-term changes in the gastrocnemius H-reflexes and does not disturb normal locomotion in humans. Journal of Neurophysiology. 112 (6), 1439-1446 (2014).
- Hoffmann, P. Beitrag zur Kenntnis der menschlichen Reflexe mit besonderer Berücksichtigung der elektrischen Erscheinungen. Archiv für Anatomie, Physiologie und Wissenschaftliche Medicin. 1, 223-246 (1910).
- Magladery, J. W., McDougal, D. B. Electrophysiological studies of nerve and reflex activity in normal man, I: Identification of certain reflexes in the electromyogram and the conduction velocity of peripheral nerve fibers. Bulletin of the Johns Hopkins Hospital. 86, 265-289 (1950).
- Zehr, E. P. Considerations for use of the Hoffmann reflex in exercise studies. European Journal of Applied Physiology. 86 (5), 455-468 (2002).
- Misiaszek, J. E. The H-reflex as a tool in neurophysiology: Its limitations and uses in understanding nervous system function. Muscle & Nerve. 28 (2), 144-160 (2003).
- Pierrot Deseilligny, E., Burke, D. . The Circuitry of the Human Spinal Cord: Its Role in Motor Control and Movement Disorders. , (2012).
- Skinner, B. F. . The Behavior of Organisms: An Experimental Analysis. , (1938).
- Eftekhar, A., Norton, J. J. S., McDonough, C. M., Wolpaw, J. R. Retraining reflexes: Clinical translation of spinal reflex operant conditioning. Neurotherapeutics. 15 (3), 669-683 (2018).
- Norton, J., et al. Operant condition of the flexor carpi radialis H-reflex. Archives of Physical Medicine and Rehabilitation. 101 (12), 145-146 (2020).
- Crone, C., Johnsen, L. L., Hultborn, H., Orsnes, G. B. Amplitude of the maximum motor response (Mmax) in human muscles typically decreases during the course of an experiment. Experimental Brain Research. 124 (2), 265-270 (1999).
- Devetzoglou-Toliou, S., et al. Recursive PID controller for automatically adjusting M-wave size during H-reflex operant conditioning. International IEEE/EMBS Conference on Neural Engineering. 10, 1079-1082 (2021).
- Wolpaw, J. R., Seegal, R. F. Diurnal rhythm in the spinal stretch reflex. Brain Research. 244 (2), 365-369 (1982).
- Chen, X. Y., Wolpaw, J. R. Circadian rhythm in rat H-reflex. Brain Research. 648 (1), 167-170 (1994).
- Carp, J. S., Tennissen, A. M., Chen, X. Y., Wolpaw, J. R. Diurnal H-reflex variation in mice. Experimental Brain Research. 168 (4), 517-528 (2006).
- Lagerquist, O., Zehr, E. P., Baldwin, E. R., Klakowicz, P. M., Collins, D. F. Diurnal changes in the amplitude of the Hoffmann reflex in the human soleus but not in the flexor carpi radialis muscle. Experimental Brain Research. 170, 1-6 (2006).
- Thompson, A. K., Wolpaw, J. R. Operant conditioning of spinal reflexes: From basic science to clinical therapy. Frontiers in Integrative Neuroscience. 8, 25 (2014).
- Segal, R. L., Wolf, S. L. Operant conditioning of spinal stretch reflexes in patients with spinal cord injuries. Experimental Neurology. 130 (2), 202-213 (1994).
- Wolf, S. L., Segal, R. L. Reducing human biceps brachii spinal stretch reflex magnitude. Journal of Neurophysiology. 75 (4), 1637-1646 (1996).
- Mrachacz-Kersting, N., et al. Acquisition of a simple motor skill: Task-dependent adaptation and long-term changes in the human soleus stretch reflex. Journal of Neurophysiology. 122 (1), 435-446 (2019).
- Thompson, A. K., et al. Operant conditioning of the motor-evoked potential and locomotion in people with and without chronic incomplete spinal cord injury. Journal of Neurophysiology. 121 (3), 853-866 (2019).
- Thompson, A. K., et al. Effects of sensorimotor rhythm modulation on the human flexor carpi radialis H-reflex. Frontiers in Neuroscience. 12, 505 (2018).

