Polymerasekædereaktion og dot-blot-hybridisering til detektion af leptospira i vandprøver
Summary
I denne undersøgelse blev en dot-blot-applikation designet til at detektere Leptospira fra de tre hovedklader i vandprøver. Denne metode gør det muligt at identificere minimale DNA-mængder, der specifikt er målrettet mod en digoxigenin-mærket sonde, der let detekteres af et anti-digoxigenin-antistof. Denne tilgang er et værdifuldt og tilfredsstillende redskab til screeningsformål.
Abstract
Dot-blot er en enkel, hurtig, følsom og alsidig teknik, der muliggør identifikation af minimale mængder DNA, der specifikt er målrettet mod sondehybridisering i nærvær af bærer-DNA. Det er baseret på overførsel af en kendt mængde DNA til en inert fast støtte, såsom en nylonmembran, ved hjælp af dot-blot-apparatet og uden elektroforetisk adskillelse. Nylonmembraner har fordelen ved høj nukleinsyrebindingskapacitet (400 μg /cm2), høj styrke og er positivt eller neutralt ladede. Den anvendte sonde er et meget specifikt ssDNA-fragment på 18 til 20 baser langt mærket med digoxigenin (DIG). Sonden vil konjugere med Leptospira DNA. Når sonden er hybridiseret med mål-DNA’et, detekteres den af et anti-digoxigenin-antistof, hvilket gør det let at detektere det gennem dets emissioner afsløret i en røntgenfilm. Prikkerne med en emission svarer til DNA-fragmenterne af interesse. Denne metode anvender den ikke-isotopiske mærkning af sonden, som kan have en meget lang halveringstid. Ulempen ved denne standard immunetiket er en lavere følsomhed end isotopprober. Ikke desto mindre afbødes det ved kobling af polymerasekædereaktion (PCR) og dot-blot-assays. Denne fremgangsmåde muliggør berigelse af målsekvensen og dens detektion. Derudover kan det bruges som en kvantitativ anvendelse sammenlignet med en seriel fortynding af en velkendt standard. En dot-blot-applikation til påvisning af Leptospira fra de tre hovedklader i vandprøver præsenteres her. Denne metode kan anvendes på store mængder vand, når de er blevet koncentreret ved centrifugering for at give bevis for tilstedeværelsen af leptospiral-DNA. Dette er et værdifuldt og tilfredsstillende værktøj til generelle screeningsformål og kan bruges til andre ikke-dyrkelige bakterier, der kan være til stede i vand, hvilket forbedrer forståelsen af økosystemet.
Introduction
Leptospirose hos mennesker stammer hovedsageligt fra miljømæssige kilder 1,2. Tilstedeværelsen af Leptospira i søer, floder og vandløb er en indikator for leptospiroseoverførsel blandt dyreliv og husdyr og produktionsdyr, der i sidste ende kan komme i kontakt med disse vandområder 1,3,4. Desuden er Leptospira blevet identificeret i ikke-naturlige kilder, herunder spildevand, stillestående vand og postevand 5,6.
Leptospira er en verdensomspændende distribueret bakterie 7,8, og miljøets rolle i dets bevarelse og transmission er blevet anerkendt. Leptospira kan overleve i drikkevand under variabel pH og mineraler9 og i naturlige vandområder1. Det kan også overleve i lange perioder i destilleret vand10, og under konstant pH (7,8) kan det overleve op til 152 dage11. Desuden kan Leptospira interagere i bakteriekonsortier for at overleve barske forhold12,13. Det kan indgå i biofilm i ferskvand med Azospirillum og Sphingomonas og er endda i stand til at vokse og udholde temperaturer på over 49 °C14,15. Det kan også formere sig i vandtæt jord og forblive levedygtigt i op til 379 dage16 og bevare dets evne til at forårsage sygdommen i så længe som et år17,18. Imidlertid er der lidt kendt om økologien inden for vandlegemer og hvordan den fordeles i dem.
Siden opdagelsen var undersøgelsen af slægten Leptospira baseret på serologiske tests. Det var først i det nuværende århundrede, at molekylære teknikker blev mere udbredt i undersøgelsen af denne spirochaete. Dot-blottet er næsten ikke blevet anvendt til identifikation ved hjælp af (1) en isotopsonde baseret på 16S rRNA og på en inter-simple sekvensgentagelse (ISSR)19,20, (2) som et nanoguldbaseret immunoassay for human leptospirose anvendt på urin21 eller (3) som et antistofbaseret assay til kvægurinprøver22. Teknikken faldt i brug, fordi den oprindeligt var baseret på isotopsonder. Det er imidlertid en velkendt teknik, der kombineret med PCR giver forbedrede resultater, og det betragtes som sikkert på grund af brugen af ikke-isotopiske sonder. PCR spiller en afgørende rolle i berigelsen af Leptospira-DNA’et ved at amplificere et specifikt DNA-fragment, der kan findes i spormængder i en prøve. Under hver PCR-cyklus fordobles mængden af det målrettede DNA-fragment i reaktionen. I slutningen af reaktionen er amplikonen blevet ganget med en faktor på mere end en million23. Produktet forstærket af PCR, ofte ikke synligt i agaroseelektroforese, bliver synligt gennem specifik hybridisering med en DIG-mærket sonde i dot-blot 24,25,26.
Dot-blot-teknikken er enkel, robust og velegnet til adskillige prøver, hvilket gør den tilgængelig for laboratorier med begrænsede ressourcer. Det har været anvendt i en række bakterieundersøgelser, herunder (1) orale bakterier27, (2) andre prøvetyper såsom mad og afføring28 og (3) identifikation af udyrkelige bakterier29, ofte i overensstemmelse med andre molekylære teknikker. Blandt fordelene ved dot-blot-teknikken er: (1) Membranen har en høj bindingskapacitet, der er i stand til at binde over 200 μg/cm2 nukleinsyrer og op til 400 μg/cm2; (2) Dot-blot-resultater kan fortolkes visuelt uden behov for særligt udstyr, og (3) de kan nemt opbevares i årevis ved stuetemperatur (RT).
Slægten Leptospira er blevet klassificeret i patogene, mellemliggende og saprofytiske klader30,31. Sondringen mellem disse klader kan opnås baseret på specifikke gener såsom lipL41, lipL32 og 16S rRNA. LipL32 er til stede i de patogene klader og udviser høj følsomhed i forskellige serologiske og molekylære værktøjer, mens det er fraværende i saprofytarter21. Husholdningsgenet lipL41 er kendt for sit stabile udtryk og anvendes i molekylære teknikker32, mens 16S rRNA-genet bruges til deres klassificering.
Denne metode kan anvendes på store mængder vand, når de er blevet koncentreret ved centrifugering. Det gør det muligt at vurdere forskellige punkter og dybder i et vandlegeme for at detektere tilstedeværelsen af leptospiral-DNA og den klade, som den tilhører. Dette værktøj er værdifuldt til både økologiske og generelle screeningsformål og kan også anvendes til at detektere andre ikke-dyrkelige bakterier, der kan være til stede i vand.
Derudover er PCR- og dot-blot-assays teknisk og økonomisk overkommelige for en lang række laboratorier, selv dem, der mangler sofistikeret eller dyrt udstyr. Denne undersøgelse har til formål at anvende den digoxigeninbaserede dot-blot til identifikation af de tre Leptospira-klader i vandprøver indsamlet fra naturlige vandområder.
Bakteriestammer
Tolv Leptospira serovarer (Autumnalis, Bataviae, Bratislava, Canicola, Celledoni, Grippothyphosa, Hardjoprajitno, Icterohaemorrhagiae, Pomona, Pyrogenes, Tarassovi og Wolffi) blev inkluderet i denne undersøgelse. Disse serovarer er en del af samlingen på Institut for Mikrobiologi og Immunologi, Det Veterinærmedicinske Fakultet og Zooteknik, National Autonomous University of Mexico, og de bruges i øjeblikket i mikroagglutinationstesten (MAT).
Alle Leptospira serovarer blev dyrket i EMJH, og deres DNA blev ekstraheret ved hjælp af et kommercielt DNA-ekstraktionssæt (se materialetabel). En genomisk DNA-blanding af de tolv serovarer blev anvendt som en positiv kontrol for den Leptospira-patogene klade. Som en positiv kontrol af Leptospira-mellemkladen blev genomisk DNA fra Leptospira fainei serovar Hurstbridge-stammen BUT6 inkluderet, og som en positiv kontrol for Leptospira-saprofytkladen blev genomisk DNA fra Leptospira biflexa serovar Patoc-stammen Patoc I også inkluderet.
Negative kontroller bestod af et tomt plasmid, DNA fra ikke-relaterede bakterier (Ureaplasma urealyticum, Staphylococcus aureus, Brucella abortus, Salmonella typhimurium, Shigella boydii, Klebsiella pneumoniae, Acinetobacter baumannii og Escherichia coli) og vand af PCR-kvalitet, der fungerede som ikke-skabelonkontrol.
Vandprøver
Tolv prøvetagningsprøver blev indsamlet ved hjælp af en stratificeret-tilfældig prøveudtagningsmetode fra Cuemanco Biological and Aquaculture Research Center (CIBAC) (19° 16′ 54″ N 99° 6′ 11″ W). Disse prøver blev opnået på tre dybder: overfladisk, 10 og 30 cm (figur 1A, B). Vandopsamlingsprocedurerne påvirkede ikke nogen truede eller beskyttede arter. Hver prøve blev opsamlet i et sterilt 15 ml mikrocentrifugeglas. For at indsamle prøven blev hvert rør forsigtigt nedsænket i vandet, fyldt på den valgte dybde og derefter forseglet. Prøverne blev opbevaret ved 22 °C og straks transporteret til laboratoriet til forarbejdning.
Hver prøve blev koncentreret ved centrifugering i sterile 1,5 ml mikrocentrifugeglas ved 8000 x g i 20 minutter ved stuetemperatur. Dette trin blev gentaget, indtil alle prøverne var koncentreret i et rør, som derefter blev brugt til DNA-ekstraktion (figur 1C).
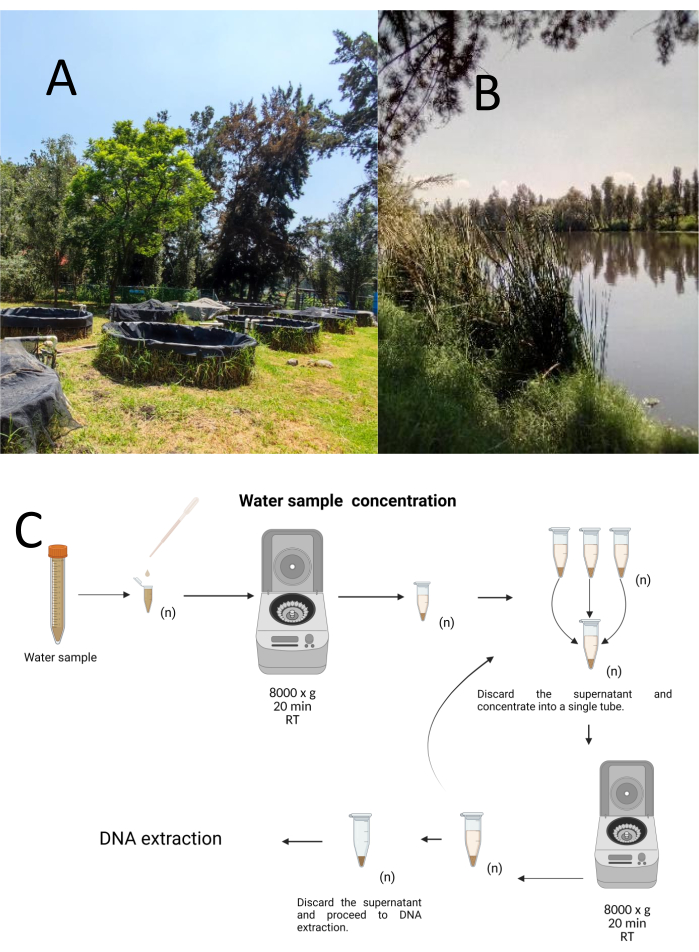
Figur 1: Koncentration af vandprøver ved centrifugering. (A) Vandprøvetagningsdamme, og (B) Naturlige vandløb. C) Centrifugeringsbaseret behandling af vandprøver i gentagne trin så mange gange som nødvendigt (n). Klik her for at se en større version af denne figur.
DNA-ekstraktion
Total DNA blev isoleret ved hjælp af et kommercielt genomisk DNA-sæt i henhold til producentens instruktioner (se materialetabel). DNA-ekstraktioner blev elueret i 20 μL elueringsbuffer, og DNA-koncentrationen blev bestemt af et UV-spektrofotometer ved 260-280 nm og opbevaret ved 4 °C indtil brug.
PCR-forstærkning
PCR-målene var generne 16S rRNA, lipL41 og lipL32, som identificerer DNA fra slægten Leptospira og tillader sondring mellem de tre klader: patogen, saprofytisk og mellemliggende. Både primere og sondedesign var baseret på de tidligere værker af Ahmed et al., Azali et al., Bourhy et al., Weiss et al. og Branger et al.33,34,35,36,37. Sekvensen af hver sonde, primer og forstærket fragment er beskrevet i tabel 1, og deres tilpasning til referencesekvenser er angivet i supplerende fil 1, supplerende fil 2, supplerende fil 3, supplerende fil 4 og supplerende fil 5. PCR-reagenserne og termocykelbetingelserne er beskrevet i protokolafsnittet.
Amplifikationsprodukter blev visualiseret ved elektroforetisk separation på en 1% agarosegel i TAE (40 mM Tris-base, 20 mM eddikesyre og 1 mM EDTA; pH 8,3) ved 60 V i 45 minutter med ethidiumbromiddetektion, som vist i supplerende figur 1. Genomisk DNA opnået fra hver serovar blev anvendt med koncentrationer fra 6 x 106 til 1 x 104 genomiske ækvivalente kopier (GEq) i hver PCR-reaktion baseret på genomstørrelsen af L. interrogans (4, 691, 184 bp)38 for patogen Leptospira, genomstørrelsen af L. biflexa (3, 956, 088 bp)39 for saprofytisk Leptospira, og genomstørrelsen af L. fainei serovar Hurstbridge stamme BUT6 (4.267, 324 bp) med tiltrædelsesnummer AKWZ00000000.2.
Sondernes følsomhed blev vurderet med DNA fra hver patogen serovar, L. biflexa serovar Patoc stamme Patoc I og L. fainei serovar Hurstbridge stamme BUT6 i hvert forsøg. For at vurdere specificiteten af PCR- og dot-blot-hybridiseringsanalysen blev DNA fra ikke-relaterede bakterier inkluderet.
Tabel 1: PCR-primere og sonder til forstærkning af produkter til identifikation af patogene, saprofytiske og mellemliggende klader af Leptospira. Klik her for at downloade denne tabel.
Dot-blot hybridiseringsassay
Teknikken kaldes dot-blot, fordi hullerne, hvori DNA-prøven er placeret, har en prikform, og når de suges til at blive fastgjort på plads ved vakuumsugning, får de denne form. Denne teknik blev udviklet af Kafatos et al.40. Teknikken muliggør semikvantificering af Leptospira i hver PCR-positiv prøve. Protokollen består af en denaturering med NaOH 0,4 M ved stuetemperatur, prøver med Leptospira DNA fra 30 ng til 0,05 ng, svarende til 6 x 106 til 1 x 104 leptospirer, blottes på en nylonmembran med et 96-brønds dot-blot-apparat. Efter immobilisering bindes DNA’et til membranen ved udsættelse for 120 mJ UV-lys. Hver DNA-sonde konjugeres med digoxigenin-11 dUTP ved et terminalt transferasekatalysetrin i 3′-enden (Digoxigenin er et plantesteroid opnået fra Digitalis purpurea, der anvendes som reporter41). Efter den strenge hybridisering af den mærkede DNA-sonde (50 pmol) ved den specifikke temperatur på mål-DNA’et visualiseres DNA-hybriderne ved kemiluminescensreaktionen med anti-digoxigenin alkalisk fosfataseantistof kovalent konjugeret med dets substrat CSPD. Luminescensen fanges ved udsættelse for en røntgenfilm (figur 2).
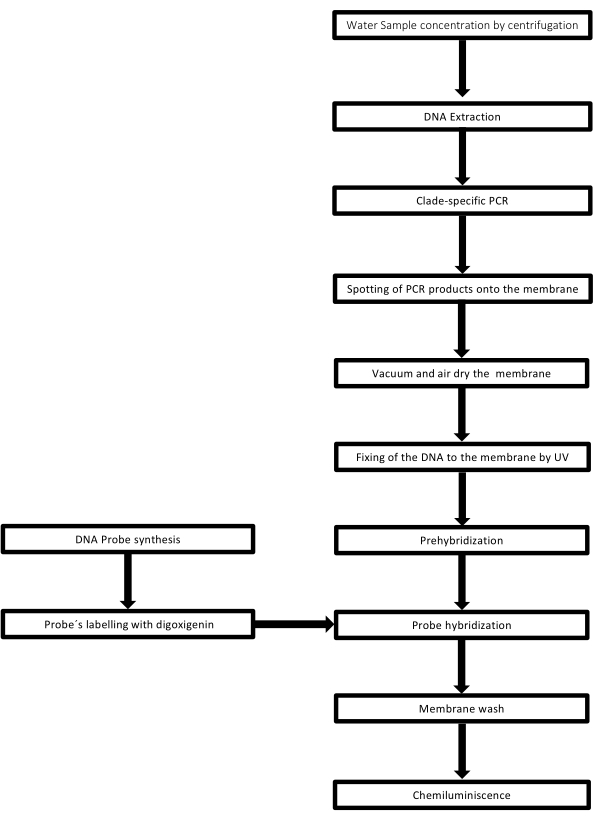
Figur 2: Trin i proceduren for PCR-dot-blot-assayet. Klik her for at se en større version af denne figur.
Protocol
Representative Results
Discussion
De kritiske trin i dot-blot-teknikken inkluderer (1) DNA-immobilisering, (2) blokering af de frie bindingssteder på membranen med ikke-homologt DNA, (3) komplementariteten mellem sonden og målfragmentet under udglødningsbetingelser, (4) fjernelse af den uhybridiserede sonde og (5) påvisning af reportermolekylet41.
PCR-Dot-blot har visse begrænsninger, såsom teknikken giver ikke information om størrelsen af det hybridiserede fragment37, det…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Vi står i gæld til Leptospira-samlingen ved Institut for Mikrobiologi og Immunologi, Det Veterinærmedicinske Fakultet og Zooteknik, Mexicos Nationale Autonome Universitet. Vi er taknemmelige for den generøse donation af referencestammerne fra Leptospira ; Leptospira fainei serovar Hurstbridge stamme BUT6 og Leptospira biflexa serovar Patoc stamme Patoc I til Dr. Alejandro de la Peña Moctezuma. Vi takker Dr. José Antonio Ocampo Cervantes, CIBAC-koordinatoren, og personalet for deres logistiske støtte. EDT var under Terminal Project-programmet for bachelorstuderende på Metropolitan Autonomous University-Campus Cuajimalpa. Vi anerkender den Biorender.com software til oprettelse af figur 1 og 3 til 9.
Materials
| REAGENTS | |||
| Purelink DNA extraction kit | Invitrogen | K182002 | |
| Gotaq Flexi DNA Polimerase (End-Point PCR Taq polymerase kit) | Promega | M3001 | |
| Whatman filter paper, grade 1, | Merk | WHA1001325 | |
| Nylon Membranes, positively charged Roll 30cm x 3 m | Roche | 11417240001 | |
| Anti-Digoxigenin-AP, Fab fragments Sheep Polyclonal Primary-antibody | Roche | 11093274910 | |
| Medium Base EMJH | Difco | S1368JAA | |
| Leptospira Enrichment EMJH | Difco | BD 279510 | |
| Blocking Reagent | Roche | 11096176001 | |
| CSPD ready to use Disodium 3-(4-methoxyspiro {1,2-dioxetane-3,2′-(5′-chloro) tricyclo [3.3.1.13,7] decan}8-4-yl) phenyl phosphate | Merk | 11755633001 | |
| Deoxyribonucleic acid from herring sperm | Sigma Aldrich | D3159 | |
| Developer Carestream | Carestream Health Inc | GBX5158621 | |
| Digoxigenin-11-ddUTP | Roche | 11363905910 | |
| EDTA, Disodium Salt (Dihydrate) | Promega | H5032 | |
| Ficoll 400 | Sigma Aldrich | F8016 | |
| Fixer Carestream | Carestream Health Inc | GBX 5158605 | |
| Lauryl sulfate Sodium Salt (Sodium dodecyl sulfate; SDS) C12H2504SNa | Sigma Aldrich | L5750 | |
| N- Lauroylsarcosine sodium salt CH3(CH2)10CON(CH3) CH2COONa | Sigma Aldrich | L-9150 | It is an anionic surfactant |
| Polivinylpyrrolidone (PVP-40) | Sigma Aldrich | PVP40 | |
| Polyethylene glycol Sorbitan monolaurate (Tween 20) | Sigma Aldrich | 9005-64-5 | |
| Sodium Chloride (NaCl) | Sigma Aldrich | 7647-14-5 | |
| Sodium dodecyl sulfate (SDS) | Sigma Aldrich | 151-21-3 | |
| Sodium hydroxide (NaOH) | Sigma Aldrich | 1310-73-2 | |
| Sodium phosphate dibasic (NaH2PO4) | Sigma-Aldrich | 7558-79-4 | |
| Terminal transferase, recombinant | Roche | 3289869103 | |
| Tris hydrochloride (Tris HCl) | Sigma-Aldrich | 1185-53-1 | |
| SSPE 20X | Sigma-Aldrich | S2015-1L | It can be Home-made following Supplementary File 6 |
| Primers | Sigma-Aldrich | On demand | Follow table 1 |
| Probes | Sigma-Aldrich | On demand | Follow table 1 |
| Equipment | |||
| Nanodrop™ One Spectrophotometer | Thermo-Scientific | ND-ONE-W | |
| Refrigerated microcentrifuge Sigma 1-14K, suitable for centrifugation of 1.5 ml microcentrifuge tubes at 14,000 rpm | Sigma-Aldrich | 1-14K | |
| Disinfected adjustable pipettes, range 2-20 µl, 20-200 µl | Gilson | SKU:F167360 | |
| Disposable 1.5 ml microcentrifuge tubes (autoclaved) | Axygen | MCT-150-SP | |
| Disposable 600 µl microcentrifuge tubes (autoclaved) | Axygen | 3208 | |
| Disposable Pipette tips 1-10 µl | Axygen | T-300 | |
| Disposable Pipette tips 1-200 µl | Axygen | TR-222-Y | |
| Dot-Blot apparatus Bio-Dot | BIORAD | 1706545 | |
| Portable Hergom Suction | Hergom | 7E-A | |
| Scientific Light Box (Visible-light PH90-115V) | Hoefer | PH90-115V | |
| UV Crosslinker | Hoefer | UVC-500 | |
| Thermo Hybaid PCR Express Thermocycler | Hybaid | HBPX110 | |
| Radiographic cassette with IP Plate14 X 17 | Fuji |
References
- Bierque, E., Thibeaux, R., Girault, D., Soupé-Gilbert, M. E., Goarant, C. A systematic review of Leptospira in water and soil environments. PLOS One. 15 (1), e0227055 (2020).
- Haake, D. A., Levett, P. N. Leptospirosis in humans. Current Topics in Microbiology and Immunology. 387, 65-97 (2015).
- Tripathy, D. N., Hanson, L. E. Leptospires from water sources at Dixon Springs Agricultural Center. Journal of Wildlife Diseases. 9 (3), 209-212 (1973).
- Smith, D. J., Self, H. R. Observations on the survival of Leptospira australis A in soil and water. The Journal of Hygiene. 53 (4), 436-444 (1955).
- Karpagam, K. B., Ganesh, B. Leptospirosis: a neglected tropical zoonotic infection of public health importance-an updated review. European Journal of Clinical Microbiology & Infectious Diseases: Official Publication of the European Society of Clinical Microbiology. 39 (5), 835-846 (2020).
- Casanovas-Massana, A., et al. Spatial and temporal dynamics of pathogenic Leptospira in surface waters from the urban slum environment. Water Research. 130, 176-184 (2018).
- Costa, F., et al. Global morbidity and mortality of Leptospirosis: A systematic review. PLOS Neglected Tropical Diseases. 9 (9), e0003898 (2015).
- Mwachui, M. A., Crump, L., Hartskeerl, R., Zinsstag, J., Hattendorf, J. Environmental and behavioural determinants of Leptospirosis transmission: A systematic review. PLOS Neglected Tropical Diseases. 9 (9), e0003843 (2015).
- Andre-Fontaine, G., Aviat, F., Thorin, C. Waterborne Leptospirosis: Survival and preservation of the virulence of pathogenic Leptospira spp. in fresh water. Current Microbiology. 71 (1), 136-142 (2015).
- Trueba, G., Zapata, S., Madrid, K., Cullen, P., Haake, D. Cell aggregation: A mechanism of pathogenic Leptospira to survive in freshwater. International Microbiology: the Official Journal of the Spanish Society for Microbiology. 7 (1), 35-40 (2004).
- Smith, C. E., Turner, L. H. The effect of pH on the survival of leptospires in water. Bulletin of the World Health Organization. 24 (1), 35-43 (1961).
- Barragan, V. A., et al. Interactions of Leptospira with environmental bacteria from surface water. Current Microbiology. 62 (6), 1802-1806 (2011).
- Abdoelrachman, R. Comparative investigations into the influence of the presence of bacteria on the life of pathogenic and apathogenic leptospirae. Antonie van Leeuwenhoek. 13 (1), 21-32 (1947).
- Singh, R., et al. Microbial diversity of biofilms in dental unit water systems. Applied and Environmental Microbiology. 69 (6), 3412-3420 (2003).
- Kumar, K. V., Lall, C., Raj, R. V., Vedhagiri, K., Vijayachari, P. Coexistence and survival of pathogenic leptospires by formation of biofilm with Azospirillum. FEMS Microbiology Ecology. 91 (6), 051 (2015).
- Yanagihara, Y., et al. Leptospira Is an environmental bacterium that grows in waterlogged soil. Microbiology Spectrum. 10 (2), 0215721 (2022).
- Gillespie, R. W., Ryno, J. Epidemiology of leptospirosis. American Journal of Public Health and Nation’s Health. 53 (6), 950-955 (1963).
- Bierque, E., et al. Leptospira interrogans retains direct virulence after long starvation in water. Current Microbiology. 77 (10), 3035-3043 (2020).
- Zhang, Y., Dai, B. Marking and detection of DNA of leptospires in the dot-blot and situ hybridization with digoxigenin-labeled probes. Journal of West China University of Medical Sciences. 23 (4), 353-435 (1992).
- Mérien, F., Amouriaux, P., Perolat, P., Baranton, G., Saint Girons, I. Polymerase chain reaction for detection of Leptospira spp. in clinical samples. Journal of Clinical Microbiology. 30 (9), 2219-2224 (1992).
- Veerapandian, R., et al. Silver enhanced nano-gold dot-blot immunoassay for leptospirosis. Journal of Microbiological Methods. 156, 20-22 (2019).
- Junpen, S., et al. Evaluation of a monoclonal antibody-based dot-blot ELISA for detection of Leptospira spp in bovine urine samples. American Journal of Veterinary Research. 66 (5), 762-766 (2005).
- Ishmael, F. T., Stellato, C. Principles and applications of polymerase chain reaction: basic science for the practicing physician. Annals of Allergy, Asthma & Immunology: Official Publication of the American College of Allergy, Asthma, & Immunology. 101 (4), 437-443 (2008).
- Boerner, B., Weigelt, W., Buhk, H. J., Castrucci, G., Ludwig, H. A sensitive and specific PCR/Southern blot assay for detection of bovine herpesvirus 4 in calves infected experimentally. Journal of Virological Methods. 83 (1-2), 169-180 (1999).
- Curry, E., Pratt, S. L., Kelley, D. E., Lapin, D. R., Gibbons, J. R. Use of a Combined duplex PCR/Dot-blot assay for more sensitive genetic characterization. Biochemistry Insights. 1, 35-39 (2008).
- Pilatti, M. M., Ferreira, S. d. e. A., de Melo, M. N., de Andrade, A. S. Comparison of PCR methods for diagnosis of canine visceral leishmaniasis in conjunctival swab samples. Research in Veterinary Science. 87 (2), 255-257 (2009).
- Conrads, G., et al. PCR reaction and dot-blot hybridization to monitor the distribution of oral pathogens within plaque samples of periodontally healthy individuals. Journal of Periodontology. 67 (10), 994-1003 (1996).
- Langa, S., et al. Differentiation of Enterococcus faecium from Lactobacillus delbrueckii subsp. bulgaricus and Streptococcus thermophilus strains by PCR and dot-blot hybridisation. International Journal of Food Microbiology. 88 (2-3), 197-200 (2003).
- Francesca, C., Lucilla, I., Marco, F., Giuseppe, C., Marisa, M. Identification of the unculturable bacteria Candidatus arthromitus in the intestinal content of trouts using dot-blot and Southern blot techniques. Veterinary Microbiology. 156 (3-4), 389-394 (2012).
- Arent, Z., Pardyak, L., Dubniewicz, K., Plachno, B. J., Kotula-Balak, M. Leptospira taxonomy: then and now. Medycyna Weterynaryjna. 78 (10), 489-496 (2022).
- Thibeaux, R., et al. Biodiversity of environmental Leptospira: Improving identification and revisiting the diagnosis. Frontiers in Microbiology. 9, 816 (2018).
- Carrillo-Casas, E. M., Hernández-Castro, R., Suárez-Güemes, F., de la Peña-Moctezuma, A. Selection of the internal control gene for real-time quantitative RT-PCR assays in temperature treated Leptospira. Current Microbiology. 56 (6), 539-546 (2008).
- Azali, M. A., Yean Yean, C., Harun, A., Aminuddin Baki A, N. N., Ismail, N. Molecular characterization of Leptospira spp. in environmental samples from North-Eastern Malaysia revealed a pathogenic strain, Leptospira alstonii. Journal of Tropical Medicine. 2016, 2060241 (2016).
- Ahmed, N., et al. Multilocus sequence typing method for identification and genotypic classification of pathogenic Leptospira species. Annals of Clinical Microbiology and Antimicrobials. 5, 28 (2006).
- Bourhy, P., Collet, L., Brisse, S., Picardeau, M. Leptospira mayottensis sp. nov., a pathogenic species of the genus Leptospira isolated from humans. International Journal of Systematic and Evolutionary Microbiology. 64, 4061-4067 (2014).
- Weiss, S., et al. An extended Multilocus Sequence Typing (MLST) scheme for rapid direct typing of Leptospira from clinical samples. PLOS Neglected Tropical Diseases. 10 (9), e0004996 (2016).
- Branger, C., et al. Polymerase chain reaction assay specific for pathogenic Leptospira based on the gene hap1 encoding the hemolysis-associated protein-1. FEMS Microbiology Letters. 243 (2), 437-445 (2005).
- Ren, S. X., et al. Unique physiological and pathogenic features of Leptospira interrogans revealed by whole-genome sequencing. Nature. 422 (6934), 888-893 (2003).
- Picardeau, M., et al. Genome sequence of the saprophyte Leptospira biflexa provides insights into the evolution of Leptospira and the pathogenesis of leptospirosis. PLOS One. 3 (2), e1607 (2008).
- Kafatos, F. C., Jones, C. W., Efstratiadis, A. Determination of nucleic acid sequence homologies and relative concentrations by a dot hybridization procedure. Nucleic Acids Research. 7 (6), 1541-1552 (1979).
- Bhat, A. I., Rao, G. P. Dot-blot hybridization technique. Characterization of Plant Viruses. , 303-321 (2020).
- Yadav, J. P., Batra, K., Singh, Y., Singh, M. Comparative evaluation of indirect-ELISA and Dot-blot assay for serodetection of Mycoplasma gallisepticum and Mycoplasma synoviae antibodies in poultry. Journal of Microbiological Methods. 189, 106317 (2021).
- Malinen, E., Kassinen, A., Rinttilä, T., Palva, A. Comparison of real-time PCR with SYBR Green I or 5′-nuclease assays and dot-blot hybridization with rDNA-targeted oligonucleotide probes in quantification of selected faecal bacteria. Microbiology. 149, 269-277 (2003).
- Wyss, C., et al. Treponema lecithinolyticum sp. nov., a small saccharolytic spirochaete with phospholipase A and C activities associated with periodontal diseases. International Journal of Systematic Bacteriology. 49, 1329-1339 (1999).
- Shah, J. S., I, D. C., Ward, S., Harris, N. S., Ramasamy, R. Development of a sensitive PCR-dot-blot assay to supplement serological tests for diagnosing Lyme disease. European Journal of Clinical Microbiology & Infectious Diseases: Official Publication of the European Society of Clinical Microbiology. 37 (4), 701-709 (2018).
- Niu, C., Wang, S., Lu, C. Development and evaluation of a dot-blot assay for rapid determination of invasion-associated gene ibeA directly in fresh bacteria cultures of E. coli. Folia microbiologica. 57 (6), 557-561 (2012).
- Wetherall, B. L., McDonald, P. J., Johnson, A. M. Detection of Campylobacter pylori DNA by hybridization with non-radioactive probes in comparison with a 32P-labeled probe. Journal of Medical Microbiology. 26 (4), 257-263 (1988).
- Kolk, A. H., et al. Detection of Mycobacterium tuberculosis in clinical samples by using polymerase chain reaction and a nonradioactive detection system. Journal of Clinical Microbiology. 30 (10), 2567-2575 (1992).
- Scherer, L. C., et al. PCR colorimetric dot-blot assay and clinical pretest probability for diagnosis of Pulmonary Tuberculosis in smear-negative patients. BMC Public Health. 7, 356 (2007).
- Armbruster, D. A., Pry, T. Limit of blank, limit of detection and limit of quantitation. The Clinical Biochemist Reviews. 29, S49-S52 (2008).
- Zhang, Y., Dai, B. Detection of Leptospira by dot-blot hybridization with photobiotin- and 32P-labeled DNA. Journal of West China University of Medical Sciences = Huaxi like daxue xuebao. 23 (2), 130-132 (1992).
- Terpstra, W. J., Schoone, G. J., ter Schegget, J. Detection of leptospiral DNA by nucleic acid hybridization with 32P- and biotin-labeled probes. Journal of Medical Microbiology. 22 (1), 23-28 (1986).
- Shukla, J., Tuteja, U., Batra, H. V. DNA probes for identification of leptospires and disease diagnosis. The Southeast Asian Journal of Tropical Medicine and Public Health. 35 (2), 346-352 (2004).
- Jiang, N., Jin, B., Dai, B., Zhang, Y. Identification of pathogenic and nonpathogenic leptospires by recombinant probes. Journal of West China University of Medical Sciences = Huaxi like daxue xuebao. 26 (1), 1-5 (1995).
- Fach, P., Trap, D., Guillou, J. P. Biotinylated probes to detect Leptospira interrogans on dot-blot hybridization or by in situ hybridization. Letters in Applied Microbiology. 12 (5), 171-176 (1991).
- Huang, N., Dai, B. Assay of genomic DNA homology among strains of different virulent leptospira by DNA hybridization. Journal of West China University of Medical Sciences = Huaxi like daxue xuebao. 23 (2), 122-125 (1992).
- Dong, X., Dai, B., Chai, J. Homology study of leptospires by molecular hybridization. Journal of West China University of Medical Sciences = Huaxi like daxue xuebao. 23 (1), 1-4 (1992).
- Komminoth, P. Digoxigenin as an alternative probe labeling for in situ hybridization. Diagnostic Molecular Pathology: The American Journal of Surgical Pathology, part B. 1 (2), 142-150 (1992).
- Saengjaruk, P., et al. Diagnosis of human leptospirosis by monoclonal antibody-based antigen detection in urine. Journal of Clinical Microbiology. 40 (2), 480-489 (2002).
- Okuda, M., et al. Enzyme-linked immunosorbent assay for the detection of canine Leptospira antibodies using recombinant OmpL1 protein. The Journal of Veterinary Medical Science. 67 (3), 249-254 (2005).
- Suwimonteerabutr, J., et al. Evaluation of a monoclonal antibody-based dot-blot ELISA for detection of Leptospira spp in bovine urine samples. American Journal of Veterinary Research. 66 (5), 762-766 (2005).
- Kanagavel, M., et al. Peptide-specific monoclonal antibodies of Leptospiral LigA for acute diagnosis of leptospirosis. Scientific reports. 7 (1), 3250 (2017).
- Levett, P. N. Leptospirosis. Clinical Microbiology Reviews. 14 (2), 296-326 (2001).
- Monahan, A. M., Callanan, J. J., Nally, J. E. Proteomic analysis of Leptospira interrogans shed in urine of chronically infected hosts. Infection and Immunity. 76 (11), 4952-4958 (2008).
- Rojas, P., et al. Detection and quantification of leptospires in urine of dogs: a maintenance host for the zoonotic disease leptospirosis. European Journal of Clinical Microbiology & Infectious Diseases: Official Publication of the European Society of Clinical Microbiology. 29 (10), 1305-1309 (2010).

