Лабораторное обслуживание нижнекрылой мухи Bradysia (Sciara) coprophila: новый/старый формирующийся модельный организм
Summary
В этой статье описывается лабораторное обслуживание (включая спаривание и кормление) низшего двукрылого мухи Bradysia (Sciara) coprophila.
Abstract
Лабораторные запасы нижнекрылой мухи, Bradysia (Sciara) coprophila, поддерживаются на протяжении более ста лет. Здесь представлены протоколы лабораторного ведения B. coprophila . Эти протоколы будут полезны для быстро растущего числа лабораторий, изучающих B. coprophila , чтобы воспользоваться ее уникальными биологическими особенностями, которые включают в себя: (1) монополярное веретено при мужском мейозе I; (2) недизъюнкция Х-диады при мужском мейозе II; (3) импринтинг хромосом для различения материнских и отцовских гомологов; (4) хромосомы, ограниченные зародышевой линией (L); (5) элиминация хромосом (отцовские хромосомы при мужском мейозе I; одна-две Х-хромосомы у ранних эмбрионов; L-хромосомы из сомы у ранних эмбрионов); (6) определение пола матерью (отсутствует Y-хромосома); и (7) регулируемая в развитии амплификация ДНК в пухлых локусах ДНК в политенных хромосомах личиночных слюнных желез.
Теперь стало возможным исследовать эти многочисленные уникальные особенности механики хромосом, используя последние достижения в секвенировании и сборке генома B. coprophila и разработку методологии трансформации для геномной инженерии. Растущее научное сообщество, использующее B. coprophila для исследований, получит пользу от описанных здесь протоколов спаривания мух (фенотипические маркеры для матерей, у которых будут только сыновья или только дочери; детали массового спаривания для биохимических экспериментов), проверки вылупления эмбрионов, кормления личинок и других комментариев по его выращиванию.
Introduction
Полное понимание биологических принципов требует изучения многих разнообразных организмов, охватывающих Древо Жизни. Несмотря на то, что до конца19-го века был описан широкий спектр организмов, к середине20-го века экспериментальные исследования стали ограничены горсткой из менее чем дюжины модельных организмов. С наступлением эры генома и целью секвенирования геномов всех видов в Древе Жизни1 мы теперь в состоянии расширить типы организмов, используемых для лабораторных экспериментов, и извлечь выгоду из их разнообразия. Такое расширение новых модельных организмов для экспериментов имеет предпосылку для возможности поддерживать их в лаборатории. Здесь описываются протоколы для выращивания одного из таких появляющихся новых/старых модельных организмов.
Большая часть животной жизни на Земле приходится на четыре сверхизлучения насекомых2. Среди насекомых насчитывается около 158 000 видов двукрылых (настоящих мух)3, из которых около 3000 видов входят в семейство Sciaridae (черные грибные комары)4. Плодовая муха дрозофила является наиболее тщательно изученной из двукрылых мух. Низшая двукрылая муха (Nematocera), Bradysia (ранее называвшаяся Sciara) coprophila, 200 миллионов лет назад отделилась от дрозофилы, которая является «высшей двукрылой» мухой (Brachycera). Таким образом, B. coprophila находится в выгодном таксономическом положении для сравнительных исследований с D. melanogaster (рис. 1). Кроме того, B. coprophila обладает многими уникальными биологическими особенностями, которые сами по себе заслуживают изучения 5,6,7. Многие из этих особенностей нарушают правило постоянства ДНК, согласно которому все клетки организма имеют одинаковое содержание ДНК. У B. coprophila (i) отцовский геном элиминируется на монополярном веретене при мужском мейозе I; (ii) при мужском мейозе II наблюдается недизъюнкция диады X; (iii) хромосомы, ограниченные зародышевой линией (L), элиминируются из сомы; и (iv) одна или две Х-хромосомы элиминируются на ранних стадиях развития эмбриона в зависимости от пола особи. Импринтинг хромосом для различения материнских и отцовских гомологов был впервые обнаружен у B. coprophila и играет роль во многих из этих событий элиминации хромосом. В дополнение к элиминации хромосом, еще один обход постоянства ДНК происходит посредством регулируемой в развитии, локус-специфичной амплификации ДНК в локусах затяжки ДНК в политенных хромосомах личиночных слюнных желез. Изучение этих уникальных особенностей требует лабораторного сопровождения B.coprophila; Подробности его содержания представлены здесь для облегчения таких исследований.
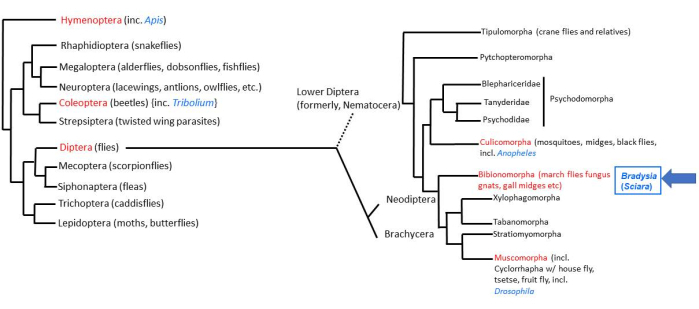
Рисунок 1: Филогения Bradysia (Sciara) coprophila. Популярные модельные организмы обозначены синим шрифтом, а их таксономический порядок — красным. Bradysia и другие комары Sciarid, а также комары относятся к низшим двукрылым (ранее подотряд Nematocera), тогда как виды дрозофил относятся к высшим двукрылым (подотряд: Brachysera). Информация в левой части рисунка взята из Misof et al.33; информация справа взята из Bertone et al.34 и Wiegmann et al.2. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Ранее род Sciara имел самое большое количество (700) видов среди всех эукариот, что побудило Стеффана разделить ихна 8. Впоследствии Шин предложил разделить семейство Sciaridae на подсемейство Sciarinae (с шестью родами, включающими Sciara, Trichosia и Leptosciarella), семейство Megalosphyinae (включая род Bradysia) и три другие группы (включая Pseudolycoriella)9. Филогения Sciaridae была дополнительно изучена несколькими группами в последние годы 9,10,11. За последние несколько десятилетий названия многих организмов семейства Sciaridae изменились12. Хотя большая часть литературы, охватывающей более ста лет, называет организм, который мы изучаем, Sciara coprophila, его нынешнее таксономическое название теперь Bradysia coprophila (син. Bradysia tilicola и другие синонимы)10. Они встречаются по всему миру и широко известны как грибные комары, поскольку едят грибы и другие грибы. Впервые они были описаны в 1804 году Мейгеном13 в Европе, а затем Иогансеном 14,15 в Северной Америке. B. coprophila была собрана в лаборатории Колд-Спринг-Харбор, а лабораторные запасы были созданы Чарльзом Метцем в начале 1900-х годов, когда он был аспирантом Колумбийского университета вместе с Томасом Хантом Морганом. Таким образом, нынешние поголовья отражают столетие инбридинга. Аналогичным образом, биология B. coprophila была дополнительно прояснена в результате десятилетий цитогенетических исследований Хелен Крауз (которая работала над докторской диссертацией вместе с Барбарой Мак-Клинток).
В 1930-х годах Bradysia (Sciara) конкурировала с Drosophila melanogaster в качестве модельной системы для генетических исследований. Несмотря на множество уникальных биологических особенностей, B. coprophila затмила D. melanogaster в качестве популярного модельного организма, поскольку радиационно-индуцированные фенотипические мутации были необходимы для генетических исследований и их было легче достичь в последнем, даже несмотря на то, что B. coprophila лишь немного более устойчива к гамма-облучению, чем D. melanogaster16. В современную эпоху геномики это уже не вызывает беспокойства. С тех пор как последовательность генома 17,18,19 (Урбан, Герби и Спрэдлинг, данные не показаны) и методы трансформации 20,21 (Ямамото и Герби, данные не показаны) для B. coprophila стали недавно, настало время использовать ее в качестве новой/старой модельной системы, как это видит растущее сообщество ученых, которые приняли ее в своих исследованиях. В данной статье описаны процедуры его лабораторного обслуживания.
У B. coprophila отсутствует Y-хромосома, а пол потомства определяется по матери. У самок с X’ («Х-прайм») хромосомой с длинной парацентрической инверсией будут только дочери, тогда как у самок, гомозиготных по стандартной (неинвертированной) Х-хромосоме, будет только 5 сыновей(рис. 2). Информация о последовательностях доступна для19-й Х-хромосомы, но молекулярный механизм еще предстоит выяснить, как Х-хромосома определяет, что потомство будет самкой. Самцы никогда не имеют X’-хромосомы, а после оплодотворения самки становятся X’X (гетерозиготными по X’) или XX. Взрослых самок X’X можно отличить от самок XX по фенотипическим маркерам на крыле (рис. 3). Самки X’X (у которых будут только дочери) могут быть распознаны по доминирующему маркеру волнистого (W) крыла на X’ (как у популяции HoLo2)22. В качестве альтернативы, самки XX (у которых будут только сыновья) могут быть распознаны по рецессивному миниатюрному (p) маркеру крыла на X, как в 91S stock23. В этом случае самки X’Xp будут иметь полноразмерные (не миниатюрные) крылья и будут иметь только дочерей. Сток 6980 несет рецессивный маркер на Х-хромосоме для опухших (sw) вен24, а также доминантный маркер Wavy на X’, позволяющий использовать два маркера для отбора для скрещивания. Степень экспрессии волнистого может варьироваться и кажется слабее в переполненных флаконах, где количество пищи ограничено или если температура становится слишком высокой. Фенотип волнистого крыла особенно силен, если личинки содержатся в холодном помещении (4°-8 °C) вместо обычных 21 °C. Несмотря на то, что рецессивный маркер малого крыла не является изменчивым и его очень легко идентифицировать, стаи 91S используются реже, поскольку они менее здоровы, чем стадо HoLo2. Схемы спаривания B. coprophila представлены здесь (Рисунок 2) и подробно описаны для популяций HoLo2, 7298 и W14 (Дополнительный файл 1), 91S (Дополнительная папка 1), 6980 (Дополнительная папка 1) и транслокационных популяций (Дополнительный файл 1). Запасы транслокаций больше не сохранились; они представляли собой реципрокные транслокации гетерохромомеров (H1, H2 и H3) на коротком плече X-хромомера, содержащем гены рибосомной РНК 25,26,27.
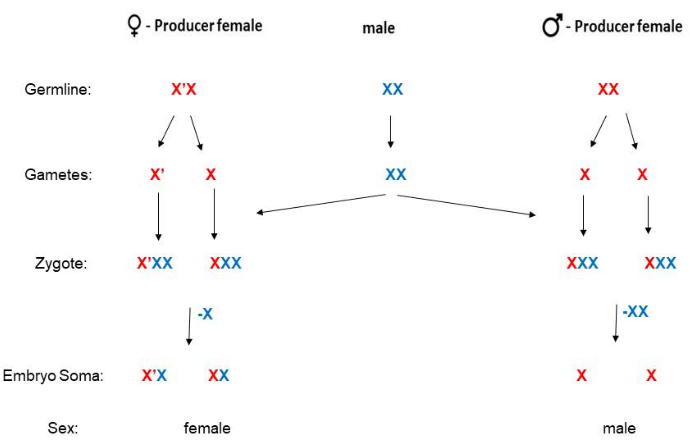
Рисунок 2: Схема спаривания B. coprophila. У этого организма нет Y-хромосомы (у самца сомы есть одна X); Матери определяют пол своего потомства. У матерей XX только сыновья, а у женщин X’X только дочери. Х-хромосома имеет длинную парацентрическую инверсию по сравнению с Х-хромосомой. Отцовская или материнская линия Х-хромосомы (или Х’) на этом рисунке обозначена синим или красным цветом соответственно. Сперматозоиды гаплоидны для аутосом, но имеют две копии Х-хромосомы из-за нерасхождения при мейозе II. Соматическая линия ранних эмбрионов исключает одну или две копии Х-хромосом, полученных по отцовской линии, если они будут женского или мужского пола соответственно. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Фенотипы крыльев B. coprophila. Взрослые самки мух показаны с различными фенотипами крыльев: (А) прямокрылые (XX), (В) волнистые (X’WX), (В) экстремальные волнистые крылья (X’WX) фенотипы, которые имеют сморщенный вид после накопления личинок в холодном room, (D) миниатюрные крылы (XpXp), которые являются рудиментарными, (E) прямое крыло с диким типом (XX) и не вздутыми жилками, (F) прямое крыло с вздутыми прожилками (XswXsw), где маленькие пузырьки (черные стрелки) появляются на верхнем крае крыла и/или возле кончика обоих крыльев, (G) крайний пример вздутия, когда волдырь (белая стрелка) встречается на одном или обоих крыльях. У самцов отсутствует X-хромосома, и поэтому у них никогда не будет волнистых крыльев, но у них есть миниатюрные или опухшие крылья у 91S или 6980 соответственно. Масштабная линейка = 1 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Цель содержания поголовья состоит в том, чтобы проводить скрещивания, в которых половина скрещиваний происходит от матерей-самок, а половина скрещивания от матерей-производителей-самцов, чтобы иметь равное количество взрослых самок и самцов в следующем поколении для последующих скрещиваний. Однако это также включает в себя планирование, поскольку жизненный цикл у самцов короче, чем у самок, а взрослые самцы появляются на неделю раньше взрослых самок. Природа приспосабливается к этой асинхронности между полами, заставляя мужские эмбрионы появляться в виде личинок через 1-2 дня после женских личинок от скрещивания в ту же дату. Тем не менее, чтобы гарантировать, что взрослые особи самцов и самки доступны одновременно для лабораторных скрещиваний, развитие самок может быть несколько ускорено, если оставлять флаконы с личинками самок при комнатной температуре, а не при 21 °C, или размещать флаконы с личинками самцов при несколько более низких температурах (например, 16 °C). Другой способ, который является более надежным, – это скрещивание с матерями-женщинами-производителями в понедельник и скрещивание с матерями-мужчинами-производителями в пятницу на той же неделе. Самый простой путь, который мы используем, заключается в том, чтобы проводить скрещивание с самками-производителями и самцами-производителями в один и тот же день каждую неделю и выполнять скрещивание в этот день в течение каждой последующей недели. При таком подходе взрослые самки от скрещивания на 1-й неделе могут быть спарены со взрослыми самцами, которые появились от скрещивания на 2-й неделе.
Жизненный цикл самки B. coprophila составляет 5 недель при выращивании при 21 °C (Таблица 1). Продолжительность их жизненного цикла несколько увеличивается при более низких температурах или при недостаточном кормлении. Жизненный цикл самцов B. coprophila составляет ~4-4,5 недели, так как они окукливаются на 0,5-1 неделю раньше самок. Окончание каждой личиночной стадии отмечается сбрасыванием кутикулы, которое провоцируется всплеском уровня стероидного гормона экдизона. В отличие от D. melanogaster, у которого три личиночных возраста, у B. coprophila четыре личиночных возраста.
| Стадия развития | Количество дней после вязки (dpm) | Продолжительность этапа (дней) |
| Снесенное яйцо | 1-2 | |
| Эмбрион | С 1-2 по 7-8 | ~7 дней |
| Личинка | ||
| Возрасты личинок 1, 2 и 3 | с 7-8 по 16-19 | ~10 |
| Предглазное пятно 4-го личиночного возраста | с 16-19 по 21-24 | 5 |
| 4-я стадия пятен глазного пятна личиночного возраста | с 21-24 по 25-28 | 4 |
| Куколка | с 25-28 по 30-33 | 5 |
| Взрослый | живет 1-2 дня при 21 °C при спаривании или 2-3 недели при 16 °C при отсутствии спаривания. | |
Таблица 1: Жизненный цикл самок B. coprophila при 21 °C.
B. coprophila может содержаться в любом месте в диапазоне от 15 °C до 25 °C, при этом развитие протекает медленнее при более низких температурах. Это насекомое предпочитает влажную среду (находящееся в почве комнатных растений или грибных грядок), поэтому мы держим в инкубаторе стакан с деионизированной водой. B. coprophila можно хранить при комнатной температуре в металлической хлебнице со слабо прилегающей крышкой, содержащей стакан с водой, но они подвергаются тепловому шоку при 37 °C28, что представляет опасность в жарком климате. Майкл Эшбернер и другие безуспешно пытались хранить D. melanogaster в холоде, чтобы сократить время, необходимое для хранения запасов. В отличие от этого, основным преимуществом B. coprophila является то, что флаконы с личинками средней стадии могут храниться до 3 месяцев на открытой полке в холодном помещении (4-8 °C) с минимальным уходом, кормлением только один раз в месяц. Они развиваются чрезвычайно медленно на холоде вплоть до стадии куколки и становятся фертильными взрослыми особями, когда флаконы возвращаются к температуре 21 °C. Предположительно, это имитирует их зимовку в дикой природе. Эта задержка развития, вызванная холодом, может быть сравнима с той, которая наблюдается после гамма-облучения личинок B. coprophila 16 на средней стадии, но задержка развития не наблюдается у личинок поздних стадий, которые прошли точку невозврата для их нормального прогресса в развитии.
Protocol
Representative Results
Discussion
Представленные здесь протоколы по разведению B. coprophila будут полезны ученым, желающим выращивать этот организм в своих лабораториях для проведения экспериментов по изучению его уникальных биологических особенностей. Первоначальное описание метода кормления с использованием дрожжей и грибного порошка, посыпанных на агаровую основу для поддержания B. coprophila29 , было использовано в лаборатории Меца для выращивания 14 различных видов мух Sciarid5. Впоследствии было замечено, что добавление порошка крапивы и/или шпината еще больше увеличивает жизнеспособность B. coprophila (Gabrusewycz-Garcia, личное сообщение). Эти методы оказались успешными для поддержания родственных видов в семействе Sciaridae, включая Bradysia impatiens и Lycoriella ingenua , которые в настоящее время находятся в культуре (Роберт Бэрд, личное сообщение).
Другие методы (такие как альтернативные методы кормления, описанные ниже) были опробованы для выращивания B. coprophila, но описанные здесь протоколы были оптимизированы для получения наиболее благоприятного соотношения личинок на площадь поверхности агара для получения наиболее фертильного жира взрослых особей и минимизации роста плесени. Для увеличения масштаба массовое сопряжение может быть выполнено в стеклянных флаконах, как описано в протоколе 2 выше. В качестве альтернативы, несколько (2-4) взрослых самок могут быть помещены вместе с вдвое большим количеством взрослых самцов в колбу, подобную той, которая используется для выращивания дрозофилы (одноразовая полипропиленовая бутылка дрозофилы с квадратным дном объемом 6 унций = 177,4 мл квадратного дна). В обоих случаях исследователь должен быть полностью уверен в том, что в колбе находятся только все матери-самки или все матери-мужчины-производители.
Кормите только личинок, так как куколки и взрослые особи не едят. Не кормите флакон, если личинки превратились в куколок (признаком этого является появление первых рано появившихся взрослых мух). Как только взрослые особи закроются, поместите флаконы в более холодный инкубатор (например, 16 °C), если это возможно, так как это позволит взрослым особям жить дольше. Кормите три раза в неделю (например, в понедельник, среду, пятницу), увеличивая количество пищи, даваемой в одном флаконе, по мере взросления личинок. Кормите щедро, и вы будете вознаграждены жирными плодовитыми взрослыми особями. Однако, если вы кормите слишком много, появится белая плесень, а это признак того, что нужно уменьшить количество пищи, которую вы кладете во флакон. Кроме того, если вы будете кормить слишком много, на верхней части агара разовьется толстая подушечка с кормом, которая затруднит выход взрослых особей (вы можете удалить прокладку с помощью щипцов, но будьте осторожны, чтобы не вытащить личинки с помощью прокладки — лучше вообще не делать этого). Флаконы с небольшим количеством личинок (с пометкой «мало») нуждаются в меньшем количестве корма. Если кормить слишком мало, личинки будут карабкаться по стенкам флакона в поисках пищи. Недокормленные личинки приводят к появлению мелких взрослых особей, которые менее плодовиты.
Альтернативные способы кормления
Были опробованы различные методы, чтобы кормить личинок только один раз в течение личиночной стадии, а не 3 раза в неделю. B. coprophila не будет расти на пище в стиле дрозофилы . Джон Урбан (личное сообщение) попытался смешать пищу B. coprophila с агаром, но плесень выросла слишком сильно. Он обнаружил, что добавление двух ингибиторов плесени (тегосепта и пропионовой кислоты) в комбинации и по отдельности, пробуя несколько различных концентраций, было токсичным для B. coprophila в количествах, которые ингибируют плесень. Агар должен иметь pH 6-7 (нейтральный), так как B. coprophila заболевает при кислом pH (как при пропиановой кислоте). В качестве альтернативы, чтобы избежать трехкратного кормления в неделю, он пытался с помощью шпателя или шприца без иглы рассыпать густую дрожжевую пасту (активные сухие дрожжи Red Star, смешанные с небольшим количеством дистиллированной воды, чтобы увлажнить ее) в виде ложки поверх агара в каждом флаконе через неделю после спаривания (т.е. примерно в то время, когда личинки начнут появляться).
Еще один способ избежать трехкратного кормления в неделю — добавить в каждый флакон живую культуру грибов. Бат и Спонслер37 сообщили, что наклонная поверхность агара со средой Сабуро должна быть испещрена грибной культурой родов Chaetoconidia (лучшая) или же Baplosporangia или Xllescheria. Гриб выращивали от нескольких дней до одной недели до появления B. coprophila . После этого кормление не понадобилось в этом. Вариант этого метода также использовала Эллен Раш (личное общение). В наших руках флаконы оказались слишком влажными при таком способе и личинки утонули, но можно было попробовать еще раз для оптимизации количества личинок относительно флаконов с живыми грибами.
Артур Форер (личное сообщение) добился некоторого успеха в выращивании B. coprophila так же, как журавль летает38. При таком подходе куколки выращивались на влажном папье-маше. Впоследствии взрослые особи спаривались, а яйца откладывались на свежем влажном папье-маше. Образовавшихся личинок держали на папье-маше в чашках Петри и кормили порошкообразными листьями крапивы два раза в неделю. Куколок помещали в клетку для повторения цикла.
Юкико Ямасита (личное сообщение) безуспешно пыталась вырастить B. coprophila на почве, имитируя условия, где они встречаются в природе в горшечных растениях и теплицах с повышенной влажностью. Однако плесень может стать проблемой при повышении уровня влажности. Тем не менее, влажная почва с успехом использовалась для выращивания личинок Pseudolycoriella (ранее Bradysia) hygida в пластиковых ящиках с влажной почвой; их кормят разложившимися листьями Ilex paraguariensis, дополняя в позднюю личиночную жизнь 1,2% дрожжевым экстрактом, 1,4% кукурузным крахмалом, 0,8% овсяной мукой, 1,2% агаром12. Точно так же влажную почву можно заменить влажным торфяным мхом с измельченной фасолью для разведения мух Sciarid39,40.
Для поддержания лабораторных культур брадызии применялись и другие методы: (i) автоклавный картофель, в который добавляют дрожжи и удобрение для сухой крови41; (ii) навоз 42,43,44, к которому может быть добавлена засохшая кровь 45; (iii) пластиковые контейнеры с ватными дисками и смоченными бумажными полотенцами с молотыми соевыми бобами46.
Клещей
Клещи могут переноситься от дрозофилы к B. coprophila. Чтобы свести это к минимуму, лучше всего содержать B. coprophila в отдельном инкубаторе или комнате, не близко к запасам дрозофилы . Кроме того, проводите любые работы по поддержанию B. coprophila в начале дня перед обращением с дрозофилами. Клещи также могут переноситься на B. coprophila от комнатных растений, поэтому не держите растения в одной комнате с B. coprophila. Если клещи проникают во флаконы, их можно увидеть в виде маленьких белых сферических организмов, ползающих по телу B. coprophila. Химические обработки, которые уничтожают клещей у дрозофилы , не могут быть использованы для B. coprophila , поскольку химические вещества убивают B. coprophila (B. coprophila также чувствительна к органическим парам, таким как фенол). Единственным средством для избавления запасов B. coprophila от клещей является ручной сбор эмбрионов на агаровой пластине, осмотр каждого на отсутствие клещей, а затем перенос их в свежие агаровые флаконы с помощью тонкой кисти. Марлевые пробки с хлопчатобумажным наполнителем и пенопластовые пенопласты из ацетата целлюлозы (используемые для полипропиленовых флаконов дрозофилы ) помогают предотвратить попадание клещей внутрь флаконов.
Полезность протоколов содержания
Описанные здесь протоколы позволят растущему сообществу ученых выращивать B. coprophila в качестве нового/старого модельного организма для изучения его уникальных биологических особенностей. Новым лабораторным группам предлагается присоединиться к растущему сообществу для поддержания и исследования уникальных биологических особенностей Bradysia (Sciara).
Divulgations
The authors have nothing to disclose.
Acknowledgements
Особая благодарность предыдущим владельцам скота B. coprophila (Джейкобу Э. Блиссу, Пауле Боназинга, Энн В. Керреброк, Ингрид М. Мерсер, Хайди С. Смит) и научному персоналу (особенно Роберту Бэрду, Майклу С. Фоулку, Донне Кубаи, Джону М. Урбану, Ютаке Ямамото) за тонкую настройку протоколов содержания. Первоначальные инструкции по уходу за B. coprophila были предоставлены Хелен В. Крауз, Натальей Габрусвич-Гарсия, Ребой М. Гудманом, Чарльзом В. Метцем и Эллен Раш. С благодарностью Юкико Ямасите и Энн В. Керреброк за то, что они взяли на себя управление стоковым центром Bradysia (Sciara). Выражаем глубокую признательность следующим людям за их полезную подготовку рисунков: Брайану Вигману (Рисунок 1), Джону М. Урбану (Рисунок 4 , верхняя панель), Лоре Росс (Рисунок 4 , нижняя панель), Ютаке Ямамото (Рисунок 5 , левая панель), Лео Кадоте (Рисунок 7 и Рисунок 8). Большое спасибо Аве Филисс и Многопрофильной лаборатории Университета Брауна за помощь в фото- и видеосъемке. Выражаю благодарность Роберту Бэрду за комментарии к этой рукописи. Наши исследования и поддержка B. coprophila были поддержаны NIH и NSF, включая самую последнюю поддержку от NIH GM121455 S.A.G. Более подробная информация о B. coprophila доступна на веб-сайтах Bradysia (Sciara) Stock Center (https://sites.brown.edu/sciara/ и https://sciara.wi.mit.edu), которые в настоящее время находятся в стадии строительства.
Materials
| Agar (bacteriological) | U.S. Biological | A0930 | https://www.usbio.net; |
| CO2 FlyStuff Foot Pedal | Genesee Scientific | 59-121 | |
| CO2 FlyStuff Blowgun | Genesee Scientific | 54-104 | |
| CO2 FlyStuff UltimaterFlypad | Genesee Scientific | 59-172 | https://www.geneseesci.com |
| Ether fume hood | Labconco | 3955220 | Sits on top of lab bench |
| Filter replacement cat # 6961300 | |||
| Food: Brewer’s Yeast Powder | Solgar | Obtain from Amazon or health food store | |
| https://www.solgar.com; | |||
| Food: Nettle Powder (pesticide free) | Starwest Botanicals | 209460-51 | |
| Food: Shitake Mushrooms (pesticide free) | Starwest Botanicals | 202127-5 | https://www.starwest-botanicals.com; |
| Food: Spinach Powder ( pesticide free) | Starwest Botanicals | 209583-5 | |
| Food: Straw (pesticide free ) | Starwest Botanicals | 209465-3 | |
| Jar: clear glass, polypropylene lid | Fisher Scientific: | FB02911765 | 73 mm dia, 89 mm ht (240 ml) https://www.fishersci.com; |
| Needle Probe, wooden handle | US Geo Supply Inc | SKU: 4190 | 5.75” long probe, stainless steel needle https://usgeosupply.com; (970)-434-3708 |
| Vials: glass, preferred: | Wilmad LabGlass | ||
| Wilmad-glass custom vials | 28-33 mm inner dia, 33 mm outer dia, 9.5 cm ht Wilmad: https://www.SP-WilmadLabglass.com |
||
| Vials: glass (cheaper and ok) | Fisher Scientific | 03-339-26H | 29 mm outer dia, 9.5 cm h https://www.fishersci.com; |
| Vials: glass (a bit narrow) | Genesee Scientific | 32-201 | 24.5 mm outer dia,9.5 cm h thttps://www.geneseesci.com |
| Vials: polypropylene | Genesee Scientific | 32-114 | 28.5 mm outer dia,9.5 cm ht |
| Vial Plugs | |||
| roll of non-absorbent cotton | Fisher Scientific | 22-456881 | |
| cheesecloth | Fisher Scientific | 22-055053 | https://www.fishersci.com; |
References
- Lewin, H. A., et al. Earth BioGenome project: Sequencing life for the future of life. Proc Natl Acad Sci USA. 115 (17), 4325-4333 (2018).
- Wiegmann, B. M., et al. Episodic radiations in the fly tree of life. Proc Nat Acad Sci USA. 108 (14), 5690-5695 (2011).
- Yeates, D. K., Wiegmann, B. M. Phylogeny of Diptera. Manual of Afrotropical Diptera.Suricata. 3, 149-161 (2017).
- Vilkamaa, P., Burdíková, N., Ševčík, J. The genus Spinopygina gen. nov. (Diptera, Sciaridae) from Western North America: Preliminary molecular phylogeny and description of seven new species. Insects. 14 (2), 173 (2023).
- Metz, C. W. Chromosome behavior, inheritance and sex determination in Sciara. Amer Naturalist. 72 (743), 485-520 (1938).
- Gerbi, S. A., Hennig, N. Unusual chromosome movements in Sciarid flies. Results and Problems in Cell Differentiation. Vol 13 Germ Line – Soma Differentiation. 13, 71-104 (1986).
- Gerbi, S. A., Larracuente, A., Hanlon, S. Non-random chromosome segregation and chromosome eliminations in the fly Bradysia (Sciara). 34;Non-Mendelian Inheritance and Meiotic Drive.", Chromosome Research.(special issue). 30, 273-288 (2022).
- Steffan, W. A. A generic revision of the family Sciaridae (Diptera) of America North of Mexico. University of California Publications in Entomology. 44, 1-77 (1966).
- Shin, S., Jung, S., Menzel, F., Heller, K., Lee, H. Molecular phylogeny of black fungus gnats (Diptera: Sciaroidea: Sciaridae) and the evolution of larval habitats. Molec Phylogenetics Evolution. 66 (3), 833-846 (2013).
- Mohrig, W., Heller, K., Hippa, H., Vilkamaa, P., Menzel, F. Revision of the black fungus gnats (Diptera: Sciaridae) of North America. Studia Dipterologica. 19 (1-2), 141-286 (2013).
- Ševčík, J., et al. Molecular phylogeny of the megadiverse insect infraorder Bibionomorpha sensu lato (Diptera). PeerJ. 4, e2563 (2016).
- Menzel, F., et al. Pseudolycoriella hygida (Sauaia and Alves)-An overview of a model organism in genetics, with new aspects in morphology and systematics. Insects. 15 (2), 118 (2024).
- Meigen, J. W. . Klassifikazion und Beschreibung der europäischen zweiflügligen Insekten (Diptera Linn). 1 (1), (1804).
- Johannsen, O. A. The fungus gnats of North America part I. Maine Agricultural Experimental Station Bulletin. 172, 209-276 (1909).
- Johannsen, O. A. Mycetophilidae of North America. Maine Agricultural Experimental Station Bulletin. 200, 57-146 (1912).
- Urban, J. M., et al. Bradysia (Sciara) coprophila larvae up-regulate DNA repair pathways and down-regulate developmental regulators in response to ionizing radiation. Génétique. (3), (2024).
- Hodson, C. N., Jaron, K. S., Gerbi, S., Ross, L. Gene-rich germline-restricted chromosomes in black-winged fungus gnats evolved through hybridization. PLoS Biology. 20 (2), e3001559 (2021).
- Urban, J. M., et al. High contiguity de novo genome assembly and DNA modification analyses for the fungus fly, Sciara coprophila, using single-molecule sequencing. BMC Genomics. 22, 643 (2021).
- Baird, R. B., et al. Recent evolution of a maternally acting sex-determining supergene in a fly with single-sex broods. Mol Biol Evol. 40 (7), (2023).
- Yamamoto, Y., Gerbi, S. A. Making ends meet: targeted integration of DNA fragments by genome editing. Chromosoma. 127 (4), 405-420 (2018).
- Yamamoto, Y., Gerbi, S. A. Development of transformation for genome editing of an emerging model organism. Genes. 13 (7), 1108-1124 (2022).
- Metz, C. W., Smith, H. B. Further observation on the nature of the x-prime (X’) chromosome in Sciara. Proc Nat Acad Sci USA. 17 (4), 195-198 (1931).
- Crouse, H. V. X-ray induced sex-linked recessive lethals and visibles in Sciara coprophila. Amer Naturalist. 95 (880), 21-26 (1961).
- Metz, C. W., Ullian, S. S. Genetic identification of the sex chromosomes in Sciara (Diptera). Proc Nat Acad Sci USA. 15 (2), 82-85 (1929).
- Crouse, H. V. X heterochromatin subdivision and cytogenetic analysis in Sciara coprophila (Diptera, Sciaridae). I. Centromere localization. Chromosoma. 63, 39-55 (1977).
- Crouse, H. V., Gerbi, S. A., Liang, C. M., Magnus, L., Mercer, I. M. Localization of ribosomal DNA within the proximal X heterochromatin of Sciara coprophila (Diptera, Sciaridae). Chromosoma. 64 (4), 305-318 (1977).
- Crouse, H. V. X heterochromatin subdivision and cytogenetic analysis in Sciara coprophila (Diptera, Sciaridae). II. The controlling element. Chromosoma. 74, 219-239 (1979).
- Mok, E. H., et al. Maintenance of the DNA puff expanded state is independent of active replication and transcription. Chromosoma. 110 (3), 186-196 (2001).
- Smith-Stocking, H. Genetic studies on selective segregation of chromosomes in Sciara coprophila Lintner. Génétique. 21 (4), 421-443 (1936).
- Gabrusewycz-Garcia, N. Cytological and autoradiographic studies in Sciara coprophila salivary gland chromosomes. Chromosoma. 15, 312-344 (1964).
- Wu, N., Liang, C., DiBartolomeis, S. M., Smith, H. S., Gerbi, S. A. Developmental progression of DNA puffs in Sciara coprophila: amplification and transcription. Dev Biol. 160 (1), 73-84 (1993).
- Yamamoto, Y., Gustafson, E. A., Foulk, M. S., Smith, H. S., Gerbi, S. A. Anatomy and evolution of a DNA replication origin. Chromosoma. 130 (2-3), 199-214 (2021).
- Misof, B., et al. Phylogenomics resolves the timing and pattern of insect evolution. Science. 346 (6210), 763-767 (2014).
- Bertone, M. A., Courtney, G. W., Wiegmann, B. M. Phylogenetics and temporal diversification of the earliest true flies (Insecta: Diptera) based on multiple nuclear genes. Syst Entomol. 33, 668-687 (2008).
- de Saint Phalle, B., Sullivan, W. Incomplete sister chromatid separation is the mechanism of programmed chromosome elimination during early Sciara coprophila embryogenesis. Development. 122 (12), 3775-3784 (1996).
- de Saint Phalle, B., Oldenbourg, R., Kubai, D., Salmon, E. D., Gerbi, S. A. Paternal chromosome elimination and X non-disjunction on asymmetric spindles in Sciara male meiosis. BioRxiv. , (2021).
- Bath, J. D., Sponsler, O. L. An alternative method for the culture of Sciara larvae. Science. 109 (2828), 255 (1949).
- Forer, A. Crane fly spermatocytes and spermatids: A system for studying cytoskeletal components. Methods Cell Biol. 25, 227-252 (1982).
- Gillespie, D. R. A simple rearing method for fungus gnats Corynoptera sp. (Diptera: Sciaridae) with notes on life history. J Entomol Soc Br Colum. 83, 45-48 (1986).
- Gardiner, R. B., Jarvis, W. R., Shipp, J. L. Ingestion of Pythium spp. by larvae of the fungus gnat Bradysia impatiens (Diptera: Sciaridae). Ann Appl Biol. 116, 205-212 (1990).
- Hungerford, H. B. Sciara maggots injurious to potted plants. J Econ Entomol. 9 (6), 538-549 (1916).
- Thomas, C. A. A method for rearing mushroom insects and mites. Entomol News. 40, 222-225 (1929).
- Austin, M. D., Pitcher, R. S. A laboratory method for rearing Sciara and phorid flies. Entomol Mon Mag. 72, 12-15 (1936).
- Butt, F. H., Galtsoff, P. S., Lutz, F. E., Welch, P. S., Needham, J. G. Culture of Sciara. Culture methods for invertebrate animals. , 400-401 (1937).
- Hudson, E. K. Regulation of greenhouse sciarid fly populations using Tetradonema plicans (Nematoda: Mermithoidea). J Invert Pathol. 23 (1), 85-91 (1974).
- Wilkinson, J. D., Daughterty, D. M. Comparative development of Bradysia impatiens (Diptera: Sciaridae) under constant and variable temperatures. Ann Entomol Soc Am. 63 (4), 1079-1083 (1970).

