Gene Transfection verso Celle sferoide su lastre micropatterned coltura per trapianto di cellule geneticamente modificati
Summary
This protocol describes a cell transplantation system using genetically modified, injectable spheroids. Cell spheroids are cultured on micropatterned culture plates and recovered after gene introduction using polyplex nanomicelles. This system facilitates prolonged transgene expression from the transplanted cells in host animals while maintaining the innate function of the cells.
Abstract
Per migliorare l'efficacia terapeutica del trapianto di cellule, è stato sviluppato un sistema di trapianto di geneticamente modificati, sferoidi iniettabili. Gli sferoidi cellule vengono preparati in un sistema di coltura su piastre micropatterned rivestiti con un polimero termosensibile. Un certo numero di sferoidi sono formate sulle piastre, corrispondenti alle aree di adesione cellulare di 100 micron di diametro che sono regolarmente schierati in modo bidimensionale, circondate da aree non-adesive che sono rivestiti da un polietilenglicole (PEG) di matrice. Gli sferoidi possono essere facilmente recuperati da una sospensione liquida abbassando la temperatura delle piastre, e la loro struttura è ben mantenuto facendoli passare attraverso gli aghi di iniezione con una sufficientemente grosso calibro (over 27 G). La modificazione genetica è ottenuta gene trasfezione utilizzando il vettore originale non virale gene, nanomicelle Polyplex, che è in grado di introdurre geni nelle cellule senza distruggere la struttura sferoidale. Per primsferoidi epatociti ary trasfettate con un gene luciferasi che esprimono, la luciferasi è sostenibile ottenuti in animali trapiantati, con funzione di epatociti conservata, come indicato dall'espressione albumina. Questo sistema può essere applicato ad una varietà di tipi cellulari, comprese le cellule staminali mesenchimali.
Introduction
La terapia di trapianto cellulare ha attirato l'attenzione diffusa per il trattamento di varie malattie incurabili. L'attività e l'emivita dei fattori bioattivi che sono secreti dalle cellule trapiantate sono essenziali per migliorare l'efficacia terapeutica di un sistema di trapianto di cellule. La modificazione genetica delle cellule prima del trapianto è una tecnica utile per regolare e manipolare funzioni cellulari, compresa la secrezione dei fattori bioattivi. E 'anche importante mantenere un microambiente favorevole per le cellule per evitare la morte cellulare o perdita di attività cellulare. Tridimensionale coltura (3D) cellule sferoidale, in quale cella-cellula interazioni sono ben conservate, è promettente per questo scopo, ad esempio, per migliorare la secrezione di albumina da epatociti primari e promuovendo multi-lineage differenziazione da cellule staminali mesenchimali (MSC ) 1-7.
In questo studio, un sistema di nuova combinazione di spheroid cultura e trasfezione genica viene utilizzata per servire da piattaforma per il trapianto di cellule geneticamente modificate. Per creare cellule sferoidali, viene utilizzato un sistema di coltura sferoide su piastre di coltura micropatterned. Su queste piastre, aree di adesione cellulare di 100 micron di diametro sono regolarmente disposte in maniera bidimensionali e sono circondati da zone non adesivi rivestiti da una matrice PEG 3. Seminando un adeguato numero di cellule, array di sferoidi 3D di 100 micron di diametro sono formati corrispondenti al letto coltura micropatterned.
Gli sferoidi siano recuperati senza distruggerne la struttura 3D utilizzando piastre di coltura cellulare termosensibili, che sono stati rivestiti con un polimero termosensibile, poli (iso-propylacrylamide) (PIPAAm) 8-10. L'architettura micropatterned è costruito sulle piastre termosensibili (su misura costruito). Semplicemente abbassando la temperatura delle piastre, gli sferoidi sono staccati dal letto coltura e disperdonod in tampone fosfato (PBS). Pertanto, un gran numero di sferoidi con dimensioni uniformi di 100 micron può essere ottenuto sotto forma di una sospensione iniettabile.
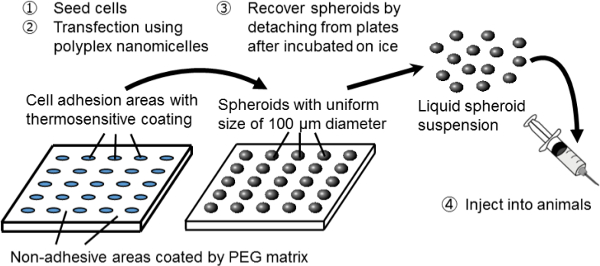
Figura 1. Rappresentazione schematica del sistema di coltura sferoide su un piatto micropatterned. La modificazione genetica è ottenuta mediante trasfezione genica utilizzando il vettore non virale gene originale, nanomicelle Polyplex. E 'composto da DNA plasmidico (pDNA) e polietilene glicole (PEG) blocchi -polycation copolimeri 11. Questi hanno una struttura core-shell caratteristica costituito da un guscio di PEG e un nucleo interno di pDNA condensata, permettendo sicuro ed efficace introduzione del gene nelle cellule a scopo terapeutico 11. Cliccate qui per vedere una versione più grande di This figura.
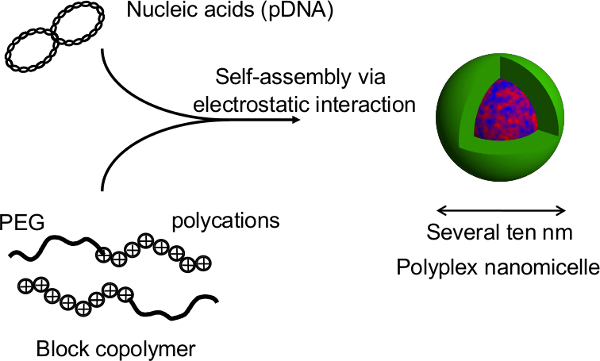
Figura 2. Struttura del nanomicelle Polyplex formata dal complesso di acidi nucleici e copolimeri a blocchi PEG-block-policatione. In questo studio, il vantaggio principale di questa tecnica è che la struttura sferoidale non interrompere durante gene trasfezione dai nanomicelles. Dopo trasfezioni nanomicelle-mediata di ratto sferoidi epatociti primari, l'espressione del transgene prolungata è ottenuto per più di un mese con la secrezione di albumina continuo dagli epatociti ad un livello paragonabile a quello di sferoidi untransfected 12. L'espressione del transgene e la secrezione di albumina da sferoidi sono mantenuti dopo il recupero dalle piastre termosensibili. E 'evidente che nanomicelles possono facilitare tranquillamente introduzione gene senza compromettere le funzioni innate della HEPatocytes. Pertanto, la combinazione di cellule sferoidali coltivate su piastre micropatterned termosensibili con introduzione del gene utilizzando nanomicelles è una piattaforma promettente per il trapianto di cellule geneticamente modificate. Cliccate qui per vedere una versione più grande di questa figura.
Protocol
Representative Results
Discussion
In questo protocollo, è fondamentale per mantenere la struttura 3D della sferoidi durante le fasi di introduzione del gene e recupero sferoidale. È essenziale mantenere un microambienti favorevoli per le celle per evitare la morte cellulare o perdita di attività cellulare. Ad esempio, la secrezione di albumina, una funzione rappresentativa innata di epatociti, è ben conservata in sferoidi epatociti, mentre gli epatociti in coltura monostrato convenzionali perdono rapidamente la loro capacità secretoria pochi giorni…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Apprezziamo profondamente il dottor Takeshi Ikeya e personale tecnico Toyo Gosei, Tokyo, Giappone per la fornitura di piastre di coltura micropatterned termosensibili e pareri scientifici. Ringraziamo anche la signora Satomi Ogura, la signora Sae Suzuki, la signora Asuka Miyoshi e la signora Katsue Morii per l'assistenza tecnica con la sperimentazione animale. Questo lavoro è stato sostenuto finanziariamente in parte dal JSPS KAKENHI Grant-in-Aid per la ricerca scientifica, il Centro per l'Innovazione (COI) Programma e il programma di innovazione S- dal Giappone Scienza e della Tecnologia Agency (JST), e il JSPS Core- a-Core Programma, A. Ricerca reti avanzate.
Materials
| Pen-Strep-Glut | GIBCO | ||
| Dexamethasone | Wako Pure Chemical Industries | 041-18861 | |
| Nicotinamide | Wako Pure Chemical Industries | 141-01202 | |
| Hank’s buffered salt and L-ascorbic acid 2-phosphate (Asc-2P) | Sigma-Aldrich | A8960 | |
| Human epidermal growth factor (hEGF) | Toyobo | PT10015 | |
| Cell-able multi-well plates | Toyo Gosei | PP-12 | |
| Thermosensitive cell culture plates (Upcell) | CellSeed Inc | The micropatterned architecture is constructed on the thermosensitive plates (custom-built by Toyo Gosei) | |
| Lipid-based transfection reagent (FuGENE HD) | Promega | E2311 | |
| Renilla Luciferase Assay System | Promega | E2810 | |
| pGL4 Luciferase Reporter Vector | Promega | E6651 | |
| pDNA expressing Gaussia luciferase | New England BioLabs | N8082S | |
| Mouse erhthropoietin-expressing vector | Origene | MC208445 | |
| pCAG-GS | Kindly provided by Laboratory for Pluripotent Cell Studies, Center for Developmental Biology, RIKEN | ||
| Escherichia coli DH5α competent cells | Takara | 9057 | |
| Endotoxin-free plasmid DNA purification system | Nippon Genetics | NucleoBond Xtra EF | |
| collagenase | Wako Pure Chemical Industries | 639-00951 | |
| trypsin inhibitor | GIBCO | R-007-100 | |
| Luminometer | Promega | GloMax™ 96 Microplate Luminometer | |
| IVIS Imaging System | Xenogen Corp. | Xenogen IVIS Spectrum in vivo imaging system | |
| blood sample analyzer | Sysmex | pocH-100i Automated Hematology Analyzer |
Riferimenti
- Landry, J., Bernier, D., Ouellet, C., Goyette, R., Marceau, N. Spheroidal aggregate culture of rat liver cells: histotypic reorganization, biomatrix deposition, and maintenance of functional activities. J Cell Biol. 101 (3), 914-923 (1985).
- Yuasa, C., Tomita, Y., Shono, M., Ishimura, K., Ichihara, A. Importance of cell aggregation for expression of liver functions and regeneration demonstrated with primary cultured hepatocytes. J Cell Physiol. 156 (3), 522-530 (1993).
- Otsuka, H., et al. Two-dimensional multiarray formation of hepatocyte spheroids on a microfabricated PEG-brush surface. Chembiochem. 5 (6), 850-855 (2004).
- Wang, W., et al. 3D spheroid culture system on micropatterned substrates for improved differentiation efficiency of multipotent mesenchymal stem cells. Biomaterials. 30 (14), 2705-2715 (2009).
- Bartosh, T. J., et al. Aggregation of human mesenchymal stromal cells (MSCs) into 3D spheroids enhances their antiinflammatory properties. Proc Natl Acad Sci U S A. 107 (31), 13724-13729 (2010).
- Frith, J. E., Thomson, B., Genever, P. G. Dynamic three-dimensional culture methods enhance mesenchymal stem cell properties and increase therapeutic potential. Tissue Eng Part C Methods. 16 (4), 735-749 (2010).
- Nakasone, Y., Yamamoto, M., Tateishi, T., Otsuka, H. Hepatocyte spheroids underlayered with nonparenchymal cells for biomedical applications. IEICE Transactions on Electronics. E94, 176-180 (2011).
- Nishida, K., et al. Corneal reconstruction with tissue-engineered cell sheets composed of autologous oral mucosal epithelium. N Engl J Med. 351 (12), 1187-1196 (2004).
- Ohashi, K., et al. Engineering functional two- and three-dimensional liver systems in vivo using hepatic tissue sheets. Nat Med. 13 (7), 880-885 (2007).
- Sekine, H., et al. Cardiac cell sheet transplantation improves damaged heart function via superior cell survival in comparison with dissociated cell injection. Tissue Eng Part A. 17 (23-24), 2973-2980 (2011).
- Itaka, K., Kataoka, K. Progress and prospects of polyplex nanomicelles for plasmid DNA delivery. Curr Gene Ther. 11 (6), 457-465 (2011).
- Endo, T., Itaka, K., Shioyama, M., Uchida, S., Kataoka, K. Gene transfection to spheroid culture system on micropatterned culture plate by polyplex nanomicelle: a novel platform of genetically-modified cell transplantation. Drug Deliv and Transl Res. 2 (5), 398-405 (2012).
- Howard, R. B., Christensen, A. K., Gibbs, F. A., Pesch, L. A. The enzymatic preparation of isolated intact parenchymal cells from rat liver. J Cell Biol. 35 (3), 675-684 (1967).
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. J Cell Biol. 43 (3), 506-520 (1969).
- Tateno, C., Yoshizato, K. Long-term cultivation of adult rat hepatocytes that undergo multiple cell divisions and express normal parenchymal phenotypes. Am J Pathol. 148 (2), 383-392 (1996).
- Kanayama, N., et al. A PEG-based biocompatible block catiomer with high buffering capacity for the construction of polyplex micelles showing efficient gene transfer toward primary cells. ChemMedChem. 1 (4), 439-444 (2006).
- Itaka, K., Ishii, T., Hasegawa, Y., Kataoka, K. Biodegradable polyamino acid-based polycations as safe and effective gene carrier minimizing cumulative toxicity. Biomaterials. 31 (13), 3707-3714 (2010).
- Uchida, S., et al. PEGylated Polyplex With Optimized PEG Shielding Enhances Gene Introduction in Lungs by Minimizing Inflammatory Responses. Mol Ther. 20 (6), 1196-1203 (2012).
- Golde, W. T., Gollobin, P., Rodriguez, L. L. A rapid, simple, and humane method for submandibular bleeding of mice using a lancet. Lab Anim (NY). 34, 39-43 (2005).
- Uchida, S., et al. An injectable spheroid system with genetic modification for cell transplantation therapy. Biomaterials. 35 (8), 2499-2506 (2014).

