La transfección de genes hacia células Esferoide sobre placas micropatterned Cultura para el trasplante de células genéticamente modificadas
Summary
This protocol describes a cell transplantation system using genetically modified, injectable spheroids. Cell spheroids are cultured on micropatterned culture plates and recovered after gene introduction using polyplex nanomicelles. This system facilitates prolonged transgene expression from the transplanted cells in host animals while maintaining the innate function of the cells.
Abstract
Para mejorar la eficacia terapéutica del trasplante de células, se desarrolló un sistema de trasplante de genéticamente modificados, esferoides inyectables. Los esferoides de células se preparan en un sistema de cultivo en placas de micropatterned recubiertas con un polímero termosensible. Un número de esferoides están formados en las placas, correspondientes a las áreas de adhesión celular de 100 m de diámetro que están dispuestos regularmente en una forma bidimensional, rodeadas por áreas no adhesivas que están recubiertas por un glicol de polietileno (PEG) matriz. Los esferoides se pueden recuperar fácilmente como una suspensión líquida mediante la reducción de la temperatura de las placas, y su estructura está bien mantenido pasándolos a través de agujas de inyección con un calibre lo suficientemente grande (más de 27 G). La modificación genética se consigue mediante transfección de genes usando la no viral portador del gen original, nanomicelle Polyplex, que es capaz de introducir genes en las células sin interrumpir la estructura esferoide. Para primesferoides de hepatocitos ary transfectadas con un gen de luciferasa que expresan, la luciferasa se obtiene de forma sostenible en animales trasplantados, junto con la función de los hepatocitos conservados, como se indica por la expresión de albúmina. Este sistema se puede aplicar a una variedad de tipos de células incluyendo células madre mesenquimales.
Introduction
Terapia de trasplante de células ha atraído una gran atención para el tratamiento de diversas enfermedades intratables. La actividad y la vida media de los factores bioactivos que son secretadas por las células trasplantadas son esenciales para mejorar la eficacia terapéutica de un sistema de trasplante de células. La modificación genética de las células antes del trasplante es una técnica beneficiosa para regular y manipular las funciones celulares, incluyendo la secreción de los factores bioactivos. También es importante mantener un microambiente favorable para las células para evitar la muerte celular o pérdida de la actividad celular. Tridimensional de cultivo (3D) de células esferoide, en el que las interacciones de célula a célula están bien conservados, es prometedor para este propósito, por ejemplo, para mejorar la secreción de albúmina de los hepatocitos primarios y promoción de la diferenciación multi-linaje de células madre mesenquimales (MSCs ) 1-7.
En este estudio, un nuevo sistema de combinación de spheroid cultura y la transfección de genes se utiliza para servir como una plataforma para el trasplante de células modificadas genéticamente. Para la creación de células esferoides, se utiliza un sistema de cultivo en placas de cultivo esferoide micropatterned. En estas placas, las áreas de adhesión celular de 100 m de diámetro están dispuestos regularmente en una forma de dos dimensiones y están rodeadas por áreas no adhesivas recubiertas por una matriz 3 PEG. Por la siembra de un número adecuado de células, se forman matrices de esferoides en 3D de 100 micras de diámetro correspondiente al lecho de cultivo microestructurada.
Los esferoides se recuperan sin interrumpir su estructura 3D mediante el uso de placas de cultivo celular termosensibles, que se revistieron con un polímero termosensible, poli (iso-propilacrilamida) (PIPAAm) 8-10. La arquitectura micropatterned se construye sobre las placas termosensibles (a medida construido). Por simplemente bajando la temperatura de las placas, los esferoides se separan de la cama de cultivo y se dispersand en tampón fosfato salino (PBS). Por lo tanto, un gran número de esferoides con un tamaño uniforme de 100 micras se puede obtener en la forma de una suspensión inyectable.
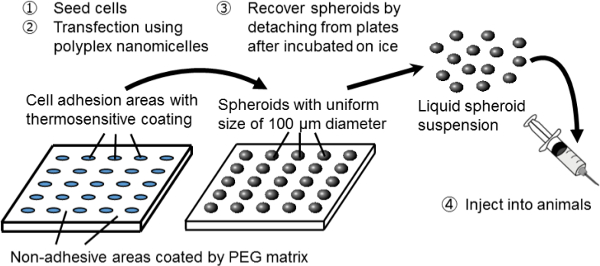
Figura 1. Representación esquemática del sistema de cultivo esferoide en una placa microestructurada. La modificación genética se consigue mediante transfección de genes usando la no viral portador del gen original, nanomicelle Polyplex. Se compone de ADN de plásmido (pDNA) y polietilenglicol (PEG) copolímeros de bloque -polycation 11. Estos tienen una estructura de núcleo-corteza característica que consiste en una cáscara de PEG y un núcleo interno de pDNA condensada, lo seguro y eficaz introducción de genes en células con fines terapéuticos 11. Haga clic aquí para ver una versión más grande de this figura.
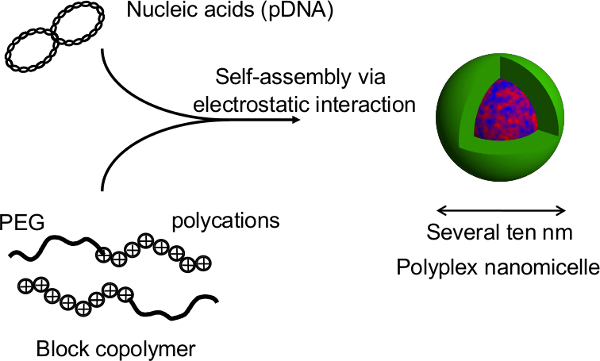
Figura 2. Estructura de la nanomicelle Polyplex formado por el complejo de ácidos nucleicos y copolímeros de bloque de PEG-bloque-policatión. En este estudio, la principal ventaja de esta técnica es que la estructura de esferoide no se interrumpe durante transfección de genes por los nanomicelles. Después de transfecciones nanomicelle mediada de rata esferoides de hepatocitos primarios, prolongada expresión del transgen se obtiene durante más de un mes con la secreción de albúmina continua de los hepatocitos en un nivel comparable a la de esferoides no transfectadas 12. La expresión del transgén y la secreción de albúmina a partir de los esferoides también se mantienen después de la recuperación de las placas termosensibles. Es evidente que nanomicelles pueden facilitar de manera segura la introducción de genes sin perjudicar las funciones innatas de la hepatocytes. Por lo tanto, la combinación de células esferoides cultivadas en placas micropatterned termosensibles con la introducción de genes usando nanomicelles es una plataforma prometedora para el trasplante de células modificadas genéticamente. Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
En este protocolo, es fundamental para mantener la estructura 3D de esferoides durante las etapas de introducción de genes y la recuperación esferoide. Es esencial mantener una microambientes favorables para las células para evitar la muerte celular o la pérdida de la actividad celular. Por ejemplo, la secreción de albúmina, una función innata representante de los hepatocitos, está bien conservado en los esferoides de hepatocitos, mientras que los hepatocitos en el cultivo monocapa convencional pierden rápidame…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Apreciamos profundamente Dr. Takeshi Ikeya y personal técnico en Toyo Gosei, Tokio, Japón para proporcionar placas de cultivo micropatterned termosensibles, así como el asesoramiento científico. También agradecemos a la Sra Satomi Ogura, Sra Sae Suzuki, la Sra Asuka Miyoshi y la Sra Katsue Morii para la asistencia técnica con los experimentos con animales. Este trabajo fue apoyado financieramente en parte por las JSP KAKENHI subvención-en-Ayudas a la Investigación Científica, el Centro del Programa de Innovación (COI) y el programa de innovación S- de la Agencia de Ciencia y Tecnología de Japón (JST), y las JSP Core- a-Core Programa, A. Redes Avanzadas de Investigación.
Materials
| Pen-Strep-Glut | GIBCO | ||
| Dexamethasone | Wako Pure Chemical Industries | 041-18861 | |
| Nicotinamide | Wako Pure Chemical Industries | 141-01202 | |
| Hank’s buffered salt and L-ascorbic acid 2-phosphate (Asc-2P) | Sigma-Aldrich | A8960 | |
| Human epidermal growth factor (hEGF) | Toyobo | PT10015 | |
| Cell-able multi-well plates | Toyo Gosei | PP-12 | |
| Thermosensitive cell culture plates (Upcell) | CellSeed Inc | The micropatterned architecture is constructed on the thermosensitive plates (custom-built by Toyo Gosei) | |
| Lipid-based transfection reagent (FuGENE HD) | Promega | E2311 | |
| Renilla Luciferase Assay System | Promega | E2810 | |
| pGL4 Luciferase Reporter Vector | Promega | E6651 | |
| pDNA expressing Gaussia luciferase | New England BioLabs | N8082S | |
| Mouse erhthropoietin-expressing vector | Origene | MC208445 | |
| pCAG-GS | Kindly provided by Laboratory for Pluripotent Cell Studies, Center for Developmental Biology, RIKEN | ||
| Escherichia coli DH5α competent cells | Takara | 9057 | |
| Endotoxin-free plasmid DNA purification system | Nippon Genetics | NucleoBond Xtra EF | |
| collagenase | Wako Pure Chemical Industries | 639-00951 | |
| trypsin inhibitor | GIBCO | R-007-100 | |
| Luminometer | Promega | GloMax™ 96 Microplate Luminometer | |
| IVIS Imaging System | Xenogen Corp. | Xenogen IVIS Spectrum in vivo imaging system | |
| blood sample analyzer | Sysmex | pocH-100i Automated Hematology Analyzer |
Riferimenti
- Landry, J., Bernier, D., Ouellet, C., Goyette, R., Marceau, N. Spheroidal aggregate culture of rat liver cells: histotypic reorganization, biomatrix deposition, and maintenance of functional activities. J Cell Biol. 101 (3), 914-923 (1985).
- Yuasa, C., Tomita, Y., Shono, M., Ishimura, K., Ichihara, A. Importance of cell aggregation for expression of liver functions and regeneration demonstrated with primary cultured hepatocytes. J Cell Physiol. 156 (3), 522-530 (1993).
- Otsuka, H., et al. Two-dimensional multiarray formation of hepatocyte spheroids on a microfabricated PEG-brush surface. Chembiochem. 5 (6), 850-855 (2004).
- Wang, W., et al. 3D spheroid culture system on micropatterned substrates for improved differentiation efficiency of multipotent mesenchymal stem cells. Biomaterials. 30 (14), 2705-2715 (2009).
- Bartosh, T. J., et al. Aggregation of human mesenchymal stromal cells (MSCs) into 3D spheroids enhances their antiinflammatory properties. Proc Natl Acad Sci U S A. 107 (31), 13724-13729 (2010).
- Frith, J. E., Thomson, B., Genever, P. G. Dynamic three-dimensional culture methods enhance mesenchymal stem cell properties and increase therapeutic potential. Tissue Eng Part C Methods. 16 (4), 735-749 (2010).
- Nakasone, Y., Yamamoto, M., Tateishi, T., Otsuka, H. Hepatocyte spheroids underlayered with nonparenchymal cells for biomedical applications. IEICE Transactions on Electronics. E94, 176-180 (2011).
- Nishida, K., et al. Corneal reconstruction with tissue-engineered cell sheets composed of autologous oral mucosal epithelium. N Engl J Med. 351 (12), 1187-1196 (2004).
- Ohashi, K., et al. Engineering functional two- and three-dimensional liver systems in vivo using hepatic tissue sheets. Nat Med. 13 (7), 880-885 (2007).
- Sekine, H., et al. Cardiac cell sheet transplantation improves damaged heart function via superior cell survival in comparison with dissociated cell injection. Tissue Eng Part A. 17 (23-24), 2973-2980 (2011).
- Itaka, K., Kataoka, K. Progress and prospects of polyplex nanomicelles for plasmid DNA delivery. Curr Gene Ther. 11 (6), 457-465 (2011).
- Endo, T., Itaka, K., Shioyama, M., Uchida, S., Kataoka, K. Gene transfection to spheroid culture system on micropatterned culture plate by polyplex nanomicelle: a novel platform of genetically-modified cell transplantation. Drug Deliv and Transl Res. 2 (5), 398-405 (2012).
- Howard, R. B., Christensen, A. K., Gibbs, F. A., Pesch, L. A. The enzymatic preparation of isolated intact parenchymal cells from rat liver. J Cell Biol. 35 (3), 675-684 (1967).
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. J Cell Biol. 43 (3), 506-520 (1969).
- Tateno, C., Yoshizato, K. Long-term cultivation of adult rat hepatocytes that undergo multiple cell divisions and express normal parenchymal phenotypes. Am J Pathol. 148 (2), 383-392 (1996).
- Kanayama, N., et al. A PEG-based biocompatible block catiomer with high buffering capacity for the construction of polyplex micelles showing efficient gene transfer toward primary cells. ChemMedChem. 1 (4), 439-444 (2006).
- Itaka, K., Ishii, T., Hasegawa, Y., Kataoka, K. Biodegradable polyamino acid-based polycations as safe and effective gene carrier minimizing cumulative toxicity. Biomaterials. 31 (13), 3707-3714 (2010).
- Uchida, S., et al. PEGylated Polyplex With Optimized PEG Shielding Enhances Gene Introduction in Lungs by Minimizing Inflammatory Responses. Mol Ther. 20 (6), 1196-1203 (2012).
- Golde, W. T., Gollobin, P., Rodriguez, L. L. A rapid, simple, and humane method for submandibular bleeding of mice using a lancet. Lab Anim (NY). 34, 39-43 (2005).
- Uchida, S., et al. An injectable spheroid system with genetic modification for cell transplantation therapy. Biomaterials. 35 (8), 2499-2506 (2014).

