באתרו לשעבר Normothermic מכונת זלוף של כבדים תורמים
Summary
Here we present a protocol describing oxygenated ex situ machine perfusion of donor liver grafts. This article contains a step by step protocol to procure and prepare the liver graft for machine perfusion, prepare the perfusion fluid, prime the perfusion machine and perform oxygenated normothermic machine perfusion of the liver graft.
Abstract
בניגוד לשימור קונבנציונלי סטטי הקר (0-4 מעלות צלזיוס), זלוף מכונה באתרו לשעבר עשוי לספק שימור טוב יותר של כבדי תורם. זלוף הרציף של איברים מספק את ההזדמנות כדי לשפר את איכות איבר ומאפשר הערכת כדאיות באתרו לשעבר של כבדי תורם לפני ההשתלה. מאמר זה מספק וידאו צעד אחר צעד לפרוטוקול באתרו לשעבר זלוף normothermic מכונה (37 מעלות צלזיוס) של כבדי תורם אנושיים באמצעות מכשיר המספק זלוף pulsatile לחץ וטמפרטורה מבוקרת של העורק הכבד וזלוף הרציף של וריד השער. נוזל זלוף הוא מחומצן על ידי שתי oxygenators קרום סיב חלול והטמפרטורה יכולה להיות מוסדרת בין 10 ° C ו 37 מעלות צלזיוס. במהלך זלוף, הפעילות המטבולית של הכבד, כמו גם את מידת פגיעה יכולה להיות מוערכת על ידי הניתוח ביוכימי של דגימות שנלקחו מנוזל זלוף. זלוף מכונת הוא כלי מאוד מבטיחכדי להגדיל את המספר של כבדים המתאימים להשתלה.
Introduction
השיטה הנוכחית של שימור איברים בהשתלת כבד היא לשטוף את עם והאחסון הבא של כבדי תורם בקור (0-4 מעלות צלזיוס) שימור נוזלים (כגון האוניברסיטה ויסקונסין פתרון או פתרון היסטידין-טריפטופן-ketoglutarate). שיטה זו נקראת אחסון סטטי כקר (SCS). למרות שקצב חילוף החומרים של כבדים ב0-4 מעלות צלזיוס הוא נמוך מאוד, יש עדיין ביקוש לרקמת 0.27 μmol חמצן / דקה / g כבד, שלא יכול להיות מסופקת ב1 SCS. השיטה המקובלת של SCS, ולכן, תוצאות במידה מסוימת של פגיעה (נוספת) של כבדי תורם. בעוד סכום זה של פציעת שימור הוא לא בעיה בכבד תורם באיכות טובה, זה יכול להיות גורם קריטי והגבלה בכבדים הכי מוצלח שכבר סבלו במידה מסוימת של פגיעה בתורם. מסיבה זו, כבדים עם איכות לא טובים או תורם קריטריונים מורחב כבדים (ECD) מה שנקרא לעתים קרובות דחו להשתלה כo הסיכוןכישלון שתל המוקדם F נחשב גבוהה מדי. שיעורים גבוהים של תפקוד מתעכב שתל, שאינו תפקיד עיקרי, ומגבלות שאינן בהשקת מרה (NAS) תוארו במקבלי כבדים מתרומה לאחר מות דם (DCD), תורמים או מקבלי שתלי steatotic 2 מבוגרים. NAS הוא אחד גורמים עיקריים לתחלואה ותמותה לאחר השתלה כבד. NAS עלול להתרחש בשני צינורות המרה תורמת חוץ-וintrahepatic ויכול להיות מלווה בבוצת המרה intraductal ושחקנים היווצרות 3,4. למרות שהוא חשב אטיולוגיה של NAS להיות כמה גורמים ופציעת איסכמיה / reperfusion של צינורות המרה בשימור שתל והשתלה זוהתה כ2,5 מנגנון בסיסי גדול. השתלה של שתל DCD זוהתה כאחד מגורמי הסיכון החזקים ביותר לפיתוח NAS. השילוב של תקופה של איסכמיה החמה בתורם DCD, איסכמיה הקרה בשימור איברים, ולאחר מכן reperfusionהוא חשב פגיעה בנמען שתהיה אחראי לפגיעה בלתי הפיכה של דרך המרה, אשר, בשילוב עם יכולת התחדשות לקויה של צינורות המרה, תוצאות בצלקות והיצרות של דרך המרה fibrotic לאחר השתלה כבד 2,5. NAS דווח בעד 30% מהחולים שטופלו בכבד DCD 6-8. זה הפך להיות ברור כי השיטה הנוכחית של SCS של שתלי כבד להשתלה אינה מספיקה לכבדי ECD preinjured כגון אלה מתורמי DCD. יש צורך בשיטות אלטרנטיביות כדי להגדיל ולייעל את השימוש של כבדי ECD להשתלה.
זלוף מכונת (MP) הוא שיטת שימור איברים שעשויים לספק שימור טוב יותר של איברי תורם, בהשוואה לSCS. חבר הפרלמנט יכול להיות רלוונטי במיוחד לשימור שתלי ECD. יתרון חשוב של חבר הפרלמנט הוא האפשרות לספק חמצן לשתל במהלך תקופת השימור. ניתן לבצע MP בטמפרטורות שונות,אשר סווג כהיפותרמיה (0-10 מעלות צלזיוס), subnormothermic (10-36 מעלות צלזיוס) וnormothermic MP (36-37 ° C) (תמ"א). בהתאם לטמפרטורה המשמשת לMP, הסוג של זלוף נוזל צריך להיות מותאם ועם עלייה בחמצן יותר טמפרטורה צריך להיות מסופק. היישום הקליני הראשון של חבר פרלמנט בהשתלת כבד אנושי התבסס על זלוף היפותרמיה ללא חמצון פעיל של 9,10 זלוף הנוזל. במודלים של בעלי חיים, MP היפותרמיה מחומצן (0-10 מעלות צלזיוס) הוכח להיות השפעה מגנה מפני איסכמיה / פציעת reperfusion של כבד שתל 11 ולספק שימור טוב יותר של מקלעת כלי דם peribiliary של המרה לבלוטות 12. Subnormothermic חומץ MP ב 20 ° C או 30 ° C נחקר גם במודלים של בעלי חיים והראה לספק התאוששות קודמת של פונקצית שתל של כבדי DCD, בהשוואה לSCS 13,14. ההיתכנות של חבר פרלמנט מחומץ subnormothermic של כבדים אנושיים הייתה recדיווח ently בסדרה של שבעה כבדי תורם אנושיים מושלכים 15. תמ"א (37 מעלות צלזיוס) מאפשר ההערכה של כדאיות שתל ופונקציונליות לפני השתלת 16,17. בנוסף, חבר הפרלמנט מאפשר לחימום מחדש הדרגתי של שתל הכבד לפני ההשתלה, אשר כבר הוכיח כדי להקל על התאוששות והחייאה של השתל 18.
מכשיר זלוף שימוש בפרוטוקול הנוכחי לזלוף מכונה כבד מאפשר זלוף הכפול (דרך וריד השער והעורק הכבד) באמצעות שתי משאבות צנטריפוגליות, המספקות זרימה רציפה ופורטל זרימת דם פועם. המערכת היא בשליטה בלחץ, המאפשר אוטומטי הסדרת הזרימה דרך כבד, בהתאם להתנגדות intrahepatic. שתי oxygenators קרום סיבים חלול לאפשר לחמצון של שתל הכבד, כמו גם להסרת של CO 2. הטמפרטורה ניתן להגדיר בהתאם לסוג המיועד של MP (טמפרטורות מינימום יור 10 מעלות צלזיוס). זרימה, לחץ וטמפרטורה מוצגים במכשיר בזמן אמת ומאפשר שליטה מתמדת של תהליך זלוף. סט חד פעמי סטרילי חדש של צינורות, מאגר וoxygenators זמין עבור זלוף של כל שתל (איור 1).
המטרה של מאמר זה וידאו היא לספק צעד אחר צעד לפרוטוקול זלוף מכונה normothermic באתרו לשעבר של כבדי תורם אנושיים באמצעות מכונה זו זלוף הכבד חדש שפותחה.
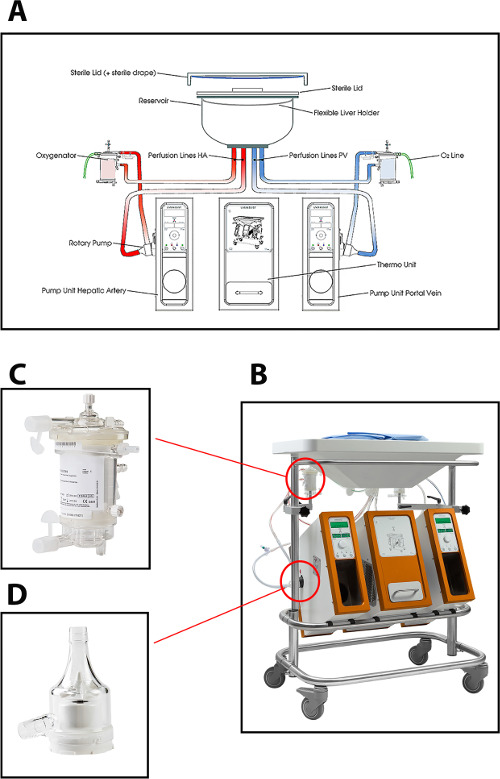
איור 1: (א) ציור סכמטי, (ב) תמונה של המכונה זלוף, (ג) מבט קרוב יותר על oxygenator, ומשאבה צנטריפוגלית משמשת לזלוף normothermic של כבדי תורם אנושיים (ד ').תקבל = "_ blank"> לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Protocol
Representative Results
Discussion
This video provides a step by step protocol for normothermic machine perfusion of human donor livers using a device that enables pressure controlled dual perfusion through the hepatic artery and portal vein. While following this protocol, technical failures of the perfusion machine did not occur and all grafts were well perfused and well oxygenated. The ex situ perfused livers had stable hemodynamics and were metabolically active, as defined by the production of bile16,17.
…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
This research work was financially supported by grants provided by Innovatief Actieprogramma Groningen (IAG-3), Jan Kornelis de Cock Stichting and Tekke Huizingafonds, all in the Netherlands. We are appreciative to all the Dutch transplantation coordinators for identifying the potential discarded livers and obtaining informed consent.
Materials
| Liver Assist | Organ Assist | OA.Li.Li.140 | Perfusion device |
| Liver Assist disposable package | Organ Assist | OA.Li.DP.540 | Disposable set and cannulas |
| Meredith No.8 | Vygon Nederlands B.V. | 1362082 | Bile duct cannula |
| Human albumin 200g/l / ALBUMAN | Sanquin | 15522598 | 100 ml |
| Modified parenteral nutrition | Baxter Nederland B.V. | N14G30E | 7.35 ml |
| Multivitamins for infusion / CERNEVIT | Baxter International Inc. | 9800927 | 7 ul |
| Concentrated trace elements for infusion / NUTRITRACE | B. Braun Melsungen AG | 14811332 | 7.35 ml |
| Metronidazole 5mg/ml | Baxter Nederland B.V. | 98181882 | 40 ml |
| Cefazoline / SERVAZOLIN | Sandoz B.V. | 15611337 | 2 ml |
| Fast acting insulin | various vendors | 20 ml | |
| Calcium glubionate, intravenous solution 10%, 137.5 mg/mL | Sandoz | 97038695 | 40 ml |
| Sterile H2O | Fresenius Kabi Nederland B.V. | 98084453 | 51.3 ml |
| NaCl 0.9% | Baxter Nederland B.V. | 15262510 | 160 ml |
| Heparin 5000 IE/ml for i.v. administration | LEO Pharma B.V. | 98026178 | 4 ml |
| Sodium bicarbonate 8,4% | B. Braun Melsungen AG | 97973874 | The amount depends on the pH |
| Packed red blood cell (in SAGM) | Blood bank (Sanquin) | N0012000 | 750 ml |
| Fresh frozen plasma | Blood bank (Sanquin) | N04030A0/N04030B0 | 900 ml |
Riferimenti
- Plaats, A., et al. Hypothermic machine preservation in liver transplantation revisited: Concepts and criteria in the new millennium. Ann. Biomed. Eng. 32 (4), 623-631 (2004).
- op den Dries, S., Sutton, M. E., Lisman, Y., Porte, R. J. Protection of bile ducts in liver transplantation: Looking beyond ischemia. Transplantation. 92 (4), 373-379 (2011).
- Seehofer, D., Eurich, D., Veltzke-Schlieker, W., Neuhaus, P. Biliary complications after liver transplantation: Old problems and new challenges. Am. J. Transplant. 13 (2), 253-265 (2013).
- Buis, C. I., et al. Nonanastomotic biliary strictures after liver transplantation, part 1: Radiological features and risk factors for early vs. late presentation. Liver. Transpl. 13 (5), 708-718 (2007).
- Karimian, N., op den Dries, S., Porte, R. J. The origin of biliary strictures after liver transplantation: Is it the amount of epithelial injury or insufficient regeneration that counts. J. Hepatol. 58 (6), 1065-1067 (2013).
- Gastaca, M. Biliary complications after orthotopic liver transplantation: A review of incidence and risk factors. Transplant. Proc. 44 (6), 1545-1549 (2012).
- Sanchez-Urdazpal, L., et al. Ischemic-type biliary complications after orthotopic liver transplantation. Hepatology. 16 (1), 49-53 (1992).
- Dubbeld, J., et al. Similar liver transplantation survival with selected cardiac death donors and brain death donors. Br. J. Surg. 97 (5), 744-753 (2010).
- Guarrera, J. V., et al. Hypothermic machine preservation in human liver transplantation: The first clinical series. Am. J. Transplant. 10 (2), 372-381 (2010).
- Henry, S. D., et al. Hypothermic machine preservation reduces molecular markers of ischemia/reperfusion injury in human liver transplantation. Am. J. Transplant. 12 (9), 2477-2486 (2012).
- Schlegel, A., Rougemont, O., Graf, R., Clavien, P. A., Dutkowski, P. Protective mechanisms of end-ischemic cold machine perfusion in DCD liver grafts. J. Hepatol. 58 (2), 278-286 (2013).
- op den Dries, S., et al. Hypothermic oxygenated machine perfusion prevents arteriolonecrosis of the peribiliary plexus in pig livers donated after circulatory death. PLoS. One. 9 (2), e88521 (2014).
- Tolboom, H., et al. Subnormothermic machine perfusion at both 20 degrees C and 30 degrees C recovers ischemic rat livers for successful transplantation. J. Surg. Res. 175 (1), 149-156 (2012).
- Gringeri, E., et al. Subnormothermic machine perfusion for non-heart-beating donor liver grafts preservation in a swine model: A new strategy to increase the donor pool? Transplant. Proc. 44 (7), 2026-2028 (2012).
- Bruinsma, B. G., et al. Subnormothermic machine perfusion for ex vivo preservation and recovery of the human liver for transplantation. Am. J. Transplant. 14 (6), 1400-1409 (2014).
- op den Dries, S., et al. Ex vivo normothermic machine perfusion and viability testing of discarded human donor livers. Am. J. Transplant. 13 (5), 1327-1335 (2013).
- Sutton, M. E., et al. Criteria for viability assessment of discarded human donor livers during ex vivo normothermic machine perfusion. PLoS. One. 9 (11), (2014).
- Minor, T., Efferz, P., Fox, M., Wohlschlaeger, J., Luer, B. Controlled oxygenated rewarming of cold stored liver grafts by thermally graduated machine perfusion prior to reperfusion. Am. J. Transplant. 13 (6), 1450-1460 (2013).
- Makowka, L., et al. Surgical technique of orthotopic liver transplantation. Gastroenterol. Clin. North. Am. 17 (1), 33-51 (1988).
- Hansen, T., et al. Histological examination and evaluation of donor bile ducts received during orthotopic liver transplantation–a morphological clue to ischemic-type biliary lesion?. Virchows Arch. 461 (1), 41-48 (2012).
- Monbaliu, D., Brassil, J. Machine perfusion of the liver: Past, present and future. Curr. Opin. Organ. Transplant. 15 (2), 160-166 (2010).
- Oldani, G., et al. Pre-retrieval reperfusion decreases cancer recurrence after rat ischemic liver graft transplantation. J. Hepatol. 61 (2), 278-285 (2014).
- Tromans, D. Temperature and pressure dependent solubility of oxygen in water: A thermodynamic analysis. Hydrometallurgy. 48 (3), 327-342 (1998).

