供肝易地常温灌注机
Summary
在这里,我们提出描述体肝移植含氧易地灌注机的协议。本文包含一步步协议采购和准备肝移植的灌注机,准备灌注液,素灌注机,并执行肝移植的含氧常温灌注机。
Abstract
相对于传统的静态低温保存(0-4°C), 易地灌注机可以提供更好的保护供肝。器官的连续灌流提供了机会,改善器官的质量,并允许移植前供肝易地可行性评估。这个视频文章提供了分步协议易地人供体肝脏的常温灌注机(37°C)使用的设备,提供了肝动脉和门静脉的连续灌流的压力和温度控制脉冲灌流。灌注流体由两个中空纤维膜氧合充氧,温度可以在10°C和37℃下进行调节。在灌注期间,肝脏的代谢活性以及损伤的程度可以通过从灌注流体取样的生化分析进行评估。灌注机是一个非常有前途的工具增加肝脏适合于移植的数量。
Introduction
器官保存在肝移植目前的方法是冲洗出来,并与供肝的后续存储在寒冷的(0-4°C)保存液(如威斯康星溶液或组氨酸,色氨酸酮戊二酸溶液大学)。这种方法被称为静态冷库(SCS)。尽管肝脏在0-4℃下的代谢率是很低的,仍有0.27微摩尔氧/分钟/克肝组织,这是不能SCS 1期间提供的需求。 SCS的常规方法,因此,导致在一定程度的供体肝脏的(附加的)损伤。虽然这一数额保存损伤是不是质量好供肝的一个问题,它可以成为次优的肝脏已经遭受一定程度损伤的供体的一个关键和限制因素。出于这个原因,肝脏与次优的质量或所谓的扩展标准供体(ECD)肝脏经常拒绝用于移植的风险ö˚F早期移植失败被认为是太高了。对移植肾功能延迟,主要的非功能和非吻合口胆管狭窄(NAS)的高利率已经在肝脏接受者循环死亡(DCD),旧的捐助者或脂肪肝移植2收件人描述后从捐赠。 NAS是发病率和死亡率的肝脏移植后的一个主要原因。 NAS可能发生在两个预算外和捐助者的肝内胆管,可伴有导管内胆泥和铸造形成3,4。尽管NAS的病因被认为是多因素的,在移植保存和移植胆管缺血/再灌注损伤已被确定为主要的潜在机制2,5。一个DCD移植物的移植已被确定为最强的危险因素为NAS的发展中的一个。一段暖缺血的一个DCD供体,器官保存在冷缺血随后再灌注的组合,和在收件人损伤被认为是负责胆管可逆损伤,这在与胆管的不良再生能力结合,导致纤维化瘢痕和胆管的变窄肝移植2,5-之后。 NAS已经报道了高达接收DCD肝6-8 30%的患者。它已经很清楚,SCS的用于移植的当前方法肝移植是不足以preinjured ECD肝脏如来自DCD供体。需要其他方法来增加和优化利用ECD肝脏移植。
机灌注(MP)是器官保存,其可以提供供体器官的保存较好,相比SCS的方法。 MP可以是特别相关的ECD移植物的保存。 MP的一项重要优点是有可能向在保存期间提供氧气的移植物。 MP可以在各种温度下进行,已被列为低温(0-10℃),subnormothermic(10-36℃)和常温(36-37℃),MP(NMP)。取决于用于MP的温度,灌注流体的类型必须调整并随着温度的升高更多的氧气应提供。 MP在人肝移植的第一个临床应用是基于低温灌注未经灌注流体9,10的活性氧。在动物模型中,低温氧化的MP(0-10℃)已经显示出具有抗缺血的保护作用/肝的再灌注损伤移植物11,并提供更好的保存胆汁的胆管周围血管丛的管道12。 Subnormothermic含氧的MP在20℃或30℃下也进行了研究的动物模型,并且显示出提供早期恢复DCD肝脏移植物功能,相比SCS 13,14。人类肝脏subnormothermic充氧MP的可行性RECently报道了七人丢弃的供肝15。 NMP(37℃)允许接枝生存能力和现有功能的评估移植16,17。此外,MP允许肝移植物的逐渐复温移植前,这已被证明有利于恢复的移植物18和复苏。
在当前协议肝灌注机中使用的灌注装置能够双重灌注(通过门静脉和肝动脉)使用两个离心泵,即提供连续的门脉血流和脉动的动脉血流。该系统的压力进行控制,从而自动调节流经肝脏,取决于肝内阻力。两个中空纤维膜氧合允许肝移植物的氧合作用,以及用于除去的CO 2。该温度可根据期望的类型的MP(最小Temperat .. [温度设定 10℃URE)。流量,压力和温度的显示装置实时地允许灌注过程的连续控制上。一种新的一次性无菌集油管,水库及氧合可用于每个移植( 图1)的灌注。
这个视频文章的目的是提供一个一步一步的协议,使用这种新开发的肝脏灌注机人供体肝脏的易地常温灌注机。
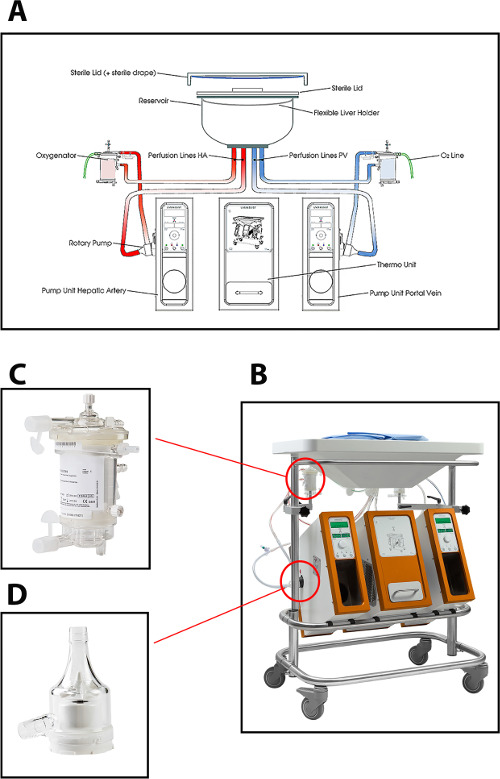
图1:(A)的概略图,(B)中的灌注机的照片,(C)的人工肺的更近的视图,以及(D)用于人类供体肝脏的常温灌注离心泵。获得=“_空白”>点击此处查看该图的放大版本。
Protocol
Representative Results
Discussion
此视频提供了使用设备,使压力控制双灌注通过肝动脉和门静脉一步的人供体肝脏的常温灌注机步协议。虽然按照此协议,灌注机的技术故障并没有出现,所有移植物灌注良好和良好的氧化。 易地肝脏灌注了血流动力学稳定,并为代谢活跃,所生产的胆16,17定义。
这是一个公认的协议,用于人类供体肝脏的灌注机。该技术具有超过SCS 21的常规方法的几?…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
该研究工作得到由Innovatief Actieprogramma格罗宁根(IAG-3),扬德Kornelis屌斯蒂廷和提基亚Huizingafonds规定,所有在荷兰的资助。我们感谢所有荷兰移植协调员识别潜在的肝脏丢弃并取得知情同意。
Materials
| Liver Assist | Organ Assist | OA.Li.Li.140 | Perfusion device |
| Liver Assist disposable package | Organ Assist | OA.Li.DP.540 | Disposable set and cannulas |
| Meredith No.8 | Vygon Nederlands B.V. | 1362082 | Bile duct cannula |
| Human albumin 200g/l / ALBUMAN | Sanquin | 15522598 | 100 ml |
| Modified parenteral nutrition | Baxter Nederland B.V. | N14G30E | 7.35 ml |
| Multivitamins for infusion / CERNEVIT | Baxter International Inc. | 9800927 | 7 ul |
| Concentrated trace elements for infusion / NUTRITRACE | B. Braun Melsungen AG | 14811332 | 7.35 ml |
| Metronidazole 5mg/ml | Baxter Nederland B.V. | 98181882 | 40 ml |
| Cefazoline / SERVAZOLIN | Sandoz B.V. | 15611337 | 2 ml |
| Fast acting insulin | various vendors | 20 ml | |
| Calcium glubionate, intravenous solution 10%, 137.5 mg/mL | Sandoz | 97038695 | 40 ml |
| Sterile H2O | Fresenius Kabi Nederland B.V. | 98084453 | 51.3 ml |
| NaCl 0.9% | Baxter Nederland B.V. | 15262510 | 160 ml |
| Heparin 5000 IE/ml for i.v. administration | LEO Pharma B.V. | 98026178 | 4 ml |
| Sodium bicarbonate 8,4% | B. Braun Melsungen AG | 97973874 | The amount depends on the pH |
| Packed red blood cell (in SAGM) | Blood bank (Sanquin) | N0012000 | 750 ml |
| Fresh frozen plasma | Blood bank (Sanquin) | N04030A0/N04030B0 | 900 ml |
Riferimenti
- Plaats, A., et al. Hypothermic machine preservation in liver transplantation revisited: Concepts and criteria in the new millennium. Ann. Biomed. Eng. 32 (4), 623-631 (2004).
- op den Dries, S., Sutton, M. E., Lisman, Y., Porte, R. J. Protection of bile ducts in liver transplantation: Looking beyond ischemia. Transplantation. 92 (4), 373-379 (2011).
- Seehofer, D., Eurich, D., Veltzke-Schlieker, W., Neuhaus, P. Biliary complications after liver transplantation: Old problems and new challenges. Am. J. Transplant. 13 (2), 253-265 (2013).
- Buis, C. I., et al. Nonanastomotic biliary strictures after liver transplantation, part 1: Radiological features and risk factors for early vs. late presentation. Liver. Transpl. 13 (5), 708-718 (2007).
- Karimian, N., op den Dries, S., Porte, R. J. The origin of biliary strictures after liver transplantation: Is it the amount of epithelial injury or insufficient regeneration that counts. J. Hepatol. 58 (6), 1065-1067 (2013).
- Gastaca, M. Biliary complications after orthotopic liver transplantation: A review of incidence and risk factors. Transplant. Proc. 44 (6), 1545-1549 (2012).
- Sanchez-Urdazpal, L., et al. Ischemic-type biliary complications after orthotopic liver transplantation. Hepatology. 16 (1), 49-53 (1992).
- Dubbeld, J., et al. Similar liver transplantation survival with selected cardiac death donors and brain death donors. Br. J. Surg. 97 (5), 744-753 (2010).
- Guarrera, J. V., et al. Hypothermic machine preservation in human liver transplantation: The first clinical series. Am. J. Transplant. 10 (2), 372-381 (2010).
- Henry, S. D., et al. Hypothermic machine preservation reduces molecular markers of ischemia/reperfusion injury in human liver transplantation. Am. J. Transplant. 12 (9), 2477-2486 (2012).
- Schlegel, A., Rougemont, O., Graf, R., Clavien, P. A., Dutkowski, P. Protective mechanisms of end-ischemic cold machine perfusion in DCD liver grafts. J. Hepatol. 58 (2), 278-286 (2013).
- op den Dries, S., et al. Hypothermic oxygenated machine perfusion prevents arteriolonecrosis of the peribiliary plexus in pig livers donated after circulatory death. PLoS. One. 9 (2), e88521 (2014).
- Tolboom, H., et al. Subnormothermic machine perfusion at both 20 degrees C and 30 degrees C recovers ischemic rat livers for successful transplantation. J. Surg. Res. 175 (1), 149-156 (2012).
- Gringeri, E., et al. Subnormothermic machine perfusion for non-heart-beating donor liver grafts preservation in a swine model: A new strategy to increase the donor pool? Transplant. Proc. 44 (7), 2026-2028 (2012).
- Bruinsma, B. G., et al. Subnormothermic machine perfusion for ex vivo preservation and recovery of the human liver for transplantation. Am. J. Transplant. 14 (6), 1400-1409 (2014).
- op den Dries, S., et al. Ex vivo normothermic machine perfusion and viability testing of discarded human donor livers. Am. J. Transplant. 13 (5), 1327-1335 (2013).
- Sutton, M. E., et al. Criteria for viability assessment of discarded human donor livers during ex vivo normothermic machine perfusion. PLoS. One. 9 (11), (2014).
- Minor, T., Efferz, P., Fox, M., Wohlschlaeger, J., Luer, B. Controlled oxygenated rewarming of cold stored liver grafts by thermally graduated machine perfusion prior to reperfusion. Am. J. Transplant. 13 (6), 1450-1460 (2013).
- Makowka, L., et al. Surgical technique of orthotopic liver transplantation. Gastroenterol. Clin. North. Am. 17 (1), 33-51 (1988).
- Hansen, T., et al. Histological examination and evaluation of donor bile ducts received during orthotopic liver transplantation–a morphological clue to ischemic-type biliary lesion?. Virchows Arch. 461 (1), 41-48 (2012).
- Monbaliu, D., Brassil, J. Machine perfusion of the liver: Past, present and future. Curr. Opin. Organ. Transplant. 15 (2), 160-166 (2010).
- Oldani, G., et al. Pre-retrieval reperfusion decreases cancer recurrence after rat ischemic liver graft transplantation. J. Hepatol. 61 (2), 278-285 (2014).
- Tromans, D. Temperature and pressure dependent solubility of oxygen in water: A thermodynamic analysis. Hydrometallurgy. 48 (3), 327-342 (1998).

