Ex Situ Normotérmica máquina de perfusión de hígados de donantes
Summary
Aquí se presenta un protocolo que describe ex situ oxigenada máquina de perfusión de los injertos de hígado de donantes. Este artículo contiene un paso a paso el protocolo para adquirir y preparar el injerto hepático para la máquina de perfusión, preparar el líquido de perfusión, cebar la máquina de perfusión y realizar oxigenada máquina de perfusión normotérmica del injerto hepático.
Abstract
En contraste con la conservación en frío estática convencional (0-4 ° C), ex máquina de perfusión in situ puede proporcionar una mejor conservación de los hígados de donantes. La perfusión continua de órganos ofrece la oportunidad de mejorar la calidad del órgano y permite ex situ evaluación de la viabilidad de hígados de donantes antes del trasplante. Este artículo de vídeo proporciona un paso a paso para protocolo ex situ máquina de perfusión normotérmica (37 ° C) de hígados de donantes humanos utilizando un dispositivo que proporciona una presión y temperatura controlada pulsátil de perfusión de la arteria hepática y la perfusión continua de la vena portal. El fluido de perfusión se oxigena por dos oxigenadores de membrana de fibra hueca y la temperatura se puede regular entre 10 ° C y 37 ° C. Durante la perfusión, la actividad metabólica del hígado, así como el grado de lesión pueden ser evaluados por análisis bioquímico de muestras tomadas del líquido de perfusión. Perfusión Machine es una herramienta muy prometedorapara aumentar el número de hígados que son adecuados para el trasplante.
Introduction
El método actual de preservación de órganos en el trasplante de hígado es enjuagar con y posterior almacenamiento de los hígados de donantes en frío (0-4 ° C) de líquido de conservación (como Universidad de Wisconsin solución o la solución de histidina-triptófano-cetoglutarato). Este método se conoce como almacenamiento en frío estático (SCS). Aunque la tasa metabólica de los hígados a 0-4 ° C es muy baja, todavía existe la demanda de 0,27 mol de oxígeno / min / g de tejido de hígado, que no puede ser proporcionado durante 1 SCS. El método convencional de SCS, por lo tanto, resulta en cierto grado de lesión (adicional) de hígados de donantes. Si bien esta cantidad de lesiones conservación no es un problema en los hígados de donantes de buena calidad, puede convertirse en un factor crítico y limitante en hígados subóptimos que ya han sufrido algún grado de lesión en el donante. Por esta razón, los hígados con una calidad subóptima o llamados criterios extendida donantes (ECD) hígados se rechazan con frecuencia para el trasplante como la o riesgof fracaso del injerto temprano se considera que es demasiado alto. Los altos índices de función retardada del injerto, no función primaria, y las estenosis biliares no anastomóticas (NAS) se han descrito en los receptores de hígados de donación después de la muerte circulatorio (DCD), los donantes de mayor edad o receptores de injertos esteatósicos 2. NAS son una causa importante de morbilidad y mortalidad después del trasplante hepático. NAS puede ocurrir tanto en los conductos biliares donante extra e intra y puede ser acompañado de barro biliar intraductal y la formación de yeso 3,4. Aunque la etiología de la NAS se cree que es multifactorial, la lesión por isquemia / reperfusión de los conductos biliares durante la conservación de injerto y el trasplante ha sido identificado como un importante mecanismo de 2,5 subyacente. Trasplante de un injerto DCD ha sido identificado como uno de los mayores factores de riesgo para el desarrollo de NAS. La combinación de un periodo de isquemia caliente en un donante DCD, isquemia fría durante la preservación de órganos, y la posterior reperfusiónlesiones en el receptor se cree que es responsable de la lesión irreversible de las vías biliares, que, en combinación con una pobre capacidad de regeneración de los conductos biliares, da lugar a cicatrices fibróticas y el estrechamiento de los conductos biliares después del trasplante hepático 2,5. NAS se han reportado hasta en el 30% de los pacientes que recibieron un hígado DCD 6-8. Ha quedado claro que el método actual de SCS de injertos de hígado para el trasplante es insuficiente para hígados ECD preinjured como los de donantes DCD. Se necesitan métodos alternativos para aumentar y optimizar el uso de hígados de DIT para el trasplante.
Máquina de perfusión (MP) es un método de preservación de órganos que pueden proporcionar una mejor preservación de órganos de donantes, en comparación con SCS. MP podría ser especialmente relevante para la preservación de los injertos de ECD. Una ventaja importante de MP es la posibilidad de proporcionar oxígeno para el injerto durante el periodo de preservación. MP se puede realizar a diversas temperaturas,que han sido clasificados como hipotermia (0-10 ° C), subnormothermic (10-36 ° C) y normotérmica (36-37 ° C) MP (NMP). Dependiendo de la temperatura utilizada para MP, el tipo de fluido de perfusión tiene que ser ajustado y con el aumento de temperatura más oxígeno debe ser suministrado. La primera aplicación clínica de la MP en el trasplante de hígado humano se basó en perfusión hipotérmica sin oxigenación activa del 9,10 fluido de perfusión. En modelos animales, MP oxigenada hipotermia (0-10 ° C) se ha demostrado que tiene efectos protectores contra la isquemia / reperfusión del hígado injerta 11 y proporcionar una mejor conservación del plexo vascular peribiliary de los conductos biliares 12. Subnormothermic oxigenada MP a 20 ° C o 30 ° C también se ha estudiado en modelos animales y se demostró para proporcionar la recuperación anterior de la función del injerto de hígados DCD, en comparación con SCS 13,14. La viabilidad de MP subnormothermic oxigenada de hígados humanos fue rectemente reportado en una serie de siete hígados de donantes humanos desechados 15. NMP (37 ° C) permite la evaluación de la viabilidad del injerto y la funcionalidad antes del trasplante 16,17. Además, MP permite recalentamiento gradual del injerto hepático antes del trasplante, que ha sido demostrado para facilitar la recuperación y reanimación del injerto 18.
El dispositivo de perfusión utilizada en el protocolo actual de la máquina de perfusión hepática permite dual de perfusión (a través de la vena porta y la arteria hepática) usando dos bombas centrífugas, que proporcionan un flujo portal continuo y un flujo arterial pulsátil. El sistema es controlado por presión, lo que permite auto-regulación del flujo a través del hígado, dependiendo de la resistencia intrahepática. Dos oxigenadores de membrana de fibra hueca permiten la oxigenación del injerto hepático, así como para la eliminación de CO 2. La temperatura se puede ajustar en función del tipo previsto de MP (temperat mínimo ure de 10 ° C). Flujo, presión y temperatura se visualizan en el dispositivo en tiempo real, lo que permite un control continuo del proceso de perfusión. Un nuevo equipo desechable estéril de tubos, depósito y oxigenadores está disponible para la perfusión de cada injerto (Figura 1).
El objetivo de este artículo de vídeo es proporcionar un paso a paso para el protocolo ex situ máquina de perfusión normotérmica de hígados de donantes humanos usando esta máquina de perfusión hepática de nuevo desarrollo.
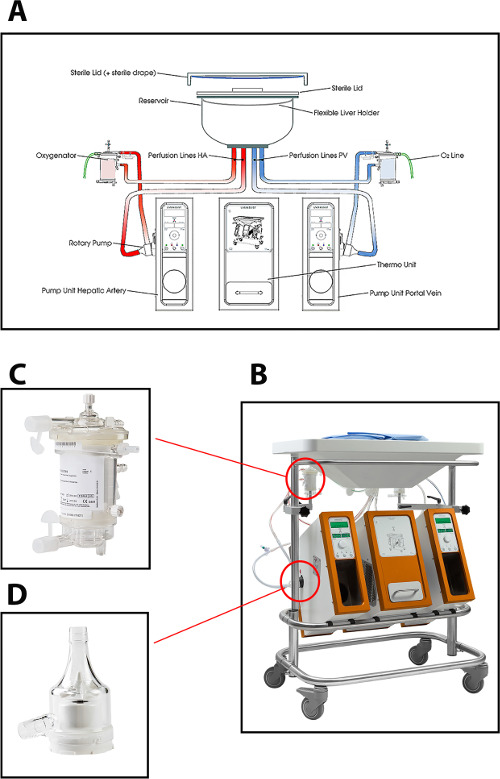
Figura 1: (A) Un dibujo esquemático, (B) una foto de la máquina de perfusión, (C) una vista más cercana del oxigenador, y (D) de la bomba centrífuga utilizada para la perfusión normotérmica de hígados de donantes humanos.conseguir = "_ blank"> Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
Este video ofrece un paso a paso para el protocolo máquina de perfusión normotérmica de hígados de donantes humanos usando un dispositivo que permite controlar la presión de doble perfusión a través de la vena porta hepática y la arteria. Al seguir este protocolo, fallas técnicas de la máquina de perfusión no ocurrieron y todos los injertos estaban bien perfundido y bien oxigenada. Los hígados perfundidos in situ ex tenían la hemodinámica estable y eran metabólicamente activa, según la definici?…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Este trabajo de investigación fue financiada por donaciones otorgados por Innovatief Actieprogramma Groningen (IAG-3), Jan de Cock Kornelis Stichting y Tekke Huizingafonds, todo en los Países Bajos. Estamos agradecidos a todos los coordinadores de trasplante holandeses para la identificación de los posibles descartados hígados y obtener el consentimiento informado.
Materials
| Liver Assist | Organ Assist | OA.Li.Li.140 | Perfusion device |
| Liver Assist disposable package | Organ Assist | OA.Li.DP.540 | Disposable set and cannulas |
| Meredith No.8 | Vygon Nederlands B.V. | 1362082 | Bile duct cannula |
| Human albumin 200g/l / ALBUMAN | Sanquin | 15522598 | 100 ml |
| Modified parenteral nutrition | Baxter Nederland B.V. | N14G30E | 7.35 ml |
| Multivitamins for infusion / CERNEVIT | Baxter International Inc. | 9800927 | 7 ul |
| Concentrated trace elements for infusion / NUTRITRACE | B. Braun Melsungen AG | 14811332 | 7.35 ml |
| Metronidazole 5mg/ml | Baxter Nederland B.V. | 98181882 | 40 ml |
| Cefazoline / SERVAZOLIN | Sandoz B.V. | 15611337 | 2 ml |
| Fast acting insulin | various vendors | 20 ml | |
| Calcium glubionate, intravenous solution 10%, 137.5 mg/mL | Sandoz | 97038695 | 40 ml |
| Sterile H2O | Fresenius Kabi Nederland B.V. | 98084453 | 51.3 ml |
| NaCl 0.9% | Baxter Nederland B.V. | 15262510 | 160 ml |
| Heparin 5000 IE/ml for i.v. administration | LEO Pharma B.V. | 98026178 | 4 ml |
| Sodium bicarbonate 8,4% | B. Braun Melsungen AG | 97973874 | The amount depends on the pH |
| Packed red blood cell (in SAGM) | Blood bank (Sanquin) | N0012000 | 750 ml |
| Fresh frozen plasma | Blood bank (Sanquin) | N04030A0/N04030B0 | 900 ml |
Riferimenti
- Plaats, A., et al. Hypothermic machine preservation in liver transplantation revisited: Concepts and criteria in the new millennium. Ann. Biomed. Eng. 32 (4), 623-631 (2004).
- op den Dries, S., Sutton, M. E., Lisman, Y., Porte, R. J. Protection of bile ducts in liver transplantation: Looking beyond ischemia. Transplantation. 92 (4), 373-379 (2011).
- Seehofer, D., Eurich, D., Veltzke-Schlieker, W., Neuhaus, P. Biliary complications after liver transplantation: Old problems and new challenges. Am. J. Transplant. 13 (2), 253-265 (2013).
- Buis, C. I., et al. Nonanastomotic biliary strictures after liver transplantation, part 1: Radiological features and risk factors for early vs. late presentation. Liver. Transpl. 13 (5), 708-718 (2007).
- Karimian, N., op den Dries, S., Porte, R. J. The origin of biliary strictures after liver transplantation: Is it the amount of epithelial injury or insufficient regeneration that counts. J. Hepatol. 58 (6), 1065-1067 (2013).
- Gastaca, M. Biliary complications after orthotopic liver transplantation: A review of incidence and risk factors. Transplant. Proc. 44 (6), 1545-1549 (2012).
- Sanchez-Urdazpal, L., et al. Ischemic-type biliary complications after orthotopic liver transplantation. Hepatology. 16 (1), 49-53 (1992).
- Dubbeld, J., et al. Similar liver transplantation survival with selected cardiac death donors and brain death donors. Br. J. Surg. 97 (5), 744-753 (2010).
- Guarrera, J. V., et al. Hypothermic machine preservation in human liver transplantation: The first clinical series. Am. J. Transplant. 10 (2), 372-381 (2010).
- Henry, S. D., et al. Hypothermic machine preservation reduces molecular markers of ischemia/reperfusion injury in human liver transplantation. Am. J. Transplant. 12 (9), 2477-2486 (2012).
- Schlegel, A., Rougemont, O., Graf, R., Clavien, P. A., Dutkowski, P. Protective mechanisms of end-ischemic cold machine perfusion in DCD liver grafts. J. Hepatol. 58 (2), 278-286 (2013).
- op den Dries, S., et al. Hypothermic oxygenated machine perfusion prevents arteriolonecrosis of the peribiliary plexus in pig livers donated after circulatory death. PLoS. One. 9 (2), e88521 (2014).
- Tolboom, H., et al. Subnormothermic machine perfusion at both 20 degrees C and 30 degrees C recovers ischemic rat livers for successful transplantation. J. Surg. Res. 175 (1), 149-156 (2012).
- Gringeri, E., et al. Subnormothermic machine perfusion for non-heart-beating donor liver grafts preservation in a swine model: A new strategy to increase the donor pool? Transplant. Proc. 44 (7), 2026-2028 (2012).
- Bruinsma, B. G., et al. Subnormothermic machine perfusion for ex vivo preservation and recovery of the human liver for transplantation. Am. J. Transplant. 14 (6), 1400-1409 (2014).
- op den Dries, S., et al. Ex vivo normothermic machine perfusion and viability testing of discarded human donor livers. Am. J. Transplant. 13 (5), 1327-1335 (2013).
- Sutton, M. E., et al. Criteria for viability assessment of discarded human donor livers during ex vivo normothermic machine perfusion. PLoS. One. 9 (11), (2014).
- Minor, T., Efferz, P., Fox, M., Wohlschlaeger, J., Luer, B. Controlled oxygenated rewarming of cold stored liver grafts by thermally graduated machine perfusion prior to reperfusion. Am. J. Transplant. 13 (6), 1450-1460 (2013).
- Makowka, L., et al. Surgical technique of orthotopic liver transplantation. Gastroenterol. Clin. North. Am. 17 (1), 33-51 (1988).
- Hansen, T., et al. Histological examination and evaluation of donor bile ducts received during orthotopic liver transplantation–a morphological clue to ischemic-type biliary lesion?. Virchows Arch. 461 (1), 41-48 (2012).
- Monbaliu, D., Brassil, J. Machine perfusion of the liver: Past, present and future. Curr. Opin. Organ. Transplant. 15 (2), 160-166 (2010).
- Oldani, G., et al. Pre-retrieval reperfusion decreases cancer recurrence after rat ischemic liver graft transplantation. J. Hepatol. 61 (2), 278-285 (2014).
- Tromans, D. Temperature and pressure dependent solubility of oxygen in water: A thermodynamic analysis. Hydrometallurgy. 48 (3), 327-342 (1998).

