Ex Situ normotermica macchina di perfusione di Vivi donatori
Summary
Qui vi presentiamo un protocollo che descrive ossigenato ex situ macchina di perfusione di fegati donatore. Questo articolo contiene un passo per passo protocollo di procurarsi e preparare il trapianto di fegato per la macchina di perfusione, preparare il liquido di perfusione, primo la macchina di perfusione ed eseguire ossigenato normotermica macchina perfusione del trapianto di fegato.
Abstract
In contrasto con conservazione a freddo statico convenzionale (0-4 ° C), ex situ perfusione macchina può fornire una migliore conservazione di fegati di donatori. Perfusione continua degli organi offre l'opportunità di migliorare la qualità di organi e permette ex valutazione della vitalità economica situ di fegati donatori prima del trapianto. Questo articolo video fornisce un passo per passo protocollo per ex situ perfusione macchina normotermica (37 ° C) di fegati di donatori umani utilizzando un dispositivo che fornisce una pressione e temperatura controllate pulsatile perfusione dell'arteria epatica e perfusione continua della vena porta. Il liquido di perfusione viene ossigenata da due ossigenatori a membrana a fibre cave e la temperatura può essere regolata tra 10 ° C e 37 ° C. Durante la perfusione, l'attività metabolica del fegato così come il grado di lesione può essere valutata mediante analisi biochimica dei campioni prelevati dal liquido di perfusione. Perfusione macchina è uno strumento molto promettenteper aumentare il numero di fegati che sono adatti per il trapianto.
Introduction
L'attuale metodo di conservazione dell'organo nel trapianto di fegato è a filo con e successivo stoccaggio di fegatini di donatori a freddo (0-4 ° C) del liquido di conservazione (come ad esempio l'Università di Wisconsin soluzione o la soluzione Istidina-triptofano-chetoglutarato). Questo metodo è denominato frigoconservazione statica (SCS). Sebbene il tasso metabolico di fegati a 0-4 ° C è molto basso, vi è ancora richiesta per / min / g di tessuto epatico 0,27 mmol ossigeno, che non possono essere forniti durante SCS 1. Il metodo convenzionale di SCS, quindi, si traduce in un certo grado di (ulteriore) lesione di fegatini di donatori. Anche se questa quantità di lesioni conservazione non è un problema nel fegato del donatore di buona qualità, può diventare un fattore critico e limitante fegati non ottimali che hanno già subito un certo grado di lesione del donatore. Per questo motivo, fegatini con una qualità non ottimale o cosiddetti criteri esteso donatore (ECD) fegati sono spesso respinte per il trapianto come il rischio of fallimento precoce innesto viene considerato troppo alto. Alti tassi di funzione in ritardo trapianto, non funzione primaria, e stenosi biliari non anastomotiche (NAS) sono stati descritti nei riceventi di fegati da donazione dopo la morte circolatorio (DCD), i donatori di età superiore o destinatari di innesti steatosico 2. NAS sono una delle principali cause di morbilità e mortalità dopo trapianto di fegato. NAS può verificarsi in entrambi i dotti biliari extra-donatore e intraepatiche e può essere accompagnata da intraduttale fango biliare e la formazione di fusione 3,4. Sebbene l'eziologia di NAS è pensato per essere multifattoriale, danno da ischemia / riperfusione dei dotti biliari durante la conservazione del trapianto e trapianto è stato identificato come uno dei principali sottostante meccanismo di 2,5. Il trapianto di un innesto DCD è stato identificato come uno dei più forti fattori di rischio per lo sviluppo di NAS. La combinazione di un periodo di ischemia calda in un donatore DCD, ischemia fredda durante la conservazione di organi, e successiva riperfusionelesioni nel ricevente è pensato per essere responsabile per lesione irreversibile delle vie biliari, che, in combinazione con una scarsa capacità rigenerativa dei dotti biliari, provoca cicatrici fibrotica e restringimento delle vie biliari dopo trapianto di fegato 2,5. NAS sono stati segnalati nel 30% dei pazienti che hanno ricevuto un fegato DCD 6-8. È ormai chiaro che l'attuale metodo di SCS di fegati per il trapianto non è sufficiente per preinjured fegati ECD come quelli da donatori DCD. Metodi alternativi sono necessari per aumentare e ottimizzare l'utilizzo di fegati ECD per il trapianto.
Macchina perfusione (MP) è un metodo di conservazione di organi che possono fornire una migliore conservazione di organi, rispetto a SCS. MP potrebbe essere particolarmente rilevante per la conservazione di innesti ECD. Un importante vantaggio di MP è la possibilità di fornire l'ossigeno per l'innesto durante il periodo di conservazione. MP può essere eseguita a varie temperature,che sono stati classificati come ipotermico (0-10 ° C), subnormothermic (10-36 ° C) e normotermica (36-37 ° C) MP (NMP). A seconda della temperatura utilizzata per MP, il tipo di liquido di perfusione deve essere regolata e con l'aumentare della temperatura più ossigeno deve essere fornito. La prima applicazione clinica di MP nel trapianto di fegato umano è stato basato sulla perfusione ipotermica senza l'ossigenazione attiva del 9,10 liquido di perfusione. In modelli animali, ipotermia MP ossigenata (0-10 ° C) ha dimostrato di avere effetti protettivi contro l'ischemia / riperfusione del fegato innesti 11 e per fornire una migliore conservazione del plesso vascolare peribiliare della bile condotti 12. Subnormothermic ossigenato MP a 20 ° C o 30 ° C è stato anche studiato in modelli animali e ha dimostrato di fornire prima il recupero della funzione del trapianto di fegati DCD, rispetto a SCS 13,14. La fattibilità di subnormothermic MP ossigenato di fegato umano è stata recdipendentemente riportato in una serie di sette fegati donatori umani scartati 15. NMP (37 ° C), permette la valutazione della fattibilità del trapianto e la funzionalità prima del trapianto 16,17. Inoltre, MP consente graduale rewarming dell'innesto epatica prima del trapianto, che è stato dimostrato per facilitare il recupero e rianimazione dell'innesto 18.
Il dispositivo perfusione utilizzato nel protocollo corrente epatica perfusione macchina consente dual perfusione (attraverso la vena porta e l'arteria epatica) utilizzando due pompe centrifughe, che forniscono un continuo flusso portale e un flusso pulsatile arteriosa. Il sistema è a pressione controllata, permettendo autoregolazione del flusso attraverso il fegato, a seconda della resistenza intraepatica. Due cavi ossigenatori a membrana fibra consentono l'ossigenazione del trapianto di fegato, come pure per la rimozione di CO 2. La temperatura può essere impostata in base al tipo previsto di MP (temperat minima ure di 10 ° C). Portata, pressione e temperatura vengono visualizzati sul dispositivo in tempo reale consentendo un controllo continuo del processo di perfusione. Un nuovo set monouso sterile tubi, serbatoio e ossigenatori è disponibile per la perfusione di ogni innesto (figura 1).
Lo scopo di questo articolo il video è quello di fornire un passo per passo protocollo per ex situ macchina normotermica perfusione di fegati di donatori umani che utilizzano questa macchina di perfusione epatica di nuova concezione.
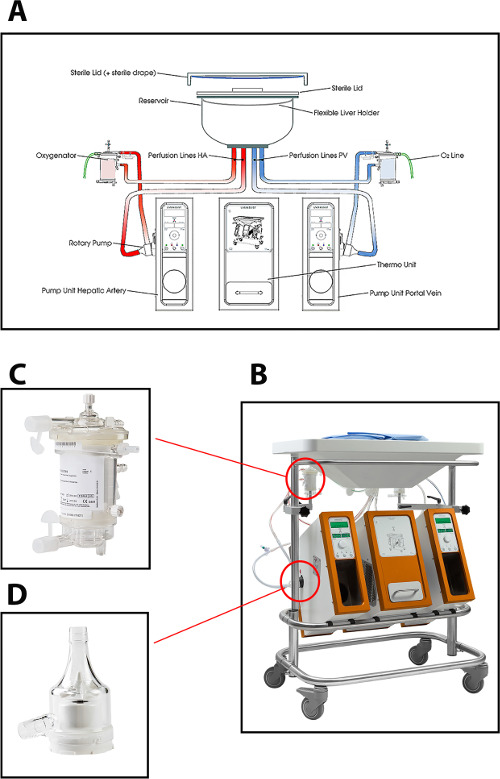
Figura 1: (A) Un disegno schematico, (B) una foto della macchina perfusione, (C) una vista ravvicinata della ossigenatore, e (D) pompa centrifuga usata per la perfusione normotermica di fegati di donatori umani.ottenere = "_ blank"> Clicca qui per vedere una versione più grande di questa figura.
Protocol
Representative Results
Discussion
Questo video offre un passo per passo protocollo per normotermica macchina di perfusione di fegatini di donatori umani utilizzando un dispositivo che consente a pressione controllata a doppio perfusione attraverso la arteria epatica e vena porta. Seguendo questo protocollo, guasti tecnici della macchina di perfusione non si è verificato e tutti gli innesti sono stati ben perfuso e ben ossigenato. I situ perfuso fegati ex avevano emodinamica stabile ed erano metabolicamente attiva, come definito dalla …
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Questo lavoro di ricerca è stato sostenuto finanziariamente da sovvenzioni fornite da Innovatief Actieprogramma Groningen (IAG-3), Jan de Cock Kornelis Stichting e Tekke Huizingafonds, tutto nei Paesi Bassi. Siamo grati a tutti i coordinatori di trapianto olandesi per identificare i potenziali scartato fegatini e ottenere il consenso informato.
Materials
| Liver Assist | Organ Assist | OA.Li.Li.140 | Perfusion device |
| Liver Assist disposable package | Organ Assist | OA.Li.DP.540 | Disposable set and cannulas |
| Meredith No.8 | Vygon Nederlands B.V. | 1362082 | Bile duct cannula |
| Human albumin 200g/l / ALBUMAN | Sanquin | 15522598 | 100 ml |
| Modified parenteral nutrition | Baxter Nederland B.V. | N14G30E | 7.35 ml |
| Multivitamins for infusion / CERNEVIT | Baxter International Inc. | 9800927 | 7 ul |
| Concentrated trace elements for infusion / NUTRITRACE | B. Braun Melsungen AG | 14811332 | 7.35 ml |
| Metronidazole 5mg/ml | Baxter Nederland B.V. | 98181882 | 40 ml |
| Cefazoline / SERVAZOLIN | Sandoz B.V. | 15611337 | 2 ml |
| Fast acting insulin | various vendors | 20 ml | |
| Calcium glubionate, intravenous solution 10%, 137.5 mg/mL | Sandoz | 97038695 | 40 ml |
| Sterile H2O | Fresenius Kabi Nederland B.V. | 98084453 | 51.3 ml |
| NaCl 0.9% | Baxter Nederland B.V. | 15262510 | 160 ml |
| Heparin 5000 IE/ml for i.v. administration | LEO Pharma B.V. | 98026178 | 4 ml |
| Sodium bicarbonate 8,4% | B. Braun Melsungen AG | 97973874 | The amount depends on the pH |
| Packed red blood cell (in SAGM) | Blood bank (Sanquin) | N0012000 | 750 ml |
| Fresh frozen plasma | Blood bank (Sanquin) | N04030A0/N04030B0 | 900 ml |
Riferimenti
- Plaats, A., et al. Hypothermic machine preservation in liver transplantation revisited: Concepts and criteria in the new millennium. Ann. Biomed. Eng. 32 (4), 623-631 (2004).
- op den Dries, S., Sutton, M. E., Lisman, Y., Porte, R. J. Protection of bile ducts in liver transplantation: Looking beyond ischemia. Transplantation. 92 (4), 373-379 (2011).
- Seehofer, D., Eurich, D., Veltzke-Schlieker, W., Neuhaus, P. Biliary complications after liver transplantation: Old problems and new challenges. Am. J. Transplant. 13 (2), 253-265 (2013).
- Buis, C. I., et al. Nonanastomotic biliary strictures after liver transplantation, part 1: Radiological features and risk factors for early vs. late presentation. Liver. Transpl. 13 (5), 708-718 (2007).
- Karimian, N., op den Dries, S., Porte, R. J. The origin of biliary strictures after liver transplantation: Is it the amount of epithelial injury or insufficient regeneration that counts. J. Hepatol. 58 (6), 1065-1067 (2013).
- Gastaca, M. Biliary complications after orthotopic liver transplantation: A review of incidence and risk factors. Transplant. Proc. 44 (6), 1545-1549 (2012).
- Sanchez-Urdazpal, L., et al. Ischemic-type biliary complications after orthotopic liver transplantation. Hepatology. 16 (1), 49-53 (1992).
- Dubbeld, J., et al. Similar liver transplantation survival with selected cardiac death donors and brain death donors. Br. J. Surg. 97 (5), 744-753 (2010).
- Guarrera, J. V., et al. Hypothermic machine preservation in human liver transplantation: The first clinical series. Am. J. Transplant. 10 (2), 372-381 (2010).
- Henry, S. D., et al. Hypothermic machine preservation reduces molecular markers of ischemia/reperfusion injury in human liver transplantation. Am. J. Transplant. 12 (9), 2477-2486 (2012).
- Schlegel, A., Rougemont, O., Graf, R., Clavien, P. A., Dutkowski, P. Protective mechanisms of end-ischemic cold machine perfusion in DCD liver grafts. J. Hepatol. 58 (2), 278-286 (2013).
- op den Dries, S., et al. Hypothermic oxygenated machine perfusion prevents arteriolonecrosis of the peribiliary plexus in pig livers donated after circulatory death. PLoS. One. 9 (2), e88521 (2014).
- Tolboom, H., et al. Subnormothermic machine perfusion at both 20 degrees C and 30 degrees C recovers ischemic rat livers for successful transplantation. J. Surg. Res. 175 (1), 149-156 (2012).
- Gringeri, E., et al. Subnormothermic machine perfusion for non-heart-beating donor liver grafts preservation in a swine model: A new strategy to increase the donor pool? Transplant. Proc. 44 (7), 2026-2028 (2012).
- Bruinsma, B. G., et al. Subnormothermic machine perfusion for ex vivo preservation and recovery of the human liver for transplantation. Am. J. Transplant. 14 (6), 1400-1409 (2014).
- op den Dries, S., et al. Ex vivo normothermic machine perfusion and viability testing of discarded human donor livers. Am. J. Transplant. 13 (5), 1327-1335 (2013).
- Sutton, M. E., et al. Criteria for viability assessment of discarded human donor livers during ex vivo normothermic machine perfusion. PLoS. One. 9 (11), (2014).
- Minor, T., Efferz, P., Fox, M., Wohlschlaeger, J., Luer, B. Controlled oxygenated rewarming of cold stored liver grafts by thermally graduated machine perfusion prior to reperfusion. Am. J. Transplant. 13 (6), 1450-1460 (2013).
- Makowka, L., et al. Surgical technique of orthotopic liver transplantation. Gastroenterol. Clin. North. Am. 17 (1), 33-51 (1988).
- Hansen, T., et al. Histological examination and evaluation of donor bile ducts received during orthotopic liver transplantation–a morphological clue to ischemic-type biliary lesion?. Virchows Arch. 461 (1), 41-48 (2012).
- Monbaliu, D., Brassil, J. Machine perfusion of the liver: Past, present and future. Curr. Opin. Organ. Transplant. 15 (2), 160-166 (2010).
- Oldani, G., et al. Pre-retrieval reperfusion decreases cancer recurrence after rat ischemic liver graft transplantation. J. Hepatol. 61 (2), 278-285 (2014).
- Tromans, D. Temperature and pressure dependent solubility of oxygen in water: A thermodynamic analysis. Hydrometallurgy. 48 (3), 327-342 (1998).

