Fabrication des Thermoresponsive Hydrogels dégradable sur plusieurs échelles de longueur par Extrusion réactive, microfluidique, auto-assemblage et électrofilage
Summary
Les protocoles sont décrits pour la fabrication des hydrogels biodégradables thermoresponsive basés sur hydrazone réticulation de polymères oligomères sur la balance en vrac a petite Echelle, échelle nanométrique et ce dernier pour la préparation de nanoparticules de gel et de nanofibres.
Abstract
Alors que divers matériaux intelligents ont été explorées pour une variété d’applications biomédicales (p. ex., MEDICAMENTS, génie tissulaire, bio-imagerie, etc.), leur utilisation clinique ultime a été entravée par le manque de biologiquement pertinentes dégradation observée pour les matériaux plus intelligents. Cela est particulièrement vrai pour les température hydrogels, qui reposent presque uniformément sur les polymères qui sont fonctionnellement non dégradables (par exemple, poly(N-isopropylacrylamide) (PNIPAM) ou poly (méthacrylate de glycol d’oligoéthylène) (POEGMA) ). Par conséquent, pour effectivement traduire le potentiel des hydrogels thermoresponsive aux défis de la délivrance des médicaments télécommandé ou réglementées du métabolisme, cellule échafaudages avec des interactions cellule-matériau accordables, théranostiques matériaux avec le potentiel pour l’imagerie et medicaments et ces autres demandes, une méthode est nécessaire pour restituer les hydrogels (si pas entièrement dégradable) au moins capable de la clairance rénale suite à la durée de vie exigée du matériau. À cette fin, ce protocole décrit la préparation d’hydrogels hydrolytiquement-dégradables hydrazone-RETICULE sur plusieurs échelles de longueur basées sur la réaction entre l’hydrazide maléique et oligomères fonctionnalisés aldéhyde de PNIPAM ou POEGMA avec moléculaire poids inférieur à la limite de la filtration rénale. Plus précisément, les méthodes pour fabriquer thermoresponsive dégradables en vrac hydrogels (en utilisant une technique de seringue double barillet), particules d’hydrogel (sur les deux la micro-échelle grâce à l’utilisation d’une plate-forme microfluidique facilitant le mélange simultané et émulsion de polymères précurseur et l’échelle nanométrique par l’utilisation d’un moteur thermique auto-assemblage et réticulation méthode), et nanofibres hydrogel (en utilisant une stratégie réactive électrofilage) sont décrites. Dans chaque cas, hydrogels avec température sensibles aux propriétés similaires à ceux obtenus par l’intermédiaire radicalaire classique processus de réticulation est possible, mais le réseau réticulé hydrazone peut se dégrader au fil du temps pour re-former les oligomères polymères de précurseur et la clairance de l’activer. Par conséquent, nous prévoyons que ces méthodes (qui peut être générique appliquée à tout synthétique polymère soluble dans l’eau, smart non seulement des matériaux) permettront de traduction plus facile des matériaux intelligents synthétiques aux applications cliniques.
Introduction
Les matériaux intelligents ont attiré beaucoup d’attention en raison de leur potentiel de réversibles « on-demand » réponses aux signaux externes et/ou environnementaux. Des matériaux sensibles aux températures ont suscité un intérêt particulier en raison de leur comportement inférieure de température (LCST) critique de la solution, résultant dans les précipitations axée sur la température à une température T > LCST1,2. Dans le contexte des hydrogels thermoresponsive, ce problème de température critique de la solution inférieur se manifeste par réversibles gonflement/désactiver-swelling événements qui donnent lieu à des tailles de température accordable en vrac (plus grosses au T < LCST)3, la taille des pores (plus grande à T < LCST)4et propriétés interfaciales (plus hydrophile à T < LCST)5. Ces transitions ont été largement appliquées dans l’administration de médicaments (médicament externe ou pour l’environnement-triggerable version4,6,,7), tissus techniques et la culture cellulaire (pour adhésion cellulaire THERMORÉVERSIBLE / délamination8,9,10), cessations d’emploi (pour les porosités de la membrane commutable et perméabilités ou prise en charge diagnostique thermiquement recyclables11,12, ( 13), traite de microfluidique (pour les robinets d’arrêt régulation débit14,,15) et les modificateurs rhéologiques (pour température accordable viscosités16). Les plus couramment étudiées thermoresponsive hydrogels sont basés sur poly(N-isopropylacrylamide) (PNIPAM)17, bien que le travail important (et croissant) ont également porté sur poly (méthacrylate de glycol d’oligoéthylène) (POEGMA)2 ,18 et poly(vinylcaprolactam) (PVCL)19,20. POEGMA a attiré un intérêt récent particulier compte tenu de sa biocompatibilité amélioration prévue21,22et son comportement LCST de facile-à-tune, dans lesquelles les mélanges linéairement prévisible des monomères avec différents nombres de unités de répétition de l’oxyde d’éthylène dans leurs chaînes latérales peuvent altérer la LCST de ~ 20 ° C à > 90 ° C2,23. Cependant, chacun de ces polymères est préparé par polymérisation radicalaire et contient donc une épine dorsale de carbone-carbone, limitant considérablement l’utilité potentielle et la traduisibilité de tels polymères dans le cadre d’applications biomédicales dans lequel dégradation (ou au moins la capacité pour les formalités de filtration rénale) y a une exigence.
En réponse à cette limitation, nous avons rapporté récemment largement sur l’application de la chimie de l’hydrazone (i.e., la réaction entre l’hydrazide maléique et aldéhyde-functionalized des prépolymères) pour préparer dégradables analogues de thermoresponsive hydrogels24,25,26,27,28,29. Permet à la réaction rapide et réversible entre groupes hydrazide maléique et aldéhyde sur le mélange des polymères fonctionnalisés précurseur30 fois gelation in situ (permettant l’injection facile de ces matériaux sans besoin de chirurgie implantation ou n’importe quel type de stimulus de polymérisation externe comme initiation de chimiques ou irradiation UV) ainsi que la dégradation hydrolytique du réseau à une vitesse contrôlée par la chimie et de la densité des sites de réticulation. Par ailleurs, en maintenant le poids moléculaire des des prépolymères utilisés pour préparer les hydrogels inférieures à la limite de la filtration rénale, hydrogels, faites à l’aide de cette approche se dégrader dans les polymères d’oligomères précurseur qui peuvent être éliminés de l’organisme25 ,27,28. Associée à la faible cytotoxicité et réponse faible tissu inflammatoire induite par ces matériaux25,26,27, cette approche offre une méthode potentiellement traduisible pour l’utilisation de thermoresponsive hydrogels intelligentes en médecine, en particulier si bien contrôlées dégradables analogues de ces hydrogels sur toutes les échelles de longueur (en vrac, micro et nano) peuvent être fabriquées.
Dans ce protocole, nous décrivons les procédés de fabrication synthétique thermoresponsive pré polymères fonctionnalisés avec des numéros contrôlés de l’hydrazide maléique et les groupes aldéhyde ainsi que méthodes pour appliquer ces polymères pour créer des hydrogels de dimensions bien définies sur différentes échelles de longueur. En particulier, ce manuscrit décrit quatre approches distinctes nous ont mis au point pour contrôler le mélange de l’hydrazide maléique réactive et aldéhyde-functionalized des prépolymères et créer ainsi des thermoresponsive hydrogel réseaux avec des géométries bien définis et morphologies :
Pour créer les hydrogels biodégradables en vrac avec des tailles définies, une stratégie de création de modèles est décrite par lequel les prépolymères réactives sont chargés dans des barriques séparées d’une seringue double barillet équipé à sa sortie d’un mélangeur statique et par la suite coextrudé en un Moule silicone avec l’hydrogel désiré forme et dimensions21,27 (Figure 1).
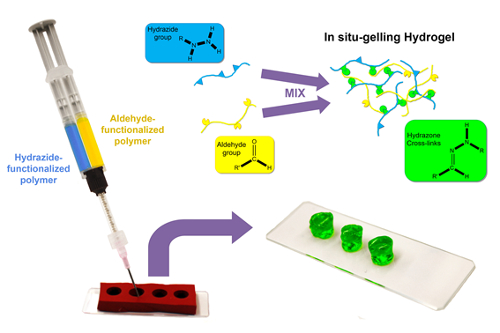
Figure 1 : Schéma de formation hydrogel en vrac. Hydrazide maléique et solutions de polymères fonctionnalisés aldéhyde (dans l’eau ou un tampon aqueux) sont chargées dans des barriques séparées d’une seringue double barillet et puis coextrudé grâce à un mélangeur statique dans un moule silicone cylindrique. Rapide in situ gélification sur mélange de formes un hydrazone réticulé hydrogel, qui est autoportante (une fois que le moule est retiré) quelques secondes à minutes selon la densité de concentration et groupe fonctionnel des polymères précurseur. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Pour créer des particules de gel dégradable sur l’échelle de micron, on décrit une méthode de microfluidique réactive dans laquelle précurseur des solutions de polymère sont simultanément mélangées et émulsion à l’aide d’une conception de puce microfluidique Lithographie-basé sur des modèles souples, permettant la formation de gouttelettes de polymères réactifs mixtes gel qui par la suite in situ à microparticules gel forme avec tailles basé sur un modèle de l’émulsion (Figure 2)31,32.
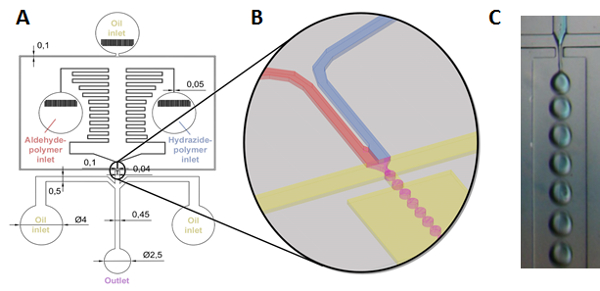
Figure 2 : Schéma de formation de microparticules de gel via microfluidics réactive. (A, B) Hydrazide maléique et solutions de polymères fonctionnalisés aldéhyde (dans l’eau ou un tampon aqueux) sont alimentées par pousse-seringue dans des réservoirs distincts qui sont connectés en aval à travers une série de zig-zag de canaux conçu pour créer un gradient de pression empêchant le refoulement. Les polymères sont ensuite mélangés juste avant d’être cisaillés par huile de paraffine qui coule des deux côtés (également entraînées par une pompe à seringue) et forcées à travers une buse, aboutissant à la production de flux de mise au point de l’humeur aqueuse gouttelettes (solution de polymère) dans une phase d’huile de paraffine continue (voir (B) pour une illustration de la zone de la buse et le processus de formation de gouttelettes). Un deux entrées supplémentaires de huile de paraffine sont placées après la buse à supplémentaire séparé les gouttelettes en suspension dans le canal de collecte permettant de gélification complète avant le retrait de la particule de flux laminaire, après quoi la résultante microparticulaire gelées sont recueilli dans un bécher magnétiquement agité ; Photo (C) du processus de génération de gouttelettes à la buse (Notez que le polymère hydrazide maléique est étiqueté comme bleu pour illustrer le mélange)
Pour créer le gel dégradable des particules à l’échelle nanométrique, un moteur thermique réactive l’auto-assemblage est décrit la méthode dans laquelle une solution de l’un des polymères réactives précurseur (le polymère « graine ») est chauffée au-dessus de la LCST pour former un nanoaggregate stable qui est par la suite réticulé par l’addition du polymère précurseur réactifs complémentaires (polymère « réticulation ») ; le nanogel de RETICULE hydrazone qui en résulte a une taille basé sur un modèle directement par la nanoaggregate (Figure 3)28.
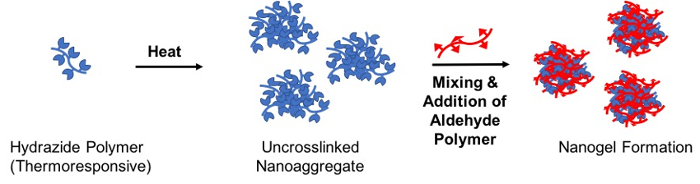
Figure 3 : Schéma de formation nanogel via pilotée par thermiquement réactive auto-assemblage. Une solution aqueuse contenant le polymère d’hydrazide maléique fonctionnalisés (thermoresponsive) est chauffée au-dessus de sa température critique de la solution plus bas pour créer un nanoaggregate non stable. Suite, un polymère fonctionnalisés aldéhyde est ajouté au crosslink la nanoaggregate via la formation d’une liaison hydrazone et ainsi stabiliser la particule nanogel lors du refroidissement au-dessous de la LCST. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Pour créer des nanofibres dégradables, décrit une technique réactive électrofilage dans lequel une seringue double barillet équipée d’un mélangeur statique à sa sortie (comme utilisé pour la fabrication des hydrogels en vrac) est attachée à une plateforme standard électrofilage (Figure 4 )33.
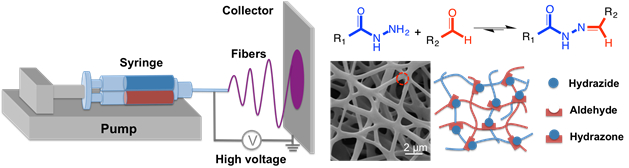
Figure 4 : Schéma de formation de nanofibres hydrogel par électrofilage réactive. Une seringue double barillet avec un mélangeur statique (chargé comme pour le vrac hydrogels, mais incluant aussi une fraction de poids moléculaire élevé poly(ethylene oxide) comme aide électrofilage) est montée sur une pompe à seringue avec l’aiguille à l’extrémité de la seringue connectée pour une alimentation à haute tension. Hydrazone réticulation se produit au cours de la fibre, processus de filature afin que quand le flux frappe le collecteur (feuille d’aluminium ou un disque en aluminium) la morphologie nanofibrous est maintenue. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
L’application de ces méthodes pour la création de réseaux dégradable hydrogel smart est démontrée dans ce protocole utilisant PNIPAM ou POEGMA comme le polymère d’intérêt ; Toutefois, les approches de base décrits peuvent être traduits à un polymère soluble dans l’eau, mais avec des ajustements appropriés pour la viscosité et (dans le cas de l’auto-assemblage nanogel de procédé de fabrication) la stabilité du polymère avant dans la formation de la graine nanoaggregate.
Protocol
Representative Results
Discussion
Nous avons appliqué avec succès toutes ces techniques de fabrication à plusieurs systèmes de polymère avec seulement de légères variations des méthodes décrites en détail plus haut pour le PNIPAM et POEGMA ; Toutefois, les utilisateurs de ces protocoles doivent être conscients des problèmes potentiels qui peuvent survenir lorsque les autres polymères sont substitués dans ces processus. En particulier, augmentation de la viscosité des polymères précurseur peut nuire tant la processabilité (surtout dans la méthode de la microfluidique) ainsi que l’efficacité du mélange des polymères deux précurseurs. En outre, le temps de gélification des polymères doivent être contrôlé à un taux qui dépend de la morphologie ciblée afin d’éviter la gélification prématurée qui sert à débit ou à empêcher l’interdiffusion des polymères réactifs avant, essentielles pour former la direction désirée structures de gel homogène. Les limites précises de chaque stratégie, mais aussi des approches, que nous avons utilisé pour adapter ces approches pour traiter ces restrictions à l’échelle de longueur de chaque fabrication, sont décrits ci-dessous.
En vrac les hydrogels par coextrusion de seringue double barillet
Temps de gélification est la variable clé de contrôle afin de garantir l’efficacité de la technique de seringue double barillet pour former des hydrogels en vrac. Polymères qui gel trop vite au contact ( 5 s sont préférables (bien que non obligatoire) pour l’utilisation de cette technique ; Cela est particulièrement important si hydrogels répétées sont cast pour analyses physiques ou mécaniques pour s’assurer que chaque cast hydrogel a la même composition. Temps de gélification peut être facilement modifié en changeant la densité des groupes fonctionnels réactifs sur l’un ou les deux polymères précurseur (densité plus faible groupe fonctionnel conduisant à la gélification plus lente) ou changeant la concentration des polymères précurseurs utilisés pour former le gel ( abaisser la concentration conduisant à la gélification lente)21. Alternativement, remplaçant le groupe aldéhyde (plus réactif) avec le groupe cétone (moins réactif) comme électrophile dans la paire gélifiant considérablement réduit le temps de gélification sans modifier sensiblement la composition de l’hydrogel qui en résulte35 ; préparé des polymères avec des mélanges d’aldéhyde et précurseurs de monomère de cétone peuvent être utilisés pour régler le temps de gélification comme vous le souhaitez sans modifier la concentration de polymères précurseur utilisé (et donc le pourcentage en masse de matières solides dans le gel qui en résulte formé).
Nous aimerions également souligner que la première conversion hydrogel n’a pas toujours les mêmes propriétés que les hydrogels ultérieures cast, une remarque attribuée à légères différences dans la vitesse à laquelle le contenu des deux barils réellement atteindre le mélangeur statique. Ainsi, nous avons généralement amorcer la seringue double barillet en extrudant une petite (< 0,3 mL) fraction du gel avant d’amorcer le processus de coulée pour minimiser cette variabilité. Enfin, bien que pas généralement problématique lors de l’utilisation des oligomères synthétiques prépolymères, la viscosité d’une ou plusieurs solutions de polymère précurseur peut poser un défi dans le contexte de cette technique, qu’il s’agisse de faciliter les flux à l’aide de dépression simple pouce ainsi que la promotion efficace de mélange dans le mélangeur statique. Cependant, étonnamment, même les solutions de polymères précurseur avec nettement différentes viscosités forment encore hydrogels relativement homogènes en utilisant les embouts mélangeur statique décrites dans la liste des pièces (par exemple, PNIPAM avec une haute moléculaire poids de glucides26), ce qui laisse supposer que les préoccupations au sujet de mixage inefficaces à la suite de viscosités mal appariées peut être négligeable au moins sur la balance en vrac. Si nécessaire, l’utilisation d’une pompe à seringue (au lieu du pouce) au flux de commande et/ou de l’utilisation d’une aiguille de calibre plus gros à la sortie peut aider à surmonter les problèmes associés à extrudabilité dans ces systèmes.
Microscale hydrogels via réactive microfluidique
L’étape clé associée à l’approche de la microfluidique pour fabrication de microparticules de gel est l’amorçage de la puce microfluidique avec les deux polymères réactives. Si les polymères sont livrés avec des pressions différentes ou à des taux différents dans la puce, la pression différentielle peut conduire le refoulement de la solution de polymère un précurseur dans le réservoir (ou du moins vers le réservoir) de l’autre polymère précurseur. Cela se traduit par gélification en amont de la formation de particules, bloquant efficacement les flux et donc nécessitant une élimination de puce. Le chemin tortueux imprimé entre chaque réservoir et le point de mélange crée une résistance importante à reflux ; Cependant, même un opérateur qualifié sera gel occasionnellement une puce avant un régime d’écoulement stable est atteint. Selon notre expérience, entre 1-2 min est habituellement requis pour stabiliser le flux suivant le début de la formation de gouttelettes (quel temps relativement polydispersés gel de microparticules sont produits) ; Si aucun problème n’est observés dans les premières 5-10 minutes d’opération, il est probable que plusieurs heures de production de particules monodispersés continu est possible. L’utilisation de précurseurs polymères avec viscosité relativement bien assortie ainsi que temps de gélification non instantanée (au moins > 15 s préférable) aide grandement à éviter ce genre de problèmes et de promouvoir la formation des flux stables.
Remarque que diverses débits allant de 0,01 à 0,1 mL/h dans la phase aqueuse et 1,1 à 5,5 mL/h dans la phase huileuse ont été testés à l’aide de cette conception de la puce, conduisant à la fabrication des particules sur la gamme de taille de ~ 25-100 µm selon le cisaillement appliqué à la débit de mise au point de jonction ; débits plus rapides synonyme de cisaillement plus élevé et donc plus petites particules formées31,32. Faire varier le débit d’huile tout en gardant le total aqueuse débit faible (cités dans le protocole, ~0.03 mL/h) s’est avéré plus efficace pour contrôler la taille de microparticules de gel sans compromettre la monodispersion ou la durée de vie de l’appareil, qui étaient tous deux observé à réduire de manière significative à l’extrémité supérieure des cité débits aqueux total. Plus grand débit d’huile (> 5,5 mL/h) pour créer des particules plus petites sont possibles, mais a augmenté le risque de décollement de puce (limitation des courante rencontrée avec plasma-collé des puces microfluidiques PDMS). Les puces utilisant une autre méthode de liaison peut permettre des débits plus rapides et donc plus petite production de microparticules de gel, une stratégie que nous explorons actuellement. Réduction de la taille de la buse peut également aider à réduire la taille des microparticules qui pourraient être produites, bien qu’à un risque accru de gélification prématurée avant la formation de particules. Débits plus lentes tend à mener à l’écoulement des instabilités et donc polydispersités plus élevées et un risque accru de gélification de la puce ; Cette limitation pourrait être surmontée en utilisant un système de contrôle de flux multicanal microfluidique qui possède une meilleure stabilité et une résolution plus élevée que les pompes à seringue standard utilisés dans le présent protocole.
Le choix de l’huile a été essentiels à la réussite de ce protocole, comme les huiles plus lourds (favorables en termes de prévention gel MICROPARTICULE agglomération après le prélèvement) a conduit à la formation de particules beaucoup moins cohérente au niveau du bec que l’huile de silicone clair rapporté dans le protocole. Nous croyons que cela réduit la reproductibilité est un résultat plus faible cohérence de seringue pompage des huiles lourdes, conduisant à un cisaillement plus variable au point mélange. Évitant le gel au moyen de microparticules agrégation dans le flacon de collection était aussi un défi, particulièrement immédiatement à la sortie du dispositif microfluidique à quel point in situ gélification n’était pas complet et grand nombre de disponible réactif fonctionnelle des groupes étaient disponibles aux ponts de forme entre les particules en collision dans le bain de la collection. Ce défi a été corrigée par : augmentation de la longueur de la voie de sortie sur la puce microfluidique elle-même, maintenir les microparticules de gel à flux laminaire pour une plus longue période de temps pour favoriser la gélification plus complète ; Ajouter les chenaux secondaires après la buse pour nourrir plus de pétrole dans la puce et donc mieux séparer les microparticules de gel dans ce canal après mélange sans affecter les champs de cisaillement à la buse lui-même, ou le taux de production de particules ; et ajouter un agitateur magnétique le ballon de collection afin d’éviter la sédimentation au moyen de microparticules de gel et maintenir une plus grande séparation moyenne entre particules adjacentes. Bien que très lentes gélifiants polymères probablement améliorerait la stabilité de l’appareil et réduire au minimum les problèmes d’amorçage, ces systèmes ont également été observés à accroître sensiblement le risque d’agrégation de microparticules de gel, comme un plus grand nombre de groupes fonctionnels réactifs reste inaltéré (et donc en mesure de ponts entre particules forme) sur une longue période de temps. À ce titre, temps de gélification sur l’ordre de 15-60 s semblent être optimal pour cette technique : lent, assez pour permettre l’amorçage mais assez rapide assurer le plus réactif des groupes fonctionnels sont consommés avant les microparticules de gel de quitter le canal d’écoulement laminaire dans le flacon de collection.
Enfin, l’enlèvement des hydrocarbures aux modèles est essentiel de veiller à ce que les particules qui en résulte conservent que les propriétés smart attendu basé sur la composition des des prépolymères ajouté et permettre l’utilisation de ces particules dans un contexte biomédical. Le pentane procédure décrite de lavage a été très efficace à cet égard pour la production de microparticules de gel général. Toutefois, l’application de cette technique dans un contexte biomédical direct (p. ex., sur puce cell encapsulation) exigerait réévaluation du présent protocole. Nous avons également exploré l’utilisation de l’huile d’olive, a proposé d’être qu’une huile plus inerte dans le contexte de communiquer avec les cellules36, comme le dispersant. Tandis que la formation de particules n’a pas été possible, les populations de microparticules de gel ont été significativement plus polydispersés que pourrait être réalisé avec de l’huile minérale, au moins avec la conception actuelle de la puce. Ainsi, alors que la puce semble être adaptable à la fois de polymère synthétique et de gel de polymère naturel au moyen de microparticules formation31, un mis à jour le dessin peut être requis pour exploiter cette technique plus largement dans l’ensemble de toutes les combinaisons possibles de matière.
Nanoscale hydrogels via réactive auto-assemblage
Nanogels ont été créés à l’aide d’un très large éventail de conditions, y compris les différentes concentrations de polymère de graine de traitement (0,5 à 2 % en poids), différents rapports de polymère crosslinking:seed (0,05 à 0,2), différentes températures (40-80 ° C), différents (mélange) des vitesses 200-800 tr/min) et le chauffage différent moments après l’addition de la RETICULATION polymère (2-60 min)28. En termes de concentrations, les tendances observées sont généralement comme pourrait être prédit, que des concentrations plus élevées de polymère de semences conduisent à plus grande nanogels et des ratios plus élevés de polymère de crosslinker:seed conduisent à nanogels avec des densités plus élevées de crosslink et ainsi abaisser thermoresponsivities. Il convient de souligner que, augmentant le polymère de semences concentration trop élevée conduit finalement à l’agrégation par opposition à nanoaggregation, conforme à ce qui est observé dans le processus de précipitation classiques des radicaux libres pour la formation de vrac thermoresponsive nanogels3. Temps de chauffage plus courts se retrouvent également d’être favorables pour formant plus petites et plus monodisperses de particules. Nous émettons l’hypothèse que la tenue du nanoaggregate à plus longs à une température au-dessus de la LCST un ou deux de ces polymères précurseur augmente la probabilité d’agrégation sur nanogel collision, avec l’hydrophobie accrue de la liaison de l’hydrazone relatif à soit les précurseur aldéhyde ou hydrazide maléique groupes fonctionnels faisant cette agrégation plus probable, car le degré de réticulation obtenue est augmenté. En fin de compte, des temps de chauffage plus courts sont favorables dans une perspective de processus, car une population de nanogel monodisperses peut se former en aussi peu que 2 min après l’addition de reticulation de polymère ; 10 min s’est avéré le plus longtemps qui pouvait produire constamment monodispersés nanogels tout en permettant à la production de plus hautement réticulé nanogels. Fait intéressant, la méthode est remarquablement insensible au mélange, avec des tailles de particules presque identique et granulométries résultant du mélange à des vitesses différentes, ou encore mise à l’échelle du processus à des volumes plus importants. Bien que surpris par ce résultat, il est probable parle avec le rôle principal de la thermodynamique dans la régulation de la production nanogel.
Pour atteindre les polydispersités faibles, la stabilité colloïdale et le degré d’hydratation de la nanoaggregate semblent être les principales variables. Par exemple, nanoaggrégats préparés en utilisant les polymères fonctionnalisés hydrazide maléique plus hydrophiles comme la graine par opposition aux polymères fonctionnalisés aldéhyde moins hydrophiles entraîner nanogels avec polydispersités significativement plus faibles. La différence entre la température du montage expérimental et la LCST du polymère de semences est également essentielle. Fonctionnant à une température juste au-dessus du polymère de semences LCST ((T-LCST) < 5 ° C) vous propose la plus forte probabilité de formation de nanogel monodisperses ; bien au-dessus de la LCST crée plus nanoaggrégats s’est effondré et hydrophobes qui risquent plus globale et moins susceptibles de crosslink, tout en fonctionnant en dessous des LCST des résultats dans un polymère de semence relativement non compact qui ne peuvent être efficacement ou reproductible réticulé. Pour la meilleure prédiction des particules monodispersion, nous vous recommandons tout d’abord effectuer une analyse de UV/vis pour mesurer l’apparition LCST du polymère de graines et par la suite effectuer les processus d’auto-assemblage à une température de 1 à 2 ° C au-dessus de la LCST.
Notez que nanogels produites à l’aide de cette méthode pourrait être lyophilisés et redispersed sans aucun changement dans la stabilité colloïdale, souvent pas possible pour les structures auto-assemblées et à notre avis attribuable à notre méthode de stabilisation de réticulation. Nous prévoyons également que seulement le polymère de semences doit être thermoresponsive pour que cette méthode de travail ; utilisation de réticulation de polymères qui sont irrecevables ou sensible aux autres stimuli peut-être élargir davantage l’application ultime de cette technique. Enfin, le mélange de deux polymères réactifs précurseurs étant dans ce cas passive par opposition au temps de gélification active, est beaucoup moins important en termes de contrôle de processus par rapport aux autres stratégies de fabrication décrites. Cependant, même dans cette technique, gardant le temps total de réticulation < 30 min est souhaitable afin de minimiser le risque d’agrégation des particules.
Hydrogels Nanofibrous par électrofilage réactive
Contrôler le temps de gélification des polymères réactifs avant redevient essentiel à la réussite de la production de nanofibres de gel. En particulier, correspondant à environ le temps de séjour des polymères précurseur dans le mélangeur statique (contrôlée en changeant la vitesse d’écoulement de la solution de la seringue double barillet ainsi que la longueur et la tortuosité du mélangeur statique) avec la gélification en vrac temps des polymères précurseur est indispensable tant pour préserver le filage ainsi que d’assurer efficacement réticulation des fibres filés entre l’aiguille et le collecteur. Gélification rapide conduit au développement des cônes Taylor inefficace et donc filage pauvre, alors que plus lent gelation résulte dans une solution aqueuse au lieu d’un gel de frapper le collecteur, résultant dans la diffusion et la formation ultime d’un film mince de gel au lieu de nanofibres. Travaillant au temps de séjour un peu moins le temps de gélification en vrac a également été trouvé à être efficace (et en effet préférable de réduire le risque de colmatage de l’aiguille) car l’évaporation de l’eau que la solution tourne effectivement concentre les polymères de précurseur dans la Stream et donc accélère la cinétique de la gélification au cours du processus de filage. Dans cette même veine, opérant à des distances de l’aiguille-à-collector plus élevés (> 10 cm) est généralement favorable à ce processus, car une distance plus courte réduit le temps disponible pour l’évaporation de l’eau et nécessite donc un contrôle plus strict sur la relation entre temps de séjour et temps de gélification afin de préserver un produit de nanofibrous.
Notez que l’utilisation du PEO (ou une autre masse moléculaire élevée et facilement électrofilées polymère) est essentiel dans ce protocole pour promouvoir la formation de nanofibres, comme les oligomères POEGMA courtes et très ramifiées ne peuvent atteindre seul un niveau adéquat d’enchevêtrement d’induire électrofilage ; au lieu de cela, electrospray résultats à tous les processus de conditions testées pour les formulations POEGMA seule (bien que cela peut avoir également des applications pour la fabrication de particules de gel dégradables en utilisant cette même chimie). Une concentration minimale de PEO de 1 % en poids (1 MDa de poids moléculaire) est nécessaire pour maintenir une morphologie totalement nanofibrous. Notez que la PEO peut être retirée des fibres suite à une procédure simple trempage (eau déminéralisée, 24h) sans perturber l’intégrité du réseau nanofibrous ; de cette façon, PEO agit plus comme une aide transitoire électrofilage qu’une composante essentielle du produit final nanofibrous. Notez également que différents types de capteurs, y compris l’aluminium simple (pour créer des hydrogels de couche mince qui peut se décoller du collecteur après trempage) ainsi qu’un disque en aluminium (pour créer des échafaudages plus épais) peuvent être utilisés en conjonction avec ce même technique, fourni les autres variables de processus contrôlant le taux de gélification, le taux d’électrofilage et le taux d’évaporation de l’eau pendant électrofilage restent inchangés.
Fait intéressant, selon la méthode utilisée pour préparer les différentes morphologies, des différences significatives ont été observées dans les temps de dégradation des hydrogels préparés à partir des mêmes précurseurs d’hydrogel. Par exemple, POEGMA nanofibrous hydrogels se dégrade plus lentement que les hydrogels POEGMA en bloc avec la même composition malgré leur superficie nettement plus élevé et donc accès à l’eau d’hydrolyser les liaisons d’hydrazone. Nous relions ces différences pour les contrastes inhérentes entre les protocoles décrits en ce qui concerne la géométrie du mélange les polymères de précurseur, qui peuvent conduire au gel interne homogénéïtés et/ou de morphologies qui sont significativement différentes et/ou de la dans situ concentration de précurseurs de polymère sur la même échelle de temps que la gélification, particulièrement pertinente dans électrofilage due à l’évaporation de l’eau simultanée et réticulation observée dans ce processus. Même si cela peut un peu compliquer le choix des polymères précurseur si un polymère est ciblé pour utilisation dans chaque protocole, il peut aussi offrir une possibilité technique en termes de prise des hydrogels avec une composition chimique, mais des propriétés physiques très différentes.
Dans l’ensemble, les méthodes décrites offrent une stratégie de fabrication dégradables (ou au moins insuffisants libérable) analogues de polymères thermoresponsive sur plusieurs échelles de longueur (en vrac, micro et nano) et avec plusieurs types de structures internes (particules ou fibres). Ces protocoles aborder les principaux obstacles à la traduction réussie des matériaux préparés conventionnellement synthétique thermoresponsive pour le domaine biomédical : injectabilité et dégradabilité. Nous continuons à étudier l’application de ces matières dans l’administration de médicaments et de tissus techniques des applications allant de la physique ciblant des cancers, le transport de drogues à travers la barrière hémato – encéphalique, la prestation thérapeutique des protéines à l’arrière de le œil, la croissance directionnelle des tissus et l’adhérence THERMORÉVERSIBLE et différenciation des cellules, parmi d’autres applications.
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Financement par les Sciences naturelles et ingénierie recherche Conseil du Canada (CRSNG), le CRSNG CREATE-IDEM (conception intégrée de Matrices extracellulaires) programme, 20/20 : réseau de recherche biomatériaux ophtalmique du CRSNG et le ministère de la recherche de l’Ontario et Programme de bourses de nouveaux chercheurs d’innovation est reconnu.
Materials
| Chemicals | |||
| 2,2 – azobisisobutryic acid dimethyl ester | Wako Chemicals | 101138 | |
| Di(ethylene glycol) methyl ether methacrylate (M(EO)2MA) | Sigma Aldrich | 447927 | 188.2 g/mol, n=2 ethylene oxide repeat units |
| Oligo (ethylene glycol) methyl ether methacrylate (OEGMA475) | Sigma Aldrich | 447943 | 475 g/mol, n=8-9 ethylene oxide repeat units |
| Acrylic acid (AA), 99% | Sigma Aldrich | 147230 | |
| Thioglycolic acid (TGA), 98% | Sigma Aldrich | T3758 | |
| Dioxane, 99% | Caledon Labs | 360481 | |
| Nitrogen, UHP grade | Air Liquide | Alphagaz1 765A-44 | |
| Adipic acid dihydrazide (ADH), 98% | Alfa Aesar | A15119 | |
| N'-ethyl-N-(3- dimethylaminopropyl)-carbodiimide (EDC, x%) | Carbosynth | FD05800 | |
| Hydrochloric acid (HCl), 37% | Sigma Aldrich | 320331 | |
| Sodium hydroxide (NaOH), 97% | Sigma Aldrich | 221465 | |
| Aminoacetyl aldehyde dimethyl acetal, 99% | Sigma Aldrich | 121967 | |
| 4-Hydroxy-TEMPO, 97% | Sigma Aldrich | 176141 | |
| Methacryloyl chloride,97x% | Sigma Aldrich | 523216 | |
| Petroleum ether, 95% | Sigma Aldrich | 32047 | |
| Magnesium sulfate, 99.5% | Sigma Aldrich | M7506 | |
| tert-Butyl methyl ether, >99.0% | Sigma Aldrich | 443808 | |
| Phosphate buffered saline | BioShop | PBS405.1 | 1x, pH 7.3-7.5 |
| N-isopropylacrylamide, 99% | J&K Scientific | 258717 | Recrystallized from 60% hexanes/40% toluene |
| Ethanol, anhydrous | Commerical Alchols | P016EAAN | |
| Span 80 | Sigma Aldrich | S6760 | |
| Heavy paraffin oil | Caledon Labs | 1326197 | |
| Pentane, reagent grade | Caledon Labs | 1/10/7800 | |
| Poly (ethylene oxide) average Mv 600,000 | Sigma Aldrich | 182028 | |
| Supplies essential for synthesis and hydrogel fabrication | |||
| Rotary evaporator | Heidolph | G3 | |
| Dialysis tubing (3500 Da molecular weight cut-off) | Spectrum Labs | 28170-166 | Vol/length= 6.4mL/cm |
| Double barrel syringe | Medmix | L series | L series, 2.5 mL, 1:1 volume ratio |
| Static mixer | Medmix | L series | L series, 2.5 mL, 1:1 volume ratio, 1.5" length |
| Silicone rubber sheet, 1/16" thickness | McMaster-Carr | 9010K12, 30A Durometer (Super Soft) | |
| Syringe pump | KD Scientific | KDS Legato 200 | Infuse Only Dual Syringe Pump |
| High voltage power supply | Spellman | 230-20R | 0 to 20 kV |
| Microfluidic Chip Fabrication | |||
| Silicon wafer | University Wafer | 2080 | D = 76.2 mm; 380 µm thickness; P-doped; <100> orientation |
| SU-8 100 | MicroChem | Y131273 | |
| SU-8 Developer | MicroChem | Y020100 | |
| Custom 2.5" spincoater | Built in-house | N/A | |
| Mask Aligner | KARL SUSS | MJB3 UV400 (with a 276 W lamp) | |
| Masterflex L/S 13 Silicone Tubing | Cole Parmer | OF-96400-13 | Peroxide-cured |
| Dow Corning Sygard 184 Silicone Elastomer Base | Ellsworth Adhesives | 4019862 | |
| Dow Corning Sygard 184 Silicone Elastomer Curing Agent | Ellsworth Adhesives | 4019862 | |
| High Power Plasma Cleaner | Harrick | PDC-002-HP | |
| Characterization Instruments | |||
| Mach 1 micromechanical tester | Biomomentum | LB007-EN | |
| Cellstar tissue culture 12 well plate | Greiner Bio-one | 665 180 | |
| Cell culture insert for 12 well plate | Corning | 08-771-12 | 8 µm pore size |
| Optical microscope | Olympus BX51 optical microscope | BX51 | |
| Temperature-controlled microscope stage | Linkam Scientific | THMS600 | |
| Gel permeation chromatograph (GPC) | Waters | 590 HPLC Pump | Waters Styragel columns (HR2, HR3, HR4; 30 cm x 7.8 mm (ID); 5 mm particles), Waters 410 refractive index detector |
| Dynamic light scattering (DLS) | Brookhaven | 90Plus Particle Size Analyzer | |
| Transmission electron microscopy (TEM) | TEMSCAN | JEOL 1200EX | Accelerating voltage 100 kV |
| Scanning electron microscopy (SEM) | Tescan | Vega II LSU | Accelerating voltage 10 kV |
| Microsquisher | CellScale Biomaterials Testing | MS-50M-01 |
Riferimenti
- Heskins, M., Guillet, J. E. Solution Properties of Poly(N-isopropylacrylamide). J. Macromol. Sci. A. 2 (8), 1441-1455 (1968).
- Lutz, J. -. F., Akdemir, &. #. 2. 1. 4. ;., Hoth, A. Point by Point Comparison of Two Thermosensitive Polymers Exhibiting a Similar LCST: Is the Age of Poly(NIPAM) Over. J. Am. Chem. Soc. 128 (40), 13046-13047 (2006).
- Pelton, R. H., Chibante, P. Preparation of Aqueous Lattices with N-Isopropylacrylamide. Colloids Surf. 20 (3), 247-256 (1986).
- Palasis, M., Gehrke, S. H. Permeability of Responsive Poly(N-Isopropylacrylamide) Gel to Solutes. J. Controlled Release. 18 (1), 1-11 (1992).
- Kawaguchi, H., Fujimoto, K., Mizuhara, Y. Hydrogel Microspheres .3. Temperature-Dependent Adsorption of Proteins on Poly-N-Isopropylacrylamide Hydrogel Microspheres. Colloid Polym. Sci. 270 (1), 53-57 (1992).
- Okuyama, Y., Yoshida, R., Sakai, K., Okano, T., Sakurai, Y. Swelling Controlled Zero-Order and Sigmoidal Drug-Release from Thermoresponsive Poly(N-Isopropylacrylamide-Co-Butyl Methacrylate) Hydrogel. J. Biomater. Sci. Polym. Ed. 4 (5), 545-556 (1993).
- Snowden, M. J. The Use of Poly(N-Isopropylacrylamide) Lattices as Novel Release Systems. J. Chem. Soc. – Chem. Comm. (11), 803-804 (1992).
- Haraguchi, K., Takehisa, T., Ebato, M. Control of cell cultivation and cell sheet detachment on the surface of polymer/clay nanocomposite hydrogels. Biomacromolecules. 7 (11), 3267-3275 (2006).
- Lee, B., et al. Initiated chemical vapor deposition of thermoresponsive poly(N-vinylcaprolactam) thin films for cell sheet engineering. Acta Biomater. 9 (8), 7691-7698 (2013).
- Cole, M. A., Voelcker, N. H., Thissen, H., Griesser, H. J. Stimuli-responsive interfaces and systems for the control of protein-surface and cell-surface interactions. Biomaterials. 30 (9), 1827-1850 (2009).
- Feil, H., Bae, Y. H., Feijen, J., Kim, S. W. Molecular Separation by Thermosensitive Hydrogel Membranes. J. Membrane Sci. 64 (3), 283-294 (1991).
- Kim, J., Park, K. Smart hydrogels for bioseparation. Bioseparation. 7 (4-5), 177-184 (1998).
- Yamashita, K., Nishimura, T., Nango, M. Preparation of IPN-type stimuli responsive heavy-metal-ion adsorbent gel. Polym. Adv. Tech. 14 (3-5), 189-194 (2003).
- Ziolkowski, B., Czugala, M., Diamond, D. Integrating stimulus responsive materials and microfluidics: The key to next-generation chemical sensors. J. Intelligent Mater. Syst. Struct. 24 (18), 2221-2238 (2013).
- Zhang, Y., Kato, S., Anazawa, T. A flap-type hydrogel actuator with fast responses to temperature. Smart Mater. Struct. 16 (6), 2175-2182 (2007).
- Suzuki, D., Taniguchi, H., Yoshida, R. Autonomously Oscillating Viscosity in Microgel Dispersions. J. Am. Chem. Soc. 131 (34), 12058-12059 (2009).
- Schild, H. G. Poly(N-isopropylacrylamide): Experiment, Theory and Application. Prog. Polym. Sci. 17, 163-249 (1992).
- Oh, J. K., Min, K., Matyjaszewski, K. Preparation of poly (oligo (ethylene glycol) monomethyl ether methacrylate) by homogeneous aqueous AGET ATRP. Macromolecules. 39 (9), 3161-3167 (2006).
- Vihola, H., Laukkanen, A., Tenhu, H., Hirvonen, J. Drug Release Characteristics of Physically Cross-Linked Thermosensitive Poly(N-vinylcaprolactam) Hydrogel Particles. J. Pharm. Sci. 97 (11), 4783-4793 (2008).
- Zhang, L. F., Liang, Y., Meng, L. Z. Thermo-sensitive amphiphilic poly(N-vinylcaprolactam) copolymers: synthesis and solution properties. Polym. Adv. Tech. 21 (10), 720-725 (2010).
- Smeets, N. M. B., Bakaic, E., Patenaude, M., Hoare, T. Injectable and tunable poly(ethylene glycol) analogue hydrogels based on poly(oligoethylene glycol methacrylate). Chem. Comm. 50 (25), 3306-3309 (2014).
- Lutz, J. -. F. Polymerization of oligo (ethylene glycol)(meth) acrylates: toward new generations of smart biocompatible materials. J. Polym. Sci. A. 46 (11), 3459-3470 (2008).
- Lutz, J. -. F., Hoth, A. Preparation of Ideal PEG Analogues with a Tunable Thermosensitivity by Controlled Radical Copolymerization of 2-(2-Methoxyethoxy)ethyl Methacrylate and Oligo(ethylene glycol) Methacrylate. Macromolecules. 39 (2), 893-896 (2006).
- Patenaude, M., Campbell, S., Kinio, D., Hoare, T. Tuning Gelation Time and Morphology of Injectable Hydrogels Using Ketone-Hydrazide Cross-Linking. Biomacromolecules. 15 (3), 781-790 (2014).
- Patenaude, M., Hoare, T. Injectable, Degradable Thermoresponsive Poly(N-isopropylacrylamide) Hydrogels. ACS Macro Lett. 1 (3), 409-413 (2012).
- Patenaude, M., Hoare, T. Injectable, Mixed Natural-Synthetic Polymer Hydrogels with Modular Properties. Biomacromolecules. 13 (2), 369-378 (2012).
- Smeets, N. M. B., Bakaic, E., Patenaude, M., Hoare, T. Injectable poly(oligoethylene glycol methacrylate)-based hydrogels with tunable phase transition behaviours: Physicochemical and biological responses. Acta Biomater. 10 (10), 4143-4155 (2014).
- Sivakumaran, D., Mueller, E., Hoare, T. Temperature-Induced Assembly of Monodisperse, Covalently Cross-Linked, and Degradable Poly(N-isopropylacrylamide) Microgels Based on Oligomeric Precursors. Langmuir. 31, 5767-5778 (2015).
- Bakaic, E., Smeets, N. M. B., Dorrington, H., Hoare, T. “Off-the-shelf” thermoresponsive hydrogel design: tuning hydrogel properties by mixing precursor polymers with different lower-critical solution temperatures. RSC Adv. 5 (42), 33364-33376 (2015).
- Bulpitt, P., Aeschlimann, D. New strategy for chemical modification of hyaluronic acid: Preparation of functionalized derivatives and their use in the formation of novel biocompatible hydrogels. J. Biomed. Mater. Res. 47 (2), 152-169 (1999).
- Kesselman, L. R. B., Shinwary, S., Selvaganapathy, P. R., Hoare, T. Synthesis of Monodisperse, Covalently Cross-Linked, Degradable “Smart” Microgels Using Microfluidics. Small. 8 (7), 1092-1098 (2012).
- Sivakumaran, D., Mueller, E., Hoare, T. Microfluidic production of degradable thermoresponsive microgels based on poly(N-isopropylacrylamide). Soft Matter. , (2016).
- Xu, F., Sheardown, H., Hoare, T. Reactive Electrospinning of Degradable Poly(oligoethylene glycol methacrylate)-Based Nanofibrous Hydrogel Networks. Chem. Comm. 52 (7), 1451-1454 (2016).
- Troll, K., et al. The collapse transition of poly(styrene-b-(N-isopropyl acrylamide)) diblock copolymers in aqueous solution and in thin films. Colloid Polym. Sci. 286 (8), 1079-1092 (2008).
- Patenaude, M., Campbell, S., Kinio, D., Hoare, T. Tuning Gelation Time and Morphology of Injectable Hydrogels Using Ketone-Hydrazide Cross-Linking. Biomacromolecules. 15 (3), 781-790 (2014).
- Kelly, T. A., Felder, M. S., Ollar, R. A. Inducing Apoptosis in a Mammalian Cell by Contacting with Paraffin or Agar. US Patent. , (2001).

