Fabbricando degradabile Hydrogel idrogeli su scale di lunghezza Multiple tramite estrusione reattiva, microfluidica, auto-assemblaggio ed elettrofilatura
Summary
Protocolli sono descritti per la realizzazione di idrogeli degradabile Hydrogel basati su idrazone cross-linking di oligomeri polimerici sulla scala di massa, microscala e su scala nanometrica, quest’ultimo per preparazione di nanoparticelle di gel e di nanofibre.
Abstract
Mentre vari materiali intelligenti sono stati esplorati per una varietà di applicazioni biomediche (ad es., somministrazione di farmaci, ingegneria tissutale, bioimmagini, ecc.), loro ultimo uso clinico è stata ostacolata dalla mancanza di biologicamente rilevanti degradazione osservata per materiali più intelligenti. Ciò è particolarmente vero per gli idrogel termosensibile, che sono quasi uniformemente basati su polimeri che sono funzionalmente non degradabili (ad es., PNIPPA (PNIPAM) o poli (metacrilato di glicole oligoethylene) (POEGMA) ). Come tale, per tradurre efficacemente il potenziale di idrogel Hydrogel per le sfide di consegna della droga telecomandati o metabolismo-regolato, ponteggi di cella con sintonizzabile interazioni cellula-materiale, teranostici materiali con il potenziale per l’imaging e consegna della droga e altre applicazioni, un metodo è richiesto per il rendering nel caso degli idrogeli (se non completamente degradabili) almeno in grado di clearance renale dopo la necessaria durata del materiale. A tal fine, questo protocollo descrive la preparazione di idrogeli idroliticamente degradabile idrazone-reticolato su scale di lunghezza più basate sulla reazione tra idrazide maleica e aldeide-funzionalizzate oligomeri PNIPAM o POEGMA con molecolare pesi inferiori al limite di filtrazione renale. In particolare, metodi per fabbricare degradabile Hydrogel idrogeli di massa (usando una tecnica di siringa doppia canna), particelle di idrogel (su microscala entrambi attraverso l’uso di una piattaforma di microfluidica facilitare la miscelazione simultanea e emulsificazione dei polimeri precursore e nanoscala attraverso l’uso di un termicamente determinato auto-assemblaggio e metodo di cross-linking), e nanofibre di idrogel (usando una strategia reattiva elettrofilatura) sono descritti. In ogni caso, gli idrogel con termosensibile proprietà simili a quelli ottenuti tramite processi di reticolazione del radicale libero convenzionale possono essere raggiunto, ma la rete di cross-linked idrazone può essere degradata nel tempo a ri-formare l’oligomerici polimeri di precursore e la clearance di enable. Come tale, possiamo anticipare questi metodi (che può essere genericamente applicato a ogni sintetico polimero solubile in acqua, non solo intelligenti materiali) sarà più facile traduzione di materiali sintetici intelligenti per applicazioni cliniche.
Introduction
Materiali intelligenti hanno attirato l’attenzione significativa a causa del loro potenziale per reversibile “on-demand” risposte ai segnali esterni e/o ambientali. Materiale termosensibile hanno attirato particolare interesse dovuto il loro comportamento di temperatura (LCST) soluzione critica inferiore, con conseguente precipitazione temperatura-driven a temperature T > LCST1,2. Nel contesto di idrogel Hydrogel, questo comportamento di temperatura critica soluzione inferiore si manifesta con reversibili gonfiore/de-swelling eventi che provocano dimensioni temperatura-tunable bulk (più grande a T < LCST)3, poro dimensioni (superiori a T < LCST)4e proprietà interfacciali (più idrofilo al T < LCST)5. Tali transizioni sono stati ampiamente applicati nella somministrazione di farmaci (per droga esterna o ambientale-triggerable rilascio4,6,7), coltura delle cellule e di ingegneria tissutale (per adesione cellulare termoreversibile / delaminazione8,9,10), separazioni (per porosità membrana commutabile e permeabilità o supporti diagnostici termicamente riciclabile11,12, 13), processi di microfluidica (per valvole on-off regolazione flusso14,15) e modificatori reologici (per temperatura-tunable viscosità16). Il più comunemente studiato Hydrogel idrogeli sono basati su PNIPPA (PNIPAM)17, anche se lavoro significativo (e crescente) è stato condotto anche su poli (metacrilato di glicole oligoethylene) (POEGMA)2 ,18 e poly(vinylcaprolactam) (PVCL)19,20. POEGMA ha suscitato particolare interesse recente dato sua biocompatibilità miglioramento atteso21,22e relativo comportamento LCST facile-a-tune, in cui le miscele linearmente prevedibile di monomeri con diversi numeri di unità di ossido di etilene ripetere in loro catene laterali possono alterare il LCST da ~ 20 ° C a > 90 ° C2,23. Tuttavia, ciascuno di questi polimeri è preparato mediante polimerizzazione radicalica e contiene pertanto una dorsale di carbonio-carbonio, limitando notevolmente la potenziale utilità e traducibilità di tali polimeri nel contesto delle applicazioni biomediche in cui degradazione (o almeno la capacità per l’autorizzazione mediante filtrazione renale) è in genere un requisito.
In risposta a questa limitazione, recentemente abbiamo riferito ampiamente sull’applicazione della chimica idrazone (cioè., la reazione tra idrazide maleica e aldeide-funzionalizzate pre-polimeri) per preparare analoghi degradabili di Hydrogel idrogeli24,25,26,27,28,29. La reazione rapida e reversibile tra gruppi idrazide maleica e aldeide con la miscelazione di polimeri funzionalizzati precursore30 consente entrambi gelificazione in situ (Abilitazione facile iniezione di questi materiali senza l’esigenza chirurgica l’impianto o qualsiasi tipo di stimolo esterno polimerizzazione come iniziazione di irradiazione o chimico UV) così come degradazione idrolitica della rete ad un tasso controllato dalla chimica e la densità dei siti di reticolazione. Inoltre, mantenendo il peso molecolare dei pre-polimeri usato per preparare l’idrogel sotto il limite di filtrazione renale, idrogeli effettuati utilizzando questo approccio degradano nuovamente dentro i polimeri precursori oligomerici che possono essere eliminati dal corpo25 ,27,28. Accoppiato con la bassa citotossicità e la risposta di basso tessuto infiammatorio indotto da questi materiali25,26,27, questo approccio offre un metodo potenzialmente traducibile per l’uso di Hydrogel idrogeli intelligenti in medicina, in particolare se ben controllati degradabile analoghi di tali idrogeli su tutte le scale di lunghezza (massa, micro e nano) possono essere fabbricati.
In questo protocollo, descriviamo i metodi per rendere Hydrogel sintetica pre-polimeri funzionalizzati con un numero controllato di idrazide maleica e aldeide gruppi nonché metodi per applicare questi polimeri per creare gli idrogel con dimensioni ben definite su varie scale di lunghezza. In particolare, questo manoscritto descrive quattro approcci distinti abbiamo sviluppato per controllare la miscelazione del reattivo idrazide maleica e aldeide-funzionalizzate pre-polimeri e creando reti di idrogel Hydrogel con geometrie ben definite e morfologie:
Per creare massa degradabile idrogel con dimensioni definite, una strategia di templating è descritto mediante il quale i pre-polimeri reattivi vengono caricati in barili separati di una siringa doppia canna dotata al suo sbocco di un miscelatore statico e successivamente co-estruso in un stampo in silicone con l’idrogel desiderata forma e dimensioni21,27 (Figura 1).
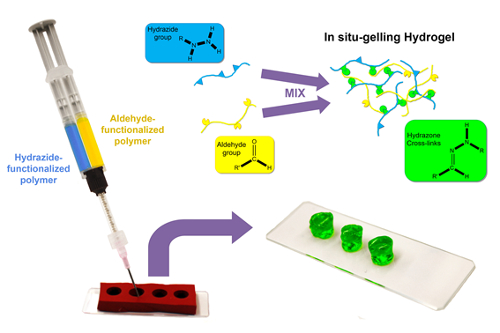
Figura 1 : Schematico di formazione di massa idrogel. Idrazide maleica e soluzioni di polimeri funzionalizzati aldeide (in acqua o tampone acquoso) vengono caricati in barili separati di una siringa a doppia canna e quindi co-estrusa attraverso un miscelatore statico in uno stampo in silicone cilindrico. Rapida in situ gelificazione miscelazione forme un idrogel di reticolato idrazone, che è free standing (una volta rimossa la muffa) in pochi secondi a minuti a seconda della concentrazione e gruppo funzionale della densità dei polimeri precursore. Clicca qui per visualizzare una versione più grande di questa figura.
Per creare particelle di gel degradabile scala del micron, un metodo di microfluidica reattiva è descritto in quale precursore soluzioni polimeriche sono simultaneamente misto ed emulsionato utilizzando una progettazione di chip microfluidici basati su modelli Litografia morbida, consentendo la Formazione di goccioline di polimero reattivo misto di gel che successivamente in situ di microparticelle di gel di forma con dimensioni basato su modelli dall’emulsione (Figura 2)31,32.
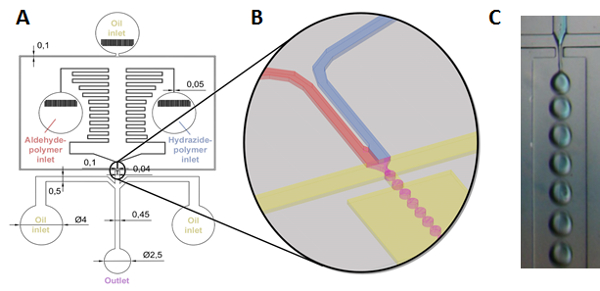
Figura 2 : Schematico della formazione di microparticelle di gel via reattiva microfluidica. (A, B) Idrazide maleica e soluzioni di polimeri funzionalizzati aldeide (in acqua o tampone acquoso) sono alimentati da pompa a siringa in serbatoi separati che sono collegati a valle attraverso una serie di zig-zag di canali progettato per creare un gradiente di pressione impedendo il riflusso. I polimeri sono poi mescolati poco prima di essere tosato di olio di paraffina che scorre da entrambi i lati (anche guidati da una pompa a siringa) e forzati attraverso un ugello, con conseguente produzione di flusso-messa a fuoco di acquoso goccioline (soluzione di polimero) in una fase di olio di paraffina continuo (vedere (B) per un’illustrazione della zona dell’ugello e del processo di formazione delle gocce). Un ulteriore due insenature di olio di paraffina sono posizionati dopo l’ugello per separare ulteriormente le goccioline nel canale di raccolta per consentire completa gelificazione prima della rimozione di particelle da flusso laminare, dopo di che il risultante microparticellari gel sono raccolti in un becher magneticamente agitato; (C) foto del processo di generazione della gocciolina all’ugello (notare quel polimero idrazide maleica viene etichettato come blu per illustrare la miscelazione)
Per creare particelle di gel degradabile su scala nanometrica, termicamente determinato reattivo autoassemblaggio metodo è descritto in cui una soluzione di uno dei polimeri reattivi precursore (il polimero “seme”) è riscaldata sopra il LCST per formare un nanoaggregati stabile che è successivamente reticolato mediante l’aggiunta del polimero precursore reattivi complementari (polimero “reticolazione”); la risultante idrazone reticolato nanogel ha una dimensione basata su modelli direttamente di nanoaggregati (Figura 3)28.
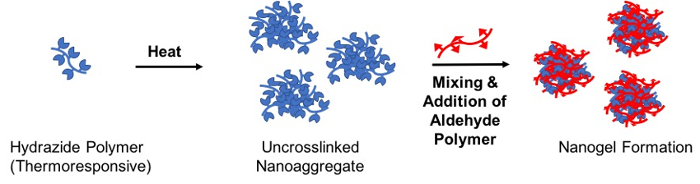
Figura 3 : Schematico di formazione nanogel via termicamente determinato reattivo autoassemblaggio. Una soluzione acquosa contenente il polimero (hydrogel) idrazide maleica-funzionalizzate è scaldata sopra sua bassa temperatura critica soluzione per creare un reticolato stabile nanoaggregati. In seguito, un polimero dell’aldeide-funzionalizzate viene aggiunto al crosslink nanoaggregati tramite formazione di legami idrazone e quindi stabilizzare la particella nanogel sul raffreddamento sotto il LCST. Clicca qui per visualizzare una versione più grande di questa figura.
Per creare le nanofibre degradabile, una tecnica di elettrofilatura reattiva è descritta in cui una siringa doppia canna con un miscelatore statico al suo sbocco (come quello usato per la fabbricazione di idrogeli di massa) è collegata a una piattaforma standard elettrofilatura (Figura 4 )33.
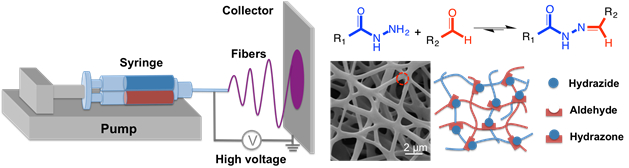
Figura 4 : Schematico di idrogel nanofibra formazione via reattiva elettrofilatura. Una siringa doppia canna con un miscelatore statico (caricato come descritto per idrogeli di massa ma anche tra una frazione di poly(ethylene oxide) ad alto peso molecolare come sussidio di elettrofilatura) è montata su una pompa a siringa, con l’ago all’estremità della siringa collegata di un alimentatore ad alta tensione. Idrazone reticolazione si verifica durante il processo di filatura in modo che quando il flusso colpisce il collettore (o foglio di alluminio o un disco rotante di alluminio) la morfologia nanofibrous è mantenuta in fibra. Clicca qui per visualizzare una versione più grande di questa figura.
L’applicazione di tali metodi per la creazione di reti degradabile idrogel intelligente è dimostrato in questo protocollo utilizzando PNIPAM o POEGMA come il polimero di interesse; Tuttavia, gli approcci di base descritti possono essere tradotta in qualunque polimero solubile in acqua, anche se con opportune regolazioni per viscosità e (nel caso del metodo di fabbricazione autoassemblaggio nanogel) la stabilità del pre-polimero nel formare il seme nanoaggregati.
Protocol
Representative Results
Discussion
Abbiamo applicato con successo tutte queste tecniche di fabbricazione di sistemi multipli di polimero con solo lievi variazioni dei metodi descritti in dettaglio sopra per PNIPAM e POEGMA; Tuttavia, gli utenti di questi protocolli devono essere consapevoli dei potenziali problemi che possono sorgere quando vengono sostituiti con altri polimeri in questi processi. In particolare, aumentando la viscosità dei polimeri precursore può influire negativamente sulle sia la lavorabilità (soprattutto nel metodo microfluidica), nonché l’efficienza di miscelazione dei polimeri due precursore. Inoltre, il tempo di gelificazione dei polimeri deve essere controllato ad un tasso dipendono la morfologia mirata al fine di evitare la prematura gelificazione che serve a inibire il flusso o prevenire interdiffusione dei pre-polimeri reattivi, essenziali per formare la desiderata strutture di gel omogeneo. Le limitazioni specifiche di ogni strategia, nonché approcci che abbiamo usato per adattare questi approcci per affrontare tali limitazioni in ogni scala di lunghezza di fabbricazione, sono descritti di seguito.
Idrogeli tramite coestrusione di siringa doppia canna di massa
Tempo di gelificazione è la variabile chiave di controllo per garantire l’efficacia della tecnica siringa doppia canna per la formazione di idrogeli di massa. Polimeri che gel troppo veloce al contatto ( 5 s sono preferibili (anche se non obbligatorio) per l’utilizzo di questa tecnica; Ciò è particolarmente importante se replicati idrogeli sono essere lanciati per analisi fisiche o meccanica garantire che ogni lancio di idrogel ha la stessa composizione. Tempo di gelificazione può essere facilmente alterato modificando la densità di gruppi funzionali reattivi su uno o sia polimeri precursore (bassa densità di gruppo funzionale che porta a gelificazione più lento) o cambiando la concentrazione dei polimeri precursore utilizzato per formare il gel ( abbassare le concentrazioni che conduce a gelificazione più lento)21. In alternativa, sostituendo il gruppo aldeidico (più reattivo) con il gruppo chetonico (meno reattivo) come l’elettrofilo nella coppia gelificante significativamente riduce il tempo di gelificazione senza modificare significativamente la composizione dell’idrogel risultante35 ; polimeri preparati con miscele di aldeide e precursori monomerici chetone possono essere utilizzati per ottimizzare il tempo di gelificazione come desiderato senza modificare la concentrazione di polimeri precursore utilizzato (e quindi la percentuale in massa di solidi nel gel risultante formata).
Notiamo anche che il primo cast di idrogel non ha sempre le stesse proprietà idrogeli successivi lanci, un’osservazione attribuita a lievi differenze nel tasso a cui il contenuto di due bariletti effettivamente raggiunge il miscelatore statico. Di conseguenza, abbiamo in genere adescare la siringa doppia canna estrudendo un piccolo (< 0,3 mL) frazione di gel prima di iniziare il processo di fusione per ridurre al minimo tale variabilità. Infine, mentre non è in genere problematico quando si utilizza oligomerici pre-polimeri sintetici, la viscosità di una o più soluzioni di polimero precursore può rappresentare una sfida nel contesto di questa tecnica, sia in termini di agevolazione del flusso mediante depressione semplice pollice oltre a promuovere efficace miscelazione all'interno del miscelatore statico. Tuttavia, piuttosto sorprendentemente, anche soluzioni di polimero precursore con viscosità nettamente diverse formano ancora relativamente omogenei idrogeli utilizzando gli allegati di miscelatore statico descritti nell'elenco delle parti (ad es., PNIPAM con un alto molecolare peso del carboidrato26), suggerendo che le preoccupazioni circa la miscelazione inefficiente a seguito di mis-matched viscosità potrebbe non essere significativo almeno sulla scala di massa. Se necessario, l’uso di una pompa a siringa (anziché il pollice) al flusso di auto e/o l’uso di un ago di calibro più grande presso l’outlet può aiutare a superare problemi associati estrudibilità in questi sistemi.
Idrogeli di Microscala via reattiva microfluidica
Il passo chiave connesso con l’approccio di microfluidica per fabbricazione di microparticelle di gel è l’innesco del chip microfluidici con due polimeri reattivi. Se i polimeri vengono consegnati con pressioni differenti o a velocità diverse nel chip, la pressione differenziale può guidare il riflusso di soluzione polimerica un precursore nel serbatoio (o almeno verso il serbatoio) di altro polimero precursore. Ciò provoca gelificazione a Monte da formazione di particelle, bloccando il flusso e quindi smaltire chip. Il percorso tortuoso improntato tra ciascun serbatoio e il punto di miscelazione crea una resistenza significativa a riflusso; Tuttavia, anche un operatore addestrato occasionalmente gel un chip prima che sia raggiunto un regime di flusso stabile. Basandoci sulla nostra esperienza, tra 1-2 min è in genere necessaria per stabilizzare i flussi che seguono l’inizio della formazione della gocciolina (nel quale tempo relativamente polidispersi gel microparticelle sono prodotti); Se si osservano entro i primi 5-10 minuti di funzionamento senza problemi, è probabile che molte ore di produzione delle particelle monodisperse continuo possono essere raggiunto. L’uso di polimeri di precursore con viscosità relativamente ben abbinati, nonché tempi di gelificazione non istantanea (almeno > 15 s preferibile) notevolmente aiuta a evitare tali problemi e promuovendo la formazione di flussi stabili.
Nota che varie portate che vanno da 0,01-0,1 mL/h nella fase acquosa e 1.1-5.5 mL/h in fase di olio sono stati testati utilizzando la progettazione di chip, che conduce alla fabbricazione delle particelle dell’intervallo di dimensioni di ~ 25-100 µm secondo la cesoia applicata presso il giunzione di flusso-messa a fuoco; velocità di flusso equivale a taglio più alto e così le particelle più piccole formano31,32. Variando la velocità di flusso di olio, mantenendo basso il tasso di flusso acquoso totale (mL/h ~0.03, come citato nel protocollo) è stato trovato per essere più efficiente per controllare la dimensione di microparticelle di gel senza compromettere la durata del dispositivo o monodispersity, entrambi i quali sono stati osservato per fare diminuire significativamente all’estremità superiore dei tassi citati totale flusso acquoso. Grandi portate di olio (> 5,5 mL/h) per creare particelle più piccole sono possibili, ma ha aumentato il rischio di delaminazione chip (una limitazione comune incontrata con plasma-legato chip microfluidici PDMS). I chip utilizzando un altro metodo di legame può consentire velocità di flusso e così più piccola produzione di microparticelle di gel, una strategia che attualmente stiamo esplorando. Diminuire le dimensioni dell’ugello può anche contribuire a ridurre le dimensioni delle microparticelle che potevano essere prodotto, seppur ad un elevato rischio di gelificazione prematura prima della formazione della particella. Più lenta velocità di flusso teso a portare a flusso instabilità e così polidispersità superiore e un rischio aumentato di gelificazione chip; Questa limitazione potrebbe essere superata utilizzando un sistema di controllo di flusso multicanale microfluidici che ha più alta stabilità e una risoluzione superiore rispetto alle pompe siringa standard utilizzata nel presente protocollo.
La scelta dell’olio è stato fondamentale per il successo di questo protocollo, come gli oli più pesanti (favorevoli in termini di prevenzione agglomerazione di microparticelle di gel dopo la raccolta) ha portato alla formazione di particelle molto meno coerente all’ugello che l’olio di silicone luce segnalato il protocollo. Supponiamo che questo ridotto riproducibilità è un risultato di bassa consistenza della siringa di pompaggio di oli pesanti, portando a più variabili di taglio al punto di miscelazione. Evitando l’aggregazione di microparticelle di gel nella beuta di raccolta è stata anche una sfida, specialmente immediatamente all’uscita dal dispositivo microfluidico al punto che in situ gelificazione non era completo e gran numero di disponibile reattivo funzionale i gruppi erano disponibili a formare ponti fra le particelle scontrantesi nella vasca di raccolta. Questa sfida è affrontata da: aumento della lunghezza del canale di uscita su chip microfluidici stesso, mantenendo le microparticelle di gel a flusso laminare per un lungo periodo di tempo per promuovere più completa gelificazione; aggiungendo i canali laterali dopo l’ugello alimentano più petrolio il chip e così meglio separare le microparticelle di gel in questo canale post-miscelazione senza influenzare i campi di taglio presso l’ugello stesso o il tasso di produzione delle particelle; e l’aggiunta di un mescolatore magnetico per la beuta di raccolta per evitare gel microparticella sedimentazione e mantenere una maggiore separazione media fra particelle adiacenti. Mentre molto lenti polimeri gelificanti sarebbero probabilmente migliorare la stabilità del dispositivo e ridurre al minimo i problemi con adescamento, tali sistemi sono stati osservati anche per aumentare significativamente il rischio di aggregazione di microparticelle di gel, come un numero maggiore di gruppi funzionali reattivi rimane non reagito (e quindi in grado di formare ponti inter-particella) su un periodo più lungo di tempo. Come tale, tempi di gelificazione nell’ordine di 15-60 s sembrano essere ottimale per questa tecnica: lento sufficiente per permettere di adescamento, ma abbastanza veloce per garantire più reattivi gruppi funzionali sono consumati prima le microparticelle di gel di uscita il canale di flusso laminare nella pallone di raccolta.
Infine, la rimozione dell’olio ai modelli è essenziale per garantire che le particelle risultanti mantengano che le proprietà smart previsto sulla base della composizione dei pre-polimeri aggiunto e consentire l’utilizzo di queste particelle in un contesto biomedico. Il pentano lavatrice procedura descritta era altamente efficace a questo proposito per la produzione di microparticelle di gel generale. Tuttavia, l’applicazione di questa tecnica in un contesto biomedico diretto (ad es., incapsulamento di cellule su chip) richiederebbe rivalutazione del presente protocollo. Abbiamo anche esplorato l’uso di olio di oliva, suggerita per essere che un olio più inerte nel contesto di contatto con le cellule36, come il disperdente. Mentre la formazione di particelle era possibile, le popolazioni di microparticelle di gel erano significativamente più polidispersi quello che potrebbe essere raggiunto con olio minerale, almeno con l’attuale design di chip. Quindi, mentre il chip sembra essere adattabile a polimero sintetico e da polimeri naturali gel microparticella formazione31, un design modificato può essere richiesto per sfruttare questa tecnica più largamente attraverso tutte le possibili combinazioni di materiali.
Su scala nanometrica idrogeli via reattiva auto-assemblaggio
Nanogel sono state formate utilizzando una gamma molto ampia di condizioni, tra cui diverse concentrazioni di polimero semi di lavorazione (0,5-2% in peso), differenti rapporti di crosslinking:seed polimero (0.05-0.2), diverse temperature (40-80 ° C), diverse miscelazione velocità ( 200-800 giri/min) e riscaldamento diversa volte dopo l’aggiunta del reticolante polimero (2-60 min)28. In termini di concentrazioni, le tendenze osservate sono generalmente come sarebbe preveduto, come le più alte concentrazioni di polimero semi portano a nanogel più grandi e più alti rapporti di polimero crosslinker:seed portano a nanogel con elevate densità di reticolazione e così più basso thermoresponsivities. Va sottolineato che aumentando il polimero semi concentrazione troppo alta infine conduce all’aggregazione al contrario di nanoaggregation, coerente con ciò che si osserva nel processo di precipitazione convenzionale del radicale libero per la formazione di massa Hydrogel nanogel3. Più brevi tempi di riscaldamento inoltre sono stati trovati per essere favorevole per formare più piccolo e più particelle monodisperse. Supponiamo che tenendo il nanoaggregati a volte più a lungo ad una temperatura sopra il LCST uno o entrambi i polimeri precursore aumenta la probabilità di aggregazione su nanogel collisione, con la maggiore idrofobicità del legame idrazone relativi a sia i precursore aldeide o idrazide maleica gruppi funzionali rendendo questa aggregazione più probabile come è aumentato il grado di reticolazione raggiunto. In definitiva, più brevi tempi di riscaldamento sono favorevoli da un punto di vista del processo, come una popolazione di nanogel monodispersi può essere formata in meno di 2 min dopo l’aggiunta di polimero reticolante; 10 min è stato trovato per essere il più lungo tempo che potrebbe produrre costantemente monodispersi nanogel consentendo anche per la produzione di più altamente reticolato nanogel. È interessante notare che, il metodo è notevolmente insensibile alla miscelazione, con dimensioni quasi identiche delle particelle e distribuzioni di dimensione delle particelle derivanti dalla miscelazione a velocità diverse o persino riducendo il processo ai volumi più grandi. Mentre inizialmente sorpresi da questo risultato, è probabile che parla per il ruolo principale della termodinamica nella regolazione della produzione di nanogel.
Per raggiungere polidispersità basso, la stabilità colloidale e il grado di idratazione della nanoaggregati sembrano essere le variabili chiave. Ad esempio, nanoaggregati preparati utilizzando i polimeri funzionalizzati idrazide maleica più idrofilici come il seme in contrasto con i polimeri funzionalizzati aldeide meno idrofilici portano a nanogel con polidispersità significativamente più basso. La differenza tra la temperatura del complessivo sperimentale e il LCST del polimero semi è anche critica. Operando ad una temperatura appena sopra il polimero semi LCST ((T-LCST) < 5 ° C) offre la più alta probabilità di formazione di nanogel monodisperse; di funzionamento ben di sopra il LCST crea più nanoaggregati idrofobo e compresso che è più probabile a aggregazione e meno probabilità di crosslink, pur operando sotto i risultati di LCST in un polimero di seme relativamente non-compatto che non può essere efficacemente o riproducibile reticolato. Per la migliore previsione della particella monodispersity, consigliamo innanzitutto eseguire una scansione di UV/vis per misurare l'insorgenza LCST del polimero semi e successivamente eseguire l'auto-assemblaggio processo ad una temperatura di 1-2 ° C sopra quella LCST.
Si noti che nanogel prodotta utilizzando questo metodo potrebbe essere liofilizzato e ridisperse senza alcun cambiamento nella stabilità colloidale, spesso non è possibile per strutture auto-assemblate e a nostro avviso attribuibile al nostro metodo di stabilizzazione di reticolazione. Prevediamo inoltre che solo il polimero di seme deve essere Hydrogel per questo metodo di lavoro; utilizzo di cross-linking polimeri che sono non-responsivi o reattivo ad altri stimoli può ampliare ulteriormente l’applicabilità finale di questa tecnica. Infine, poiché la miscelazione dei due polimeri reattivi precursore è in questo caso passivo al contrario attivo, tempo di gelificazione è molto meno importante in termini di controllo di processo rispetto alle altre strategie di fabbricazione descritto. Tuttavia, anche in questa tecnica, mantenendo il tempo di reticolazione totale < 30 min è auspicabile per ridurre al minimo il rischio di aggregazione delle particelle.
Nanofibrous idrogel tramite elettrofilatura reattiva
Controllare il tempo di gelificazione dei pre-polimeri reattivi nuovamente è essenziale per il successo della produzione di nanofibra di gel. In particolare, circa il tempo di permanenza dei polimeri precursore nel miscelatore statico (controllata cambiando la portata della soluzione da siringa doppia canna nonché la lunghezza e la tortuosità del miscelatore statico) di corrispondenza con la gelificazione di massa tempo dei polimeri precursore è essenziale sia per preservare la rotatività, nonché assicurare efficace reticolazione delle fibre del filato tra l’ago e il collettore. Gelificazione più veloce porta allo sviluppo del cono di Taylor inefficace e così povero rotatività, mentre più lento gelificazione risultati in una soluzione acquosa invece di un gel che colpisce il collettore, con conseguente diffusione e la formazione finale di un film sottile di gel invece di nanofibre. Lavorare in tempi di permanenza leggermente di sotto del tempo di gelificazione di massa è stato trovato per essere efficace (e infatti preferibile per ridurre il rischio di intasamento dell’ago) poiché l’evaporazione dell’acqua come la soluzione è filata efficacemente si concentra i polimeri di precursore nella streaming e così accelera la cinetica di gelificazione durante il processo di filatura. In questa stessa ottica, operanti a distanze superiori di ago-a-collector (> 10 cm) è generalmente favorevole in questo processo, come distanze più brevi riducono il tempo disponibile per l’evaporazione dell’acqua e quindi richiedono più rigorose di controllo sopra il rapporto tra tempo di permanenza e tempo di gelificazione al fine di preservare un prodotto di nanofibrous.
Si noti che l’uso di PEO (o un altro elettrofilate polimero ad alto peso molecolare e facilmente) è essenziale in questo protocollo per promuovere la formazione di nanofibra, come oligomeri POEGMA brevi e altamente ramificati da solo non riesce a raggiungere un adeguato grado di entanglement per indurre elettrofilatura; invece, electrospray risultati affatto testate per formulazioni di sola POEGMA (anche se questo può anche avere applicazioni per rendere le particelle di gel degradabile utilizzando questa chimica stessa) dalle condizioni di processo. Per mantenere una morfologia completamente nanofibrous è necessaria una concentrazione minima di PEO del 1% in peso (peso molecolare di 1 MDa). Si noti che il PEO può essere rimosso dalle fibre seguendo una semplice procedura di immersione (acqua deionizzata, 24 h) senza interrompere l’integrità della rete nanofibrous; in questo modo, PEO agisce più come un aiuto di elettrofilatura transitoria che un componente essenziale del prodotto finale nanofibrous. Notare inoltre che vari tipi di collezionisti, tra cui foglio di alluminio semplice (per creare gli idrogel sottile strato che possono delaminare dal collettore all’ammollo) come pure un disco rotante in alluminio (per creare più spessore impalcature) possono essere utilizzati in combinazione con questo stesso tecnica, fornito le altre variabili di processo controllo il tasso di gelificazione, il tasso di elettrofilatura e il tasso di evaporazione dell’acqua durante elettrofilatura rimangono inalterate.
È interessante notare che, a seconda del metodo utilizzato per preparare le diverse morfologie, sono state osservate differenze significative nei tempi degradazione degli idrogeli preparati con lo stessa precursori di idrogel. Ad esempio, POEGMA nanofibrous idrogeli degradano più lentamente di idrogeli POEGMA di massa con la stessa composizione nonostante la loro superficie significativamente più alto e così l’accesso all’acqua per idrolizzare i legami idrazone. Ci relazioniamo queste differenze per i contrasti inerente tra i protocolli descritti in termini di geometria di miscelazione i polimeri di precursore, che possono portare a impurita ‘ interna in gel e/o morfologie che sono significativamente differenti e/o la in situ concentrazione di precursori di polimero sulla stessa scala di tempo come gelificazione, particolarmente rilevante in elettrofilatura a causa dell’evaporazione dell’acqua simultanea e osservato in questo processo di reticolazione. Mentre questo può complicare un po’ la scelta dei polimeri precursore se un polimero è mirato per l’uso in ogni protocollo, può anche offrire un’opportunità tecnica in termini di fabbricazione idrogel con una composizione chimica ma molto differenti proprietà fisiche.
Nel complesso, i metodi descritti forniscono una strategia per fabbricare degradabile (o almeno per via renale azzerabili) analoghi di polimeri Hydrogel su più scale di lunghezza (massa, micro e nano) e con diversi tipi di strutture interne (particelle o fibre). Tali protocolli di affrontare i principali ostacoli alla traduzione successo dei materiali preparati convenzionalmente Hydrogel sintetico al campo biomedico: iniettabilità e degradabilità. Stiamo continuando a esplorare l’applicazione di tali materiali in sia di farmaci e applicazioni che vanno dalla fisica come destinazione di cancri, di ingegneria tissutale il trasporto di farmaci attraverso la barriera ematomeningea, la consegna terapeutica delle proteine a parte posteriore dell’occhio, la crescita direzionale dei tessuti e l’adesione termoreversibile e differenziazione delle cellule, tra le altre applicazioni.
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Finanziamento da scienze naturali e ingegneria ricerca Consiglio del Canada (NSERC), la creazione di NSERC-IDEM (Design integrato di matrici extracellulari) programma, 20/20: NSERC oftalmico biomateriali Research Network e il Ministero di Ontario di ricerca e Programma di primo ricercatore premi innovazione è riconosciuto.
Materials
| Chemicals | |||
| 2,2 – azobisisobutryic acid dimethyl ester | Wako Chemicals | 101138 | |
| Di(ethylene glycol) methyl ether methacrylate (M(EO)2MA) | Sigma Aldrich | 447927 | 188.2 g/mol, n=2 ethylene oxide repeat units |
| Oligo (ethylene glycol) methyl ether methacrylate (OEGMA475) | Sigma Aldrich | 447943 | 475 g/mol, n=8-9 ethylene oxide repeat units |
| Acrylic acid (AA), 99% | Sigma Aldrich | 147230 | |
| Thioglycolic acid (TGA), 98% | Sigma Aldrich | T3758 | |
| Dioxane, 99% | Caledon Labs | 360481 | |
| Nitrogen, UHP grade | Air Liquide | Alphagaz1 765A-44 | |
| Adipic acid dihydrazide (ADH), 98% | Alfa Aesar | A15119 | |
| N'-ethyl-N-(3- dimethylaminopropyl)-carbodiimide (EDC, x%) | Carbosynth | FD05800 | |
| Hydrochloric acid (HCl), 37% | Sigma Aldrich | 320331 | |
| Sodium hydroxide (NaOH), 97% | Sigma Aldrich | 221465 | |
| Aminoacetyl aldehyde dimethyl acetal, 99% | Sigma Aldrich | 121967 | |
| 4-Hydroxy-TEMPO, 97% | Sigma Aldrich | 176141 | |
| Methacryloyl chloride,97x% | Sigma Aldrich | 523216 | |
| Petroleum ether, 95% | Sigma Aldrich | 32047 | |
| Magnesium sulfate, 99.5% | Sigma Aldrich | M7506 | |
| tert-Butyl methyl ether, >99.0% | Sigma Aldrich | 443808 | |
| Phosphate buffered saline | BioShop | PBS405.1 | 1x, pH 7.3-7.5 |
| N-isopropylacrylamide, 99% | J&K Scientific | 258717 | Recrystallized from 60% hexanes/40% toluene |
| Ethanol, anhydrous | Commerical Alchols | P016EAAN | |
| Span 80 | Sigma Aldrich | S6760 | |
| Heavy paraffin oil | Caledon Labs | 1326197 | |
| Pentane, reagent grade | Caledon Labs | 1/10/7800 | |
| Poly (ethylene oxide) average Mv 600,000 | Sigma Aldrich | 182028 | |
| Supplies essential for synthesis and hydrogel fabrication | |||
| Rotary evaporator | Heidolph | G3 | |
| Dialysis tubing (3500 Da molecular weight cut-off) | Spectrum Labs | 28170-166 | Vol/length= 6.4mL/cm |
| Double barrel syringe | Medmix | L series | L series, 2.5 mL, 1:1 volume ratio |
| Static mixer | Medmix | L series | L series, 2.5 mL, 1:1 volume ratio, 1.5" length |
| Silicone rubber sheet, 1/16" thickness | McMaster-Carr | 9010K12, 30A Durometer (Super Soft) | |
| Syringe pump | KD Scientific | KDS Legato 200 | Infuse Only Dual Syringe Pump |
| High voltage power supply | Spellman | 230-20R | 0 to 20 kV |
| Microfluidic Chip Fabrication | |||
| Silicon wafer | University Wafer | 2080 | D = 76.2 mm; 380 µm thickness; P-doped; <100> orientation |
| SU-8 100 | MicroChem | Y131273 | |
| SU-8 Developer | MicroChem | Y020100 | |
| Custom 2.5" spincoater | Built in-house | N/A | |
| Mask Aligner | KARL SUSS | MJB3 UV400 (with a 276 W lamp) | |
| Masterflex L/S 13 Silicone Tubing | Cole Parmer | OF-96400-13 | Peroxide-cured |
| Dow Corning Sygard 184 Silicone Elastomer Base | Ellsworth Adhesives | 4019862 | |
| Dow Corning Sygard 184 Silicone Elastomer Curing Agent | Ellsworth Adhesives | 4019862 | |
| High Power Plasma Cleaner | Harrick | PDC-002-HP | |
| Characterization Instruments | |||
| Mach 1 micromechanical tester | Biomomentum | LB007-EN | |
| Cellstar tissue culture 12 well plate | Greiner Bio-one | 665 180 | |
| Cell culture insert for 12 well plate | Corning | 08-771-12 | 8 µm pore size |
| Optical microscope | Olympus BX51 optical microscope | BX51 | |
| Temperature-controlled microscope stage | Linkam Scientific | THMS600 | |
| Gel permeation chromatograph (GPC) | Waters | 590 HPLC Pump | Waters Styragel columns (HR2, HR3, HR4; 30 cm x 7.8 mm (ID); 5 mm particles), Waters 410 refractive index detector |
| Dynamic light scattering (DLS) | Brookhaven | 90Plus Particle Size Analyzer | |
| Transmission electron microscopy (TEM) | TEMSCAN | JEOL 1200EX | Accelerating voltage 100 kV |
| Scanning electron microscopy (SEM) | Tescan | Vega II LSU | Accelerating voltage 10 kV |
| Microsquisher | CellScale Biomaterials Testing | MS-50M-01 |
Riferimenti
- Heskins, M., Guillet, J. E. Solution Properties of Poly(N-isopropylacrylamide). J. Macromol. Sci. A. 2 (8), 1441-1455 (1968).
- Lutz, J. -. F., Akdemir, &. #. 2. 1. 4. ;., Hoth, A. Point by Point Comparison of Two Thermosensitive Polymers Exhibiting a Similar LCST: Is the Age of Poly(NIPAM) Over. J. Am. Chem. Soc. 128 (40), 13046-13047 (2006).
- Pelton, R. H., Chibante, P. Preparation of Aqueous Lattices with N-Isopropylacrylamide. Colloids Surf. 20 (3), 247-256 (1986).
- Palasis, M., Gehrke, S. H. Permeability of Responsive Poly(N-Isopropylacrylamide) Gel to Solutes. J. Controlled Release. 18 (1), 1-11 (1992).
- Kawaguchi, H., Fujimoto, K., Mizuhara, Y. Hydrogel Microspheres .3. Temperature-Dependent Adsorption of Proteins on Poly-N-Isopropylacrylamide Hydrogel Microspheres. Colloid Polym. Sci. 270 (1), 53-57 (1992).
- Okuyama, Y., Yoshida, R., Sakai, K., Okano, T., Sakurai, Y. Swelling Controlled Zero-Order and Sigmoidal Drug-Release from Thermoresponsive Poly(N-Isopropylacrylamide-Co-Butyl Methacrylate) Hydrogel. J. Biomater. Sci. Polym. Ed. 4 (5), 545-556 (1993).
- Snowden, M. J. The Use of Poly(N-Isopropylacrylamide) Lattices as Novel Release Systems. J. Chem. Soc. – Chem. Comm. (11), 803-804 (1992).
- Haraguchi, K., Takehisa, T., Ebato, M. Control of cell cultivation and cell sheet detachment on the surface of polymer/clay nanocomposite hydrogels. Biomacromolecules. 7 (11), 3267-3275 (2006).
- Lee, B., et al. Initiated chemical vapor deposition of thermoresponsive poly(N-vinylcaprolactam) thin films for cell sheet engineering. Acta Biomater. 9 (8), 7691-7698 (2013).
- Cole, M. A., Voelcker, N. H., Thissen, H., Griesser, H. J. Stimuli-responsive interfaces and systems for the control of protein-surface and cell-surface interactions. Biomaterials. 30 (9), 1827-1850 (2009).
- Feil, H., Bae, Y. H., Feijen, J., Kim, S. W. Molecular Separation by Thermosensitive Hydrogel Membranes. J. Membrane Sci. 64 (3), 283-294 (1991).
- Kim, J., Park, K. Smart hydrogels for bioseparation. Bioseparation. 7 (4-5), 177-184 (1998).
- Yamashita, K., Nishimura, T., Nango, M. Preparation of IPN-type stimuli responsive heavy-metal-ion adsorbent gel. Polym. Adv. Tech. 14 (3-5), 189-194 (2003).
- Ziolkowski, B., Czugala, M., Diamond, D. Integrating stimulus responsive materials and microfluidics: The key to next-generation chemical sensors. J. Intelligent Mater. Syst. Struct. 24 (18), 2221-2238 (2013).
- Zhang, Y., Kato, S., Anazawa, T. A flap-type hydrogel actuator with fast responses to temperature. Smart Mater. Struct. 16 (6), 2175-2182 (2007).
- Suzuki, D., Taniguchi, H., Yoshida, R. Autonomously Oscillating Viscosity in Microgel Dispersions. J. Am. Chem. Soc. 131 (34), 12058-12059 (2009).
- Schild, H. G. Poly(N-isopropylacrylamide): Experiment, Theory and Application. Prog. Polym. Sci. 17, 163-249 (1992).
- Oh, J. K., Min, K., Matyjaszewski, K. Preparation of poly (oligo (ethylene glycol) monomethyl ether methacrylate) by homogeneous aqueous AGET ATRP. Macromolecules. 39 (9), 3161-3167 (2006).
- Vihola, H., Laukkanen, A., Tenhu, H., Hirvonen, J. Drug Release Characteristics of Physically Cross-Linked Thermosensitive Poly(N-vinylcaprolactam) Hydrogel Particles. J. Pharm. Sci. 97 (11), 4783-4793 (2008).
- Zhang, L. F., Liang, Y., Meng, L. Z. Thermo-sensitive amphiphilic poly(N-vinylcaprolactam) copolymers: synthesis and solution properties. Polym. Adv. Tech. 21 (10), 720-725 (2010).
- Smeets, N. M. B., Bakaic, E., Patenaude, M., Hoare, T. Injectable and tunable poly(ethylene glycol) analogue hydrogels based on poly(oligoethylene glycol methacrylate). Chem. Comm. 50 (25), 3306-3309 (2014).
- Lutz, J. -. F. Polymerization of oligo (ethylene glycol)(meth) acrylates: toward new generations of smart biocompatible materials. J. Polym. Sci. A. 46 (11), 3459-3470 (2008).
- Lutz, J. -. F., Hoth, A. Preparation of Ideal PEG Analogues with a Tunable Thermosensitivity by Controlled Radical Copolymerization of 2-(2-Methoxyethoxy)ethyl Methacrylate and Oligo(ethylene glycol) Methacrylate. Macromolecules. 39 (2), 893-896 (2006).
- Patenaude, M., Campbell, S., Kinio, D., Hoare, T. Tuning Gelation Time and Morphology of Injectable Hydrogels Using Ketone-Hydrazide Cross-Linking. Biomacromolecules. 15 (3), 781-790 (2014).
- Patenaude, M., Hoare, T. Injectable, Degradable Thermoresponsive Poly(N-isopropylacrylamide) Hydrogels. ACS Macro Lett. 1 (3), 409-413 (2012).
- Patenaude, M., Hoare, T. Injectable, Mixed Natural-Synthetic Polymer Hydrogels with Modular Properties. Biomacromolecules. 13 (2), 369-378 (2012).
- Smeets, N. M. B., Bakaic, E., Patenaude, M., Hoare, T. Injectable poly(oligoethylene glycol methacrylate)-based hydrogels with tunable phase transition behaviours: Physicochemical and biological responses. Acta Biomater. 10 (10), 4143-4155 (2014).
- Sivakumaran, D., Mueller, E., Hoare, T. Temperature-Induced Assembly of Monodisperse, Covalently Cross-Linked, and Degradable Poly(N-isopropylacrylamide) Microgels Based on Oligomeric Precursors. Langmuir. 31, 5767-5778 (2015).
- Bakaic, E., Smeets, N. M. B., Dorrington, H., Hoare, T. “Off-the-shelf” thermoresponsive hydrogel design: tuning hydrogel properties by mixing precursor polymers with different lower-critical solution temperatures. RSC Adv. 5 (42), 33364-33376 (2015).
- Bulpitt, P., Aeschlimann, D. New strategy for chemical modification of hyaluronic acid: Preparation of functionalized derivatives and their use in the formation of novel biocompatible hydrogels. J. Biomed. Mater. Res. 47 (2), 152-169 (1999).
- Kesselman, L. R. B., Shinwary, S., Selvaganapathy, P. R., Hoare, T. Synthesis of Monodisperse, Covalently Cross-Linked, Degradable “Smart” Microgels Using Microfluidics. Small. 8 (7), 1092-1098 (2012).
- Sivakumaran, D., Mueller, E., Hoare, T. Microfluidic production of degradable thermoresponsive microgels based on poly(N-isopropylacrylamide). Soft Matter. , (2016).
- Xu, F., Sheardown, H., Hoare, T. Reactive Electrospinning of Degradable Poly(oligoethylene glycol methacrylate)-Based Nanofibrous Hydrogel Networks. Chem. Comm. 52 (7), 1451-1454 (2016).
- Troll, K., et al. The collapse transition of poly(styrene-b-(N-isopropyl acrylamide)) diblock copolymers in aqueous solution and in thin films. Colloid Polym. Sci. 286 (8), 1079-1092 (2008).
- Patenaude, M., Campbell, S., Kinio, D., Hoare, T. Tuning Gelation Time and Morphology of Injectable Hydrogels Using Ketone-Hydrazide Cross-Linking. Biomacromolecules. 15 (3), 781-790 (2014).
- Kelly, T. A., Felder, M. S., Ollar, R. A. Inducing Apoptosis in a Mammalian Cell by Contacting with Paraffin or Agar. US Patent. , (2001).

