Quantificare i microrganismi alle concentrazioni basse usando microscopia digitale oleografica (DHM)
Summary
Microscopia digitale oleografica (DHM) è una tecnica volumetrica che permette immagini campioni che 50-100 X più spessa di microscopia in campo chiaro a risoluzione paragonabile, con messa a fuoco eseguita post-elaborazione. Qui DHM viene utilizzato per l’identificazione, conteggio e microrganismi di rilevamento molto bassa densità e confrontato con misurazioni di densità ottica, germi e diretto.
Abstract
Con precisione rilevando e contando sparsi campioni batterici ha molte applicazioni nel cibo, bevanda e le industrie di trasformazione farmaceutica, nella diagnostica medica e per il rilevamento di vita tramite missioni robotiche di altri pianeti e lune del sistema solare. Attualmente, radi campioni batterici sono contati da microscopia di placcatura o epifluorescenza di cultura. Piastre di coltura richiedono lunghi tempi di incubazione (giorni o settimane), ed epifluorescenza richiede vasta macchiatura e concentrazione del campione. Qui, noi dimostrare come utilizzare fuori asse microscopia digitale oleografica (DHM) per enumerare i batteri nelle colture molto diluite (100-104 cellule/mL). In primo luogo, la costruzione del DHM personalizzato è discussa, insieme a istruzioni dettagliate sulla creazione di uno strumento di basso costo. I principi dell’olografia sono discussi, e viene utilizzato un modello statistico per stimare quanto tempo video dovrebbe essere quello di individuare le cellule, basate sulle caratteristiche prestazioni ottiche dello strumento e la concentrazione della soluzione batterica (tabella 2) . Video di rilevamento delle cellule alle 105, 104, 103e 100 cellule/mL è dimostrato in tempo reale utilizzando gli ologrammi non ricostruiti. Ricostruzione di immagini di ampiezza e fase è dimostrata utilizzando un pacchetto di software open-source.
Introduction
Determinazione delle conte batteriche accurate in campioni molto diluite è cruciale in molte applicazioni: alcuni esempi sono acqua e cibo qualità analisi1,2,3; rilevamento di agenti patogeni nel sangue, liquido cerebrospinale o espettorato4,5; produzione di prodotti farmaceutici, tra cui acqua sterile6; e l’analisi di comunità ambientale in ambienti oligotrofici come le aperto oceano e sedimenti7,8,9. C’è anche un crescente interesse nell’individuazione di possibile esistente vita microbica sulle lune ghiacciate di Giove e Saturno, particolarmente Europa10,11 ed Encelado12,13, 14, che sono noti per avere oceani liquidi sotto la superficie. Perché nessuna missione dal Viking nel 1978 ha tentato di trovare la vita ancora esistente su un altro pianeta, c’è stato limitato sviluppo di tecnologie e strumenti per identificazione batterica ed il conteggio durante spazio missioni15.
I metodi tradizionali di germi trovano solo le celle coltivabili, che possono rappresentare una minoranza di specie in ceppi ambientali, a volte < 1%16. Piatti richiedono giorni o settimane di incubazione per il massimo successo, dipendendo il ceppo. Epifluorescenza in gran parte ha sostituito conta su piastra come il gold standard per l’enumerazione microbica rapida e accurata. Contrassegno dell’acido nucleico–coloranti fluorescenti quali 4 ′, 6-diamidino-2-phenylindole dicloridrato (DAPI), SYBR Green o arancio di acridina che si legano agli acidi nucleici sono il tipico coloranti utilizzati17,18,19 , anche se molti studi utilizzano indicatori fluorescenti di grammo Iscriviti20,21,22,23,24. Utilizzando questi metodi senza passaggi di pre-concentrazione conduce ai limiti di rilevabilità (LOD) di ~ 105 cellule per mL. Miglioramenti in LoD sono possibili mediante filtrazione. Un campione liquido è vuoto-filtrata su una membrana, solitamente in policarbonato e idealmente nero per ridurre di fondo. Basso-sfondo coloranti come le macchie di DNA cui sopra possono essere applicate direttamente al filtro25. Per conteggio preciso dall’occhio, cellule5 ~ 10 sono necessari per ciascun filtro, che significa che per i campioni più diluiti rispetto alle cellule di5 ~ 10 millilitri, volumi di campione significativo devono essere raccolto e filtrati. Dispositivi di scansione laser sono stati sviluppati al fine di esplorare sistematicamente tutte le regioni del filtro e quindi ridurre il numero di cellule necessarie per il conteggio, spingendo i limiti di rilevazione fino a ~ 102 cellule per mL26. Tuttavia, questi non sono disponibili nella maggior parte dei laboratori e richiedono hardware sofisticato così come software che consentono esperta conferma che osservate particelle è batteri e non residui.
Per riferimento, adulti con sepsi solitamente cominciano a mostrare sintomi alle < 100 cellule/mL di sangue e neonati a < 10 cellule/mL. Un prelievo di sangue da un adulto prende 10 mL e da un infante, 1 mL. Metodi basati sulla PCR sono inibiti dalla presenza della flora umana e non patogeni del DNA e di componenti d’inibizione PCR nel sangue27,28. Nonostante una varietà di tecniche emergenti, culture rimangano il gold standard per la diagnosi di infezioni del torrente sanguigno, soprattutto nelle zone più rurali o nazioni in via di sviluppo. Per la rilevazione della vita su altri pianeti, calcoli termodinamici possono stimare il bilancio di energia per la vita e, quindi, la biomassa possibile prevista. 1 – 100 cellule/mL devono essere termodinamicamente ragionevole su Europa29. Può essere facilmente visto da questi numeri che la rilevazione di molto piccolo numero di cellule in grandi quantità di soluzione acquosa è un importante problema irrisolto.
In questa carta, dimostriamo rilevamento dei marcescens del Serratia e Shewanella oneidensis (wild-type e non motili mutante) alle concentrazioni di 105, 104, 103e 100 cellule/mL utilizzando un fuori-asse microscopio digitale olografica (DHM). Il vantaggio chiave di DHM su microscopia tradizionale è la formazione immagine simultanea di un volume di campione di spessore ad alta risoluzione — in questa implementazione, la camera del campione era 0,8 mm di spessore. Queste camere di campioni sono state costruite dal soft-Litografia di polidimetilsilossano (PDMS) da uno stampo di alluminio lavorati di precisione con una tolleranza di ± 50 µm. Questo rappresenta un miglioramento di circa 100 volte in profondità di campo nel corso di microscopia ad alta potenza. DHM fornisce anche informazioni di fase quantitativa, consentendo per le misure di lunghezza del cammino ottico (prodotto di indice di rifrazione e spessore). DHM e tecniche simili sono stati utilizzati per il monitoraggio batterico e ciclo delle cellule di lievito e calcolo di batterica in massa secca30,31,32; differenze di dispersione possono anche essere usate per differenziare ceppi batterici33.
Lo strumento che usiamo è costruito su misura specificamente per l’utilizzo con microrganismi, come precedentemente pubblicati34,35, e la costruzione e sono dimostrati e discussi. Soluzioni acquose sono continuamente fornite a un 0,25 µ l volume pozzetto di misurazione tramite pompa a siringa; la portata è determinata dalla frequenza di fotogrammi fotocamera al fine di garantire la formazione immagine del volume intero campione. Un calcolo statistico predice il numero di volumi di campione che deve essere imaged al fine di rilevare un numero significativo di cellule ad una determinata concentrazione.
Per applicazioni di rilevamento delle cellule, ricostruzione di ologrammi in ampiezza e fase di immagini non è stato richiesto; analisi è stata eseguita sull’ologramma crudo. Ciò consente di risparmiare spazio su disco e risorse computazionali significative: un ologramma di 500 Mb video sarà 1-2 Tb quando ricostruito. Tuttavia, discutiamo la ricostruzione attraverso la profondità del campione per confermare che gli ologrammi rappresentano la specie desiderata. Una caratteristica importante del DHM è la sua capacità di monitorare l’intensità e la fase delle immagini. Organismi che sono quasi trasparenti in intensità (come la maggior parte delle cellule biologica) appaiono chiaramente in fase. Come è una tecnica privo di etichetta, coloranti non vengono utilizzati. Si tratta di un undvantage per applicazioni di volo spaziale possibile, dato che coloranti potrebbero non sopravvivere le condizioni di una missione e — soprattutto — non può essere assunto a lavorare con organismi extraterrestri, che non possono utilizzare DNA o RNA per la codifica. È anche un vantaggio per il lavoro in ambienti estremi come l’Artico e Antartico, dove coloranti possono essere difficili da portare nella posizione remota e possono peggiorare durante la conservazione. Ricostruzione di immagini in fase e in ampiezza viene eseguita utilizzando un pacchetto di software open-source che abbiamo reso disponibile su GitHub (SHAMPOO) o ImageJ.
Protocol
Representative Results
Discussion
Ricostruzione digitale di ologrammi: per la ricostruzione numerica degli ologrammi, viene utilizzato il metodo di spettro angolare (ASM). Ciò comporta la convoluzione dell’ologramma con funzione di Green per DHM. Il fronte d’onda complesso dell’immagine a un particolare piano focale può essere calcolato utilizzando il teorema di convoluzione di Fourier come segue:
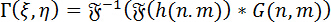 (1)
(1)
Dove <img alt="…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Gli autori riconoscono la Gordon e Betty Moore Foundation sovvenzioni 4037 e 4038 al California Institute of Technology per il finanziamento di questo lavoro.
Materials
| Bacto Yeast | BD Biosciences | 212750 | |
| Bacto Tryptone | BD Biosciences | 211705 | |
| Sodium chloride | Sigma-Aldrich | 7710 | Many options for purchase |
| Bacto Agar | BD Biosciences | 214010 | |
| 10 cm Petri dishes | VWR | 10053-704 | |
| 15 mL culture tubes | Falcon (Corning Life Sciences) | 352002 | Loose-capped |
| Petroff-Hauser chamber | Electron Microscopy Sciences | 3920 | |
| 10 mL syringes | BD Biosciences | 309604 | Luer-Lok tip not necessary |
| Male Luer to 1/16” barbed fitting | McMaster-Carr | 51525K291 | |
| Autoclavable 1/16” ID PVC tubing for flow | Nalgene | 8000-0004 | Sold by length, purchase accordingly |
| Syringe pump | Harvard Apparatus | PHD 2000 | |
| Sample Chamber | Custom | n/a | See Materials Section |
| Holographic Microscope | Custom | n/a | See Wallace et al. |
| Open-source software | Custom | https://github.com/bmorris3/shampoo |
Riferimenti
- Akineden, O., Weirich, S., Abdulmawjood, A., Failing, K., Buelte, M. Application of a Fluorescence Microscopy Technique for Detecting Viable Mycobacterium avium ssp. paratuberculosis Cells in Milk. Food Anal. Methods. 8, 499-506 (2015).
- Deibl, J., Paulsen, P., Bauer, F. Rapid enumeration of total aerobic microbial counts on meat and in meat products by means of the direct epifluorescence filter technique. Wien Tierarztl Monat. 85, 327-333 (1998).
- Huang, J., Li, Y., Slavik, M. F., Tao, Y., Huff, G. R. Identification and enumeration of Salmonella on sample slides of poultry carcass wash water using image analysis with fluorescent microscopy. Transactions of the Asae. 42, 267-273 (1999).
- Durtschi, J. D., et al. Increased sensitivity of bacterial detection in cerebrospinal fluid by fluorescent staining on low-fluorescence membrane filters. J Med Microbiol. 54, 843-850 (2005).
- Panicker, R. O., Soman, B., Saini, G., Rajan, J. A Review of Automatic Methods Based on Image Processing Techniques for Tuberculosis Detection from Microscopic Sputum Smear Images. J Med Syst. 40, (2016).
- Riepl, M., et al. Applicability of solid-phase cytometry and epifluorescence microscopy for rapid assessment of the microbiological quality of dialysis water. Nephrol Dial Transplant. 26, 3640-3645 (2011).
- Hwang, C. Y., Cho, B. C. Virus-infected bacteria in oligotrophic open waters of the East Sea, Korea. Aquat Microb Ecol. 30, 1-9 (2002).
- Kepner, R. L., Pratt, J. R. Use of Fluorochromes for Direct Enumeration of Total Bacteria in Environmental-Samples – Past and Present. Microbiol Rev. 58, 603-615 (1994).
- Queric, N. V., Soltwedel, T., Arntz, W. E. Application of a rapid direct viable count method to deep-sea sediment bacteria. J Microbiol Meth. 57, 351-367 (2004).
- Prieto-Ballesteros, O., Vorobyova, E., Parro, V., Rodriguez Manfredi, J. A., Gomez, F. Strategies for detection of putative life on Europa. Adv Space Res. 48, 678-688 (2011).
- Gleeson, D. F., et al. Biosignature Detection at an Arctic Analog to Europa. Astrobiology. 12, 135-150 (2012).
- Carr, C. E., Zuber, M. T., Ruvkun, G., Ieee, . 2013 Ieee Aerospace Conference IEEE Aerospace Conference Proceedings. , (2013).
- Konstantinidis, K., et al. A lander mission to probe subglacial water on Saturn’s moon Enceladus for life. Acta Astronautica. 106, 63-89 (2015).
- McKay, C. P., Anbar, A. D., Porco, C., Tsou, P. Follow the Plume: The Habitability of Enceladus. Astrobiology. 14, 352-355 (2014).
- Hoover, R. B., Hoover, R. B., Levin, G. V., Rozanov, A. Y., Wickramasinghe, N. C. . Instruments, Methods, and Missions for Astrobiology Xvii. , (2015).
- Handelsman, J. Metagenomics: application of genomics to uncultured microorganisms. Microbiol Mol Biol Rev: MMBR. 68, 669-685 (2004).
- Lebaron, P., Parthuisot, N., Catala, P. Comparison of blue nucleic acid dyes for flow cytometric enumeration of bacteria in aquatic systems. Appl Environ Microbiol. 64, 1725-1730 (1998).
- Marie, D., Partensky, F., Jacquet, S., Vaulot, D. Enumeration and cell cycle analysis of natural populations of marine picoplankton by flow cytometry using the nucleic acid stain SYBR Green I. Appl Environ Microbiol. 63, 186-193 (1997).
- Noble, R. T., Fuhrman, J. A. Use of SYBR Green I for rapid epifluorescence counts of marine viruses and bacteria. Aquat Microb Ecol. 14, 113-118 (1998).
- Forster, S., Snape, J. R., Lappin-Scott, H. M., Porter, J. Simultaneous fluorescent gram staining and activity assessment of activated sludge bacteria. Appl Environ Microbiol. 68, 4772-4779 (2002).
- Lauer, B. A., Reller, L. B., Mirrett, S. Comparison Of Acridine-Orange And Gram Stains For Detection Of Microorganisms In Cerebrospinal-Fluid And Other Clinical Specimens. J Clin Microbiol. 14, 201-205 (1981).
- Mason, D. J., Shanmuganathan, S., Mortimer, F. C., Gant, V. A. A fluorescent gram stain for flow cytometry and epifluorescence microscopy. Appl Environ Microbiol. 64, 2681-2685 (1998).
- Saida, H., Ytow, N., Seki, H. Photometric application of the Gram stain method to characterize natural bacterial populations in aquatic environments. Appl Environ Microbiol. 64, 742-747 (1998).
- Sizemore, R. K., Caldwell, J. J., Kendrick, A. S. Alternate Gram Staining Technique Using A Fluorescent Lectin. Appl Environ Microbiol. 56, 2245-2247 (1990).
- Bitton, G., Dutton, R. J., Foran, J. A. New Rapid Technique For Counting Microorganisms Directly On Membrane Filters. Stain Technology. 58, 343-346 (1983).
- Broadaway, S. C., Barton, S. A., Pyle, B. H. Rapid staining and enumeration of small numbers of total bacteria in water by solid-phase laser cytometry. Appl Environ Microbiol. 69, 4272-4273 (2003).
- Yagupsky, P., Nolte, F. S. Quantitative aspects of septicemia. Clin Microbiol Rev. 3, 269-279 (1990).
- Kang, D. K., et al. Rapid detection of single bacteria in unprocessed blood using Integrated Comprehensive Droplet Digital Detection. Nat Commun. 5, 5427 (2014).
- Hand, K. P. . Report of the Europa Lander Science Definition Team. , (2017).
- Popescu, G., et al. Optical imaging of cell mass and growth dynamics. Am J Physiol-Cell Physiol. 295, C538-C544 (2008).
- Mir, M., et al. Optical measurement of cycle-dependent cell growth. Proc Natl Acad Sci U S A. 108, 13124-13129 (2011).
- Rappaz, B., et al. Noninvasive characterization of the fission yeast cell cycle by monitoring dry mass with digital holographic microscopy. J.Biomed Opt. 14, 034049 (2009).
- Jo, Y., et al. Label-free identification of individual bacteria using Fourier transform light scattering. Opt. Express. 23, 15792-15805 (2015).
- Wallace, J. K., et al. Robust, compact implementation of an off-axis digital holographic microscope. Opt. Express. 23, 17367-17378 (2015).
- Lindensmith, C. A., et al. A Submersible, Off-Axis Holographic Microscope for Detection of Microbial Motility and Morphology in Aqueous and Icy Environments. Plos One. 11, e0147700 (2016).
- Dumas, E. M., Ozenne, V., Mielke, R. E., Nadeau, J. L. Toxicity of CdTe Quantum Dots in Bacterial Strains. IEEE Trans. NanoBiosci. 8, 58-64 (2009).
- Frisk, A., Jyot, J., Arora, S. K., Ramphal, R. Identification and functional characterization of flgM, a gene encoding the anti-sigma 28 factor in Pseudomonas aeruginosa. J Bacteriol. 184, 1514-1521 (2002).
- Adler, J., Templeton, B. The effect of environmental conditions on the motility of Escherichia coli. Journal Gen Microbiol. 46, 175-184 (1967).
- Piedrahita-Quintero, P., Castaneda, R., Garcia-Sucerquia, J. Numerical wave propagation in Image J. Appl Opt. 54, 6410-6415 (2015).
- Schnars, U., Jüptner, W. P. Digital recording and numerical reconstruction of holograms. Meas. Sci. Technol. 13, R85 (2002).

