Cuantificación de microorganismos a bajas concentraciones usando microscopia holográfica Digital (DHM)
Summary
La microscopia holográfica digital (DHM) es una técnica volumétrica que permite muestras de 50-100 X más gruesa que la microscopía brightfield en resolución comparable, con enfoque realizado post-processing. Aquí DHM se utiliza para identificar, contar y microorganismos en muy bajas densidades y en comparación con las mediciones de densidad óptica, gérmenes y conteo directo.
Abstract
Detecta y cuenta escasas muestras bacterianas tiene muchas aplicaciones en los alimentos, bebidas y la industria farmacéutica, diagnóstico médico y para la detección de vida por las misiones robóticas a otros planetas y lunas del sistema solar. En la actualidad, se cuentan escasas muestras bacterianas por microscopia de la galjanoplastia o epifluorescencia de cultura. Placas requieren largos tiempos de incubación (días a semanas) y microscopía de epifluorescencia requiere extensa de tinción y concentración de la muestra. Aquí, demostramos cómo se utiliza la microscopia holográfica digital fuera del eje (DHM) para enumerar bacterias en cultivos muy diluidas (100-104 células/mL). En primer lugar, se discute la construcción de la DHM personalizado, junto con instrucciones detalladas sobre la construcción de un instrumento de bajo costo. Se discuten los principios de la holografía, y se utiliza un modelo estadístico para estimar cuánto deberían videos para detectar células, basadas en las características de rendimiento óptico del instrumento y la concentración de la solución bacteriana (tabla 2) . Video detección de células a 105, 104103y 100 células/mL se demuestra en tiempo real utilizando hologramas no reconstruidos. Reconstrucción de imágenes de amplitud y fase se demuestra utilizando un paquete de software de código abierto.
Introduction
Determinación de la exacta conteos bacterianos en muestras muy diluidas es crucial en muchas aplicaciones: algunos ejemplos son alimentos y agua calidad análisis1,2,3; detección de patógenos en sangre, líquido cefalorraquídeo o esputo4,5; producción de productos farmacéuticos, incluyendo agua estéril6; y análisis de la comunidad ambiental en ambientes oligotróficos como en el abierto océano y los sedimentos7,8,9. Existe también un creciente interés en la detección de posible vida microbiana existente en las lunas heladas de Júpiter y Saturno, particularmente Europa10,11 y Encélado12,13, 14, que son conocidos por tener océanos líquidos subsuperficiales. Porque ninguna misión desde Viking en 1978 ha intentado encontrar existe vida en otro planeta, se ha limitado el desarrollo de tecnologías e instrumentos para la identificación bacteriana y conteo durante misiones de espacio15.
Los métodos tradicionales de gérmenes encuentran solamente las células cultivables, que pueden representar una minoría de la especie en las cepas ambientales, a veces < 1%16. Las placas requieren días o semanas de incubación para el máximo éxito, dependiendo de la cepa. Microscopía de epifluorescencia ha substituido en gran parte placa cuenta como estándar de oro para el recuento microbiano rápido y preciso. Etiquetado de ácido nucleico tintes fluorescentes como 4′, diclorhidrato 6-diamidino-2-phenylindole (DAPI), SYBR Green o naranja de acridina que se unen a los ácidos nucleicos son los típicos colorantes usados17,18,19 , aunque muchos estudios utilizan indicadores fluorescentes de Gram muestra20,21,22,23,24. Utilizando estos métodos sin previa concentración conduce a límites de detección (LoDs) de ~ 105 células por mL. Mejoras en LoD son posibles mediante filtración. Una muestra de líquido es filtrado a vacío sobre una membrana, generalmente policarbonato e idealmente negro para reducir el fondo. Bajo fondo colorantes tales como las manchas de ADN mencionadas pueden aplicarse directamente al filtro25. Para cuenta exacta por el ojo, ~ 105 células requiere por filtro, lo que significa que para las muestras más diluidas que ~ 105 células por mL, volúmenes de muestra significativa deben ser recogidos y filtrados. Dispositivos de escaneo láser se han desarrollado con el fin de explorar sistemáticamente todas las regiones del filtro y así reducir el número de células necesario para contar, empujando los límites de detección hasta 10 ~2 células por mL26. Sin embargo, estos no están disponibles en la mayoría de los laboratorios y requieren sofisticado hardware así como software que permitan la confirmación de expertos que observó las partículas es bacterias y no desechos.
Para referencia, adultos con sepsis generalmente comienzan con síntomas en < 100 células/mL de sangre y los bebés en < 10 células/mL. 10 mL, lleva un empate de sangre de un adulto y un niño, 1 mL. Métodos basados en PCR son inhibidos por la presencia de flora no patógena humana ADN y componentes inhibidores de PCR en la sangre de27,28. A pesar de una variedad de técnicas emergentes, las culturas siguen siendo el gold standard para el diagnóstico de infecciones del torrente sanguíneo, especialmente en las zonas más rurales o países en desarrollo. Para la detección de vida en otros planetas, cálculos termodinámicos pueden estimar el presupuesto de energía para la vida y por lo tanto la biomasa esperada posible. 1 – 100 células/mL se espera que sean termodinámicamente razonable en Europa29. Se puede fácilmente ver desde estos números que la detección de muy pequeñas cantidades de células en grandes cantidades de solución acuosa es un importante problema sin resolver.
En este trabajo demostramos la detección de marcescens del Serratia y Shewanella oneidensis (mutante de tipo salvaje y no-motile) en concentraciones de 105104103y 100 células/mL mediante un eje digital microscopio holográfico (DHM). La ventaja clave del DHM por microscopía óptica tradicional es la proyección de imagen simultánea de un volumen grueso de la muestra a alta resolución: en esta implementación, la cámara de la muestra fue de 0,8 mm de espesor. Estas cámaras de muestra fueron construidas por la litografía suave de polidimetilsiloxano (PDMS) de un molde de aluminio de precisión con una tolerancia de ± 50 μm. Esto representa una mejora de aproximadamente 100-fold en profundidad de campo sobre microscopía de luz de alta potencia. DHM también proporciona información de la fase cuantitativa, que permite las mediciones de la longitud del camino óptico (producto del índice de refracción y el espesor). DHM y técnicas similares han sido utilizadas para el control bacteriano y ciclo celular de la levadura y cálculo de masa seca bacteriana30,31,32; las diferencias de dispersión pueden utilizarse incluso para diferenciar cepas bacterianas33.
El instrumento que utilizamos es a la medida específicamente para uso con microorganismos, previamente publicados34,35, y su diseño y construcción se demostró y se discuten. Soluciones acuosas son suministradas continuamente a una cámara de muestra de volumen 0.25 μl a través de la bomba de jeringa; el caudal está determinado por la velocidad de fotogramas de la cámara para asegurar la proyección de imagen del volumen muestra todo. Un cálculo estadístico predice el número de volúmenes de muestra que debe ser reflejada con el fin de detectar un número significativo de células a una concentración dada.
Para aplicaciones de detección celular, reconstrucción de los hologramas en amplitud y fase de imágenes no fue requerida; Análisis fue realizado en el holograma crudo. Esto ahorra importantes recursos computacionales y espacio en disco: un holograma de 500 Mb video será 1 a 2 Tb cuando reconstruido. Sin embargo, discutir la reconstrucción a través de la profundidad de la muestra para confirmar que los hologramas representan la especie deseada. Una característica importante de DHM es su capacidad para monitorear la intensidad y fase de las imágenes. Organismos que son casi transparentes en intensidad (como la mayoría de las células biológica) aparecen claramente en fase. Como es una técnica libre de etiqueta, no tintes se utilizan. Se trata de un undvantage para aplicaciones de vuelo espacial posible, ya que los tintes no pueden sobrevivir las condiciones de una misión y — más importante — no puede ser asumido para trabajar con organismos extraterrestres, que no pueden usar ADN o ARN para codificar. También es una ventaja para el trabajo en ambientes extremos como el Ártico y el Antártico, donde los tintes pueden ser difícil de llevar a la ubicación remota y pueden degradar al almacenamiento. Reconstrucción de imágenes en fase y amplitud se realiza utilizando un paquete de software de código abierto que hemos hecho disponibles en GitHub (champú) o ImageJ.
Protocol
Representative Results
Discussion
Reconstrucción numérica de hologramas: la reconstrucción numérica de hologramas, se utiliza el método de espectro angular (ASM). Se trata de la circunvolución del holograma con la función de Green para el DHM. El frente de onda compleja de la imagen en un determinado plano focal se puede calcular empleando el teorema de la circunvolución de Fourier como sigue:
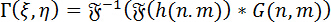 (1)
(1)
Donde <img al…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Los autores reconocen el Gordon y Betty Moore Foundation Becas 4037 y 4038 a la California Institute of Technology para la financiación de este trabajo.
Materials
| Bacto Yeast | BD Biosciences | 212750 | |
| Bacto Tryptone | BD Biosciences | 211705 | |
| Sodium chloride | Sigma-Aldrich | 7710 | Many options for purchase |
| Bacto Agar | BD Biosciences | 214010 | |
| 10 cm Petri dishes | VWR | 10053-704 | |
| 15 mL culture tubes | Falcon (Corning Life Sciences) | 352002 | Loose-capped |
| Petroff-Hauser chamber | Electron Microscopy Sciences | 3920 | |
| 10 mL syringes | BD Biosciences | 309604 | Luer-Lok tip not necessary |
| Male Luer to 1/16” barbed fitting | McMaster-Carr | 51525K291 | |
| Autoclavable 1/16” ID PVC tubing for flow | Nalgene | 8000-0004 | Sold by length, purchase accordingly |
| Syringe pump | Harvard Apparatus | PHD 2000 | |
| Sample Chamber | Custom | n/a | See Materials Section |
| Holographic Microscope | Custom | n/a | See Wallace et al. |
| Open-source software | Custom | https://github.com/bmorris3/shampoo |
Riferimenti
- Akineden, O., Weirich, S., Abdulmawjood, A., Failing, K., Buelte, M. Application of a Fluorescence Microscopy Technique for Detecting Viable Mycobacterium avium ssp. paratuberculosis Cells in Milk. Food Anal. Methods. 8, 499-506 (2015).
- Deibl, J., Paulsen, P., Bauer, F. Rapid enumeration of total aerobic microbial counts on meat and in meat products by means of the direct epifluorescence filter technique. Wien Tierarztl Monat. 85, 327-333 (1998).
- Huang, J., Li, Y., Slavik, M. F., Tao, Y., Huff, G. R. Identification and enumeration of Salmonella on sample slides of poultry carcass wash water using image analysis with fluorescent microscopy. Transactions of the Asae. 42, 267-273 (1999).
- Durtschi, J. D., et al. Increased sensitivity of bacterial detection in cerebrospinal fluid by fluorescent staining on low-fluorescence membrane filters. J Med Microbiol. 54, 843-850 (2005).
- Panicker, R. O., Soman, B., Saini, G., Rajan, J. A Review of Automatic Methods Based on Image Processing Techniques for Tuberculosis Detection from Microscopic Sputum Smear Images. J Med Syst. 40, (2016).
- Riepl, M., et al. Applicability of solid-phase cytometry and epifluorescence microscopy for rapid assessment of the microbiological quality of dialysis water. Nephrol Dial Transplant. 26, 3640-3645 (2011).
- Hwang, C. Y., Cho, B. C. Virus-infected bacteria in oligotrophic open waters of the East Sea, Korea. Aquat Microb Ecol. 30, 1-9 (2002).
- Kepner, R. L., Pratt, J. R. Use of Fluorochromes for Direct Enumeration of Total Bacteria in Environmental-Samples – Past and Present. Microbiol Rev. 58, 603-615 (1994).
- Queric, N. V., Soltwedel, T., Arntz, W. E. Application of a rapid direct viable count method to deep-sea sediment bacteria. J Microbiol Meth. 57, 351-367 (2004).
- Prieto-Ballesteros, O., Vorobyova, E., Parro, V., Rodriguez Manfredi, J. A., Gomez, F. Strategies for detection of putative life on Europa. Adv Space Res. 48, 678-688 (2011).
- Gleeson, D. F., et al. Biosignature Detection at an Arctic Analog to Europa. Astrobiology. 12, 135-150 (2012).
- Carr, C. E., Zuber, M. T., Ruvkun, G., Ieee, . 2013 Ieee Aerospace Conference IEEE Aerospace Conference Proceedings. , (2013).
- Konstantinidis, K., et al. A lander mission to probe subglacial water on Saturn’s moon Enceladus for life. Acta Astronautica. 106, 63-89 (2015).
- McKay, C. P., Anbar, A. D., Porco, C., Tsou, P. Follow the Plume: The Habitability of Enceladus. Astrobiology. 14, 352-355 (2014).
- Hoover, R. B., Hoover, R. B., Levin, G. V., Rozanov, A. Y., Wickramasinghe, N. C. . Instruments, Methods, and Missions for Astrobiology Xvii. , (2015).
- Handelsman, J. Metagenomics: application of genomics to uncultured microorganisms. Microbiol Mol Biol Rev: MMBR. 68, 669-685 (2004).
- Lebaron, P., Parthuisot, N., Catala, P. Comparison of blue nucleic acid dyes for flow cytometric enumeration of bacteria in aquatic systems. Appl Environ Microbiol. 64, 1725-1730 (1998).
- Marie, D., Partensky, F., Jacquet, S., Vaulot, D. Enumeration and cell cycle analysis of natural populations of marine picoplankton by flow cytometry using the nucleic acid stain SYBR Green I. Appl Environ Microbiol. 63, 186-193 (1997).
- Noble, R. T., Fuhrman, J. A. Use of SYBR Green I for rapid epifluorescence counts of marine viruses and bacteria. Aquat Microb Ecol. 14, 113-118 (1998).
- Forster, S., Snape, J. R., Lappin-Scott, H. M., Porter, J. Simultaneous fluorescent gram staining and activity assessment of activated sludge bacteria. Appl Environ Microbiol. 68, 4772-4779 (2002).
- Lauer, B. A., Reller, L. B., Mirrett, S. Comparison Of Acridine-Orange And Gram Stains For Detection Of Microorganisms In Cerebrospinal-Fluid And Other Clinical Specimens. J Clin Microbiol. 14, 201-205 (1981).
- Mason, D. J., Shanmuganathan, S., Mortimer, F. C., Gant, V. A. A fluorescent gram stain for flow cytometry and epifluorescence microscopy. Appl Environ Microbiol. 64, 2681-2685 (1998).
- Saida, H., Ytow, N., Seki, H. Photometric application of the Gram stain method to characterize natural bacterial populations in aquatic environments. Appl Environ Microbiol. 64, 742-747 (1998).
- Sizemore, R. K., Caldwell, J. J., Kendrick, A. S. Alternate Gram Staining Technique Using A Fluorescent Lectin. Appl Environ Microbiol. 56, 2245-2247 (1990).
- Bitton, G., Dutton, R. J., Foran, J. A. New Rapid Technique For Counting Microorganisms Directly On Membrane Filters. Stain Technology. 58, 343-346 (1983).
- Broadaway, S. C., Barton, S. A., Pyle, B. H. Rapid staining and enumeration of small numbers of total bacteria in water by solid-phase laser cytometry. Appl Environ Microbiol. 69, 4272-4273 (2003).
- Yagupsky, P., Nolte, F. S. Quantitative aspects of septicemia. Clin Microbiol Rev. 3, 269-279 (1990).
- Kang, D. K., et al. Rapid detection of single bacteria in unprocessed blood using Integrated Comprehensive Droplet Digital Detection. Nat Commun. 5, 5427 (2014).
- Hand, K. P. . Report of the Europa Lander Science Definition Team. , (2017).
- Popescu, G., et al. Optical imaging of cell mass and growth dynamics. Am J Physiol-Cell Physiol. 295, C538-C544 (2008).
- Mir, M., et al. Optical measurement of cycle-dependent cell growth. Proc Natl Acad Sci U S A. 108, 13124-13129 (2011).
- Rappaz, B., et al. Noninvasive characterization of the fission yeast cell cycle by monitoring dry mass with digital holographic microscopy. J.Biomed Opt. 14, 034049 (2009).
- Jo, Y., et al. Label-free identification of individual bacteria using Fourier transform light scattering. Opt. Express. 23, 15792-15805 (2015).
- Wallace, J. K., et al. Robust, compact implementation of an off-axis digital holographic microscope. Opt. Express. 23, 17367-17378 (2015).
- Lindensmith, C. A., et al. A Submersible, Off-Axis Holographic Microscope for Detection of Microbial Motility and Morphology in Aqueous and Icy Environments. Plos One. 11, e0147700 (2016).
- Dumas, E. M., Ozenne, V., Mielke, R. E., Nadeau, J. L. Toxicity of CdTe Quantum Dots in Bacterial Strains. IEEE Trans. NanoBiosci. 8, 58-64 (2009).
- Frisk, A., Jyot, J., Arora, S. K., Ramphal, R. Identification and functional characterization of flgM, a gene encoding the anti-sigma 28 factor in Pseudomonas aeruginosa. J Bacteriol. 184, 1514-1521 (2002).
- Adler, J., Templeton, B. The effect of environmental conditions on the motility of Escherichia coli. Journal Gen Microbiol. 46, 175-184 (1967).
- Piedrahita-Quintero, P., Castaneda, R., Garcia-Sucerquia, J. Numerical wave propagation in Image J. Appl Opt. 54, 6410-6415 (2015).
- Schnars, U., Jüptner, W. P. Digital recording and numerical reconstruction of holograms. Meas. Sci. Technol. 13, R85 (2002).

