非侵襲的診断のプロテアーゼ活動In Vivo検出するナノセンサー
Summary
プロテアーゼは、基本的な生物学的過程の調節不全プロテアーゼ活性ドライブ進行がんなど疾病の堅く調整された酵素です。このメソッドの目的は、プロテアーゼ活性測定体内ホスト尿から検出され、病気を差別胸の谷間信号を生成してナノセンサーを作成することです。
Abstract
プロテアーゼは、ペプチド結合の加水分解に特化し、恒常性と allostasis などを含む広範な生物学的プロセスを制御多機能酵素です。また、プロテアーゼ活性の調節不全病態をドライブ、癌などの疾患の機能性バイオ マーカーしたがって、プロテアーゼ活性体内を検出する機能には、生体に臨床的に関連する情報があります。このプロトコルの目的は、プロテアーゼ活性体内の尿で定量化可能な信号を生成することによってプローブ ナノセンサーを作成することです。2 つのコンポーネントから成っているこれらのプロテアーゼ ナノセンサー: ナノ粒子と基板。病気のターゲット サイトに循環の半減期と基板の供給を増やすためナノ粒子の機能。基材はターゲット プロテアーゼやプロテアーゼのグループに特定するように設計された短いペプチッド シーケンス (6-8 AA) です。基板は、ナノ粒子の表面に共役し、検出のための蛍光マーカーなど、記者が終了します。調節不全のプロテアーゼはペプチド基質を切断と記者はプロテアーゼ活性のバイオ マーカーとして定量化のため尿中にフィルターされます。ここマトリックスメタロプロテアーゼ 9 (MMP9)、腫瘍の進行および転移マウスモデルでの大腸癌の検出のために関連付けられているためナノセンサーの構築について述べる.
Introduction
プロテアーゼは、多機能酵素でペプチド結合の加水分解に特化し、恒常性、allostasis、病1など多くの生物学的プロセスを制御することです。様々 な病気、癌、心血管疾患、プロテアーゼ臨床バイオ マーカー2,3に開発の魅力的な候補者を作るなどするプロテアーゼ活性の変化の状態と相関しています。また、プロテアーゼ活性は機能的に異なるリンク病態、患者の転帰や病4の予後です。広く、さまざまな生物学的現象を検出するバイオ センサーを開発されているし、電子伝達、神経変性疾患、癌などの病気のプロセス5,6,7,8,9します具体的には、基質を用いたプロテアーゼ センサーは10を画像診断用蛍光プローブで、プロテアーゼの活性を検出するために開発されて、から体外のペプチド基質の同位体ラベル。質量11による検出。また、バインド対象プロテアーゼ12を変更する基板のような領域を含むアクティビティ ベースのプローブが開発されています。このメソッドは、ターゲット プロテアーゼは、アクティブ サイトを変更すると、組織は、生体内でアプリケーションの制限の収穫解析が必要と不可逆的阻害されます。プロテアーゼ活性の調節は内因性阻害剤の存在など他の生物学的活動のコンテキストに大きく依存するためしかし、プロテアーゼ活性生体内で、感知することが重要です。
この作業の目的は、尿で測定可能な信号を生成することによってプロテアーゼ活性体内検出アクティビティ ベース ナノセンサーの定式化を記述するためです。このプラットフォームは、機能性バイオ マーカーとして調節不全プロテアーゼ活性を用いた癌のような複雑な疾患を区別する非侵襲的診断として使用されます。私たちナノセンサー プラットフォームは、プロテアーゼの基質に共役酸化鉄ナノ粒子 (IONP) で構成されます。これらの基板は、プロテアーゼ切断基板とき解放される蛍光レポーターによって終了されます。これらの IONPs は、体内を循環させる、病変部位へをローカライズし、アクティブな疾患関連プロテアーゼに基板を公開します。胸の谷間後、蛍光レポーターは解放され、IONP に分解されていない基板のまま体のサイズが小さいため尿にフィルターが。したがって、プロテアーゼの活動生体内での増加は尿 (図 1) の報道記者の高濃度になります。当社のプラットフォームは、尿検査は、イメージング プラットフォームは必要なく、診断信号が尿中に濃縮されています。
このプラットフォームは、様々 な癌、線維症、血栓症13,14など病気を検出する設計することができます。ここで行列メタロペプチダーゼファミリー 9 (MMP9) の標高を検出するナノセンサーの設計について述べる大腸癌のバイオ マーカーとしての活動。大腸がんは、推定の 136,800 新しいケースと 2014年だけ1550,300 人が死亡、米国で癌死の 2 番目の主要な原因です。大腸腫瘍細胞を作り出す MMP9 悪性進展行列分解、転移16を駆動する示されています。さらに、私たちの文学17から MMP9 の適したペプチド基質 (PLGVRGK) を識別します。このプラットフォームは、がんの早期発見と低コスト ポイント ・ オブ ・ ケア診断13,14,18,19,20,21に使用できます。
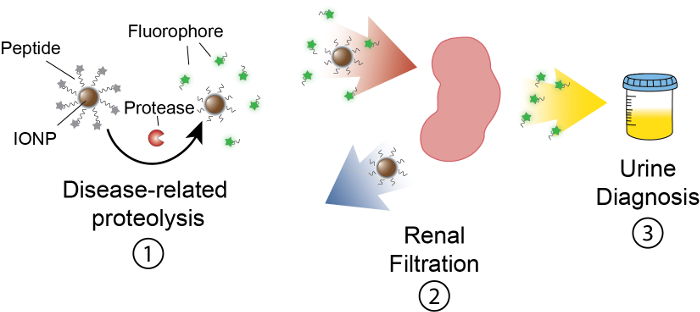
図 1: ナノセンサー活動In vivoのスケマティック。ナノセンサーは体内を循環し、病気のサイトにローカライズします。その後、病気関連プロテアーゼ クリーブ IONPs によって提示されたペプチッド基板です。劈開フラグメントのサイズは、尿中に局在することそれらを引き起こして腎クリアランスのことができます。動物が排尿後、これらのペプチド断片は、レポーター分子によって分析できます。この図の拡大版を表示するのにはここをクリックしてください。
Protocol
Representative Results
Discussion
このメソッドでは、ナノ粒子のコアに共役プロテアーゼの基質から成るアクティビティ ベース ナノセンサーの開発について説明します。劈開ペプチッドプロダクト 5 nm23と非侵襲的信号を生成する尿にフィルターろ過数腎サイズより小さいので、蛋白質分解開裂のイベントは「薬物動態スイッチ」と呼ばれます。したがって、ナノ粒子またはキャリアが 5 よりも大きい流体?…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
この作品資金が供給された NIH Director の新しいイノベーター賞受賞号DP2HD091793)。Q.D.M. は NSF 大学院研究奨学金プログラム (グラント号によってサポートされてDGE-1650044)。B.A.H は、ジョージア テック社長のフェローシップと同様、国家機関の健康 GT バイオマット訓練助成金受賞番号 5T32EB006343 の下でサポートされます。G.A.K. は、バロウズ社ようこそ基金から科学的なインターフェイスでキャリア賞を保持しています。内容は著者の責任と国立衛生研究所の公式見解を必ずしも表さない。
Materials
| 0.2 µm syringe filters | VWR | 4652 | |
| 18G needle | VWR | 89134-024 | |
| 15 mL conicals | VWR | 89039-670 | |
| 250 mL Erlenmeyer flask | VWR | 89000-362 | |
| Stir bar | VWR | 58949-006 | |
| Hot Plate/Magnetic Stirrer | VWR | 97042-634 | |
| Glacial acetic acid | VWR | 97064-482 | |
| Albumin from Bovine Serum (BSA) | Thermo Fisher | A13100 | |
| Iron (III) chloride hexahydrate | Sigma | 236489 | |
| Iron (II) chloride tetrahydrate | Sigma | 44939 | |
| Epichlorohydrin | Sigma | 45340-500ML-F | |
| DMF | Sigma | D4551 | |
| Ammonium Hydroxide | Sigma | 320145-500ML | |
| Sodium Hydroxide pellets | Sigma | 221465-500G | |
| EDTA | Sigma | E9884 | |
| Sodium Borate | Sigma | B9876 | |
| L-Cysteine | Sigma | 168149-100G | |
| Tris-HCl | Sigma | T5941 | |
| Tris base | Sigma | T6066 | |
| PBS tablets | Sigma | P4417 | |
| Dextran | Pharmacosmos | 5510 0020 9006 | |
| Amicon 15 mL 10k filters, 24 pk | Millipore | UFC901024 | |
| Amicon 15 mL 30k filters, 24 pk | Millipore | UFC903024 | |
| Amicon 15 mL 100k filters, 24 pk | Millipore | UFC910024 | |
| Zetasizer Nano ZS | Malvern Panalytical | NanoZS | |
| Slide-A-Lyzer Dialysis Cassette | LifeTech | 66130 | |
| Dynabeads MyOne Tosylactivated | LifeTech | 65501 | |
| SIA | Life Tech | 22349 | |
| PEG 20k | Laysan Bio | MPEG-SH-20K-1g | |
| Fluorescein Antibody [2A3] | GeneTex | GTX10257 | |
| Hiload 16/600 superdex 200 | GE Healthcare | 45-002-490 | |
| Plate Reader | Fisher | BTCYT5M | |
| BD Insulin Syringes | Fisher | NC0872854 |
Riferimenti
- Lopez-Otin, C., Bond, J. S. Proteases: Multifunctional enzymes in life and disease. Journal of Biological Chemistry. 283 (45), 30433-30437 (2008).
- Hua, Y., Nair, S. Proteases in cardiometabolic diseases: Pathophysiology, molecular mechanisms and clinical applications. Biochimica et Biophysica Acta. 1852 (2), 195-208 (2015).
- Koblinski, J. E., Ahram, M., Sloane, B. F. Unraveling the role of proteases in cancer. Clinica Chimica Acta. 291 (2), 113-135 (2000).
- Lilja, H., Vickers, A., Scardino, P. Measurements of proteases or protease system components in blood to enhance prediction of disease risk or outcome in possible cancer. Journal of Clinical Oncology. 25 (4), 347-348 (2007).
- Jin, H., et al. Flexible surface acoustic wave resonators built on disposable plastic film for electronics and lab-on-a-chip applications. Scientific Reports. 3, 2140 (2013).
- Ma, W., Liu, H. -. T., Long, Y. -. T. Monitoring dopamine quinone-induced dopaminergic neurotoxicity using dopamine functionalized quantum dots. ACS Applied Materials & Interfaces. 7 (26), 14352-14358 (2015).
- Zhang, W. -. H., Ma, W., Long, Y. -. T. Redox-mediated indirect fluorescence immunoassay for the detection of disease biomarkers using dopamine-functionalized quantum dots. Analytical Chemistry. 88 (10), 5131-5136 (2016).
- Ma, W., et al. Investigating electron-transfer processes using a biomimetic hybrid bilayer membrane system. Nature Protocols. 8 (3), 439-450 (2013).
- Holt, B. A., et al. Fc microparticles can modulate the physical extent and magnitude of complement activity. Biomaterials science . 5, 463-474 (2017).
- Edgington, L. E., Verdoes, M., Bogyo, M. Functional imaging of proteases: Recent advances in the design and application of substrate-based and activity-based probes. Current Opinion in Chemical Biology. 15 (6), 798-805 (2011).
- Kleifeld, O., et al. Identifying and quantifying proteolytic events and the natural N terminome by terminal amine isotopic labeling of substrates. Nature Protocols. 6 (10), 1578-1611 (2011).
- Sanman, L. E., Bogyo, M. Activity-based profiling of proteases. Annual Review of Biochemistry. 83 (1), 249-273 (2014).
- Kwong, G. A., et al. Mass-encoded synthetic biomarkers for multiplexed urinary monitoring of disease. Nature Biotechnology. 31 (1), 63-70 (2013).
- Dudani, J. S., Buss, C. G., Akana, R. T. K., Kwong, G. A., Bhatia, S. N. Sustained-release synthetic biomarkers for monitoring thrombosis and inflammation using point-of-care compatible readouts. Advanced Functional Materials. 26 (17), 2919-2928 (2016).
- Meester, R. G. S., et al. Public health impact of achieving 80% colorectal cancer screening rates in the United States by 2018. Cancer. 121 (13), 2281-2285 (2015).
- Mehner, C., et al. Tumor cell-produced matrix metalloproteinase 9 (MMP-9) drives malignant progression and metastasis of basal-like triple negative breast cancer. Oncotarget. 5 (9), 2736-2749 (2014).
- Bremer, C., Tung, C. H., Weissleder, R. In vivo molecular target assessment of matrix metalloproteinase inhibition. Nature Medicine. 7 (6), 743-748 (2001).
- Warren, A. D., et al. Disease detection by ultrasensitive quantification of microdosed synthetic urinary biomarkers. Journal of the American Chemical Society. 136 (39), 13709-13714 (2014).
- Warren, A. D., Kwong, G. A., Wood, D. K., Lin, K. Y., Bhatia, S. N. Point-of-care diagnostics for noncommunicable diseases using synthetic urinary biomarkers and paper microfluidics. Proceedings of the National Academy of Sciences of the United States of America. 111 (10), 3671-3676 (2014).
- Kwong, G. A., et al. Mathematical framework for activity-based cancer biomarkers. Proceedings of the National Academy of Sciences of the United States of America. 112 (41), 12627-12632 (2015).
- Dudani, J. S., Jain, P. K., Kwong, G. A., Stevens, K. R., Bhatia, S. N. Photoactivated spatiotemporally-responsive nanosensors of in vivo protease activity. ACS Nano. 9 (12), 11708-11717 (2015).
- Palmacci, S., Josephson, L. Synthesis of polysaccharide covered superparamagnetic oxide colloids. US patent. , (1991).
- Choi, H. S., et al. Renal clearance of nanoparticles. Nature Biotechnology. 25 (10), 1165-1170 (2007).
- Harris, T. J., von Maltzahn, G., Derfus, A. M., Ruoslahti, E., Bhatia, S. N. Proteolytic actuation of nanoparticle self-assembly. Angewandte Chemie (International edition in English). 45 (19), 3161-3165 (2006).
- Kwon, E. J., Dudani, J. S., Bhatia, S. N. Ultrasensitive tumour-penetrating nanosensors of protease activity. Nature Biomedical Engineering. 1, (2017).
- Villanueva, J., Nazarian, A., Lawlor, K., Tempst, P. Monitoring Peptidase activities in complex proteomes by MALDI-TOF mass spectrometry. Nature Protocols. 4 (8), 1167-1183 (2009).
- Villanueva, J., et al. Differential exoprotease activities confer tumor-specific serum peptidome patterns. The Journal of Clinical Investigation. 116 (1), 271-284 (2006).

