Nanosensores para detectar actividad proteasa en Vivo para el diagnóstico no invasivo
Summary
Las proteasas son fuertemente reguladas las enzimas implicadas en procesos biológicos fundamentales y desajuste proteasa actividad unidades progresión de enfermedades complejas como el cáncer. Este método pretende crear nanosensores que miden actividad proteasa en vivo produciendo una señal de escote que es detectable de la orina de host y discrimina la enfermedad.
Abstract
Las proteasas son enzimas multifuncionales que se especializan en la hidrólisis de enlaces peptídicos y controlan amplios procesos biológicos incluyendo homeostasis y Alostasis. Por otra parte, actividad de las proteasas altera unidades patogenesia y es un biomarcador funcional de enfermedades como el cáncer; por lo tanto, la capacidad de detectar actividad proteasa en vivo puede proporcionar información clínicamente relevante para el diagnóstico biomédico. El objetivo de este protocolo es crear nanosensores que probe para actividad proteasa en vivo produciendo una señal cuantificable en la orina. Estos nanosensores de proteasa consisten en dos componentes: una nanopartícula y sustrato. Las funciones de nanopartículas para aumentar la entrega de Half-Life y el substrato de la circulación a sitios de enfermedad de destino. El sustrato es una secuencia de péptido corto (6-8 AA), que está diseñada para ser específicos de una proteasa de destino o grupo de las proteasas. El substrato se conjuga a la superficie de la nanopartícula y se termina por un reportero, como un marcador fluorescente para la detección. Como existen proteasas desdoblan el sustrato del péptido, el reportero se filtra en orina para cuantificación como un biomarcador de actividad de la proteasa. Adjunto describimos la construcción de un nanosensor de matriz metaloproteinasa 9 (MMP9), que se asocia con progresión del tumor y la metástasis, para detección de cáncer colorrectal en un modelo murino.
Introduction
Las proteasas son enzimas multifuncionales que se especializan en la hidrólisis de enlaces peptídicos y tener un control significativo sobre muchos procesos biológicos, incluyendo homeostasis, Alostasis y enfermedad1. Un estado alterado de la actividad de la proteasa se ha correlacionado a una variedad de enfermedades, incluyendo cáncer y enfermedades cardiovasculares, que los candidatos atractivos proteasas para desarrollo de biomarcadores clínicos2,3. Por otra parte, actividad de las proteasas es pathogeneses funcionalmente vinculados a distintas, los resultados del paciente y pronóstico de la enfermedad4. En términos generales, se han desarrollado biosensores para detectar varios fenómenos biológicos y procesos de enfermedades, como cáncer, enfermedades neurodegenerativas y transferencia de electrones5,6,7,8 , 9. más específicamente, sensores basados en el sustrato de la proteasa se han desarrollado para detectar la actividad de la proteasa e incluyen sondas fluorógenos para diagnóstico proyección de imagen10 y etiquetados isotópicamente sustratos péptido para in vitro detección por espectrometría de masas11. Además, se han desarrollado sondas basadas en la actividad, que contienen sustrato-como regiones que unen o modificar el destino proteasa12. Con este método, la proteasa destino irreversible es inhibida cuando se modifica el sitio activo, y el análisis requiere la cosecha de tejido, que se limita a aplicaciones en vivo . Sin embargo, es importante sentir proteasa actividad en vivo, porque la regulación de la actividad de las proteasas es pesadamente dependiente en el contexto de otras actividades biológicas como la presencia de inhibidores endógenos.
El objetivo de este trabajo es describir la formulación de nanosensores basados en actividades que detectan actividad proteasa en vivo produciendo una señal medible en orina. Esta plataforma se utiliza como un diagnóstico no invasivo para diferenciar enfermedades complejas como el cáncer mediante el uso de actividad de las proteasas altera como un biomarcador funcional. Nuestra plataforma de nanosensor consiste en óxido de hierro nanopartículas (IONP) conjugadas con sustratos de la proteasa. Estos sustratos son terminados por un reportero fluorescente que se libera cuando las proteasas desdoblan el sustrato. Estos IONPs circulan en vivo, localización sitios de enfermedad y exponen sustratos activos proteasas asociadas a la enfermedad. Después de hendidura, reporteros fluorescentes son liberados y, debido a su pequeño tamaño, se filtran en orina, mientras que sustratos uncleaved en el IONP permanecen en el cuerpo. Por lo tanto, un aumento en las actividades de proteasa en vivo dará como resultado concentraciones más altas del reportero en orina (figura 1). Puesto que nuestra plataforma es una prueba de orina, es necesario no hay plataforma de proyección de imagen y señales de diagnóstico están enriquecidas en la orina.
Esta plataforma puede ser diseñada para detectar una variedad de enfermedades incluyendo cáncer, fibrosis y trombosis13,14. Aquí describimos el diseño de nanosensores para detectar elevaciones en curación de matriz 9 (MMP9) actividad como un biomarcador del cáncer colorrectal. El cáncer colorrectal es la segunda causa de muerte por cáncer en los Estados Unidos, con un estimado 136.800 nuevos casos y 50.300 muertes en 2014 solo15. Las células del tumor colorrectal producen MMP9, que se ha demostrado para conducir la progresión maligna, degradación de la matriz, así como metástasis16. Además, identificamos un substrato conveniente péptido (PLGVRGK) para MMP9 de la literatura17. Esta plataforma puede usarse para detección temprana de cáncer y el diagnóstico de punto de atención de bajo costo13,14,18,19,20,21.
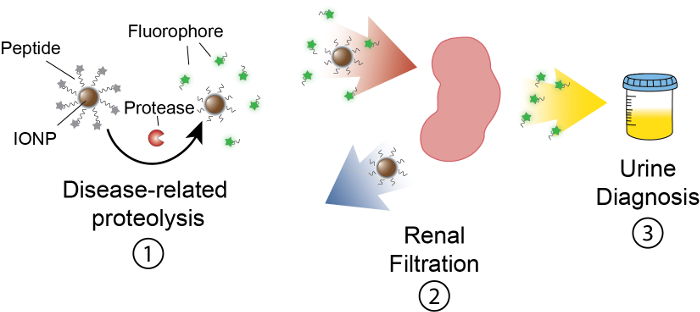
Figura 1: esquema de Nanosensor actividad en vivo. Nanosensores circulan a través del cuerpo y localización a los sitios de la enfermedad. Entonces, las proteasas relacionadas con la enfermedad cleave sustratos péptido presentados por IONPs. El tamaño de los fragmentos exfoliados permite depuración renal, haciendo que se localiza en la orina. Después de que el animal orina, estos fragmentos de péptido pueden analizarse por su molécula reporter. Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
Este método describe el desarrollo de nanosensores basados en la actividad de proteasa sustratos conjugados a un núcleo de nanopartículas. El evento de clivaje proteolítico es apodado el interruptor”farmacocinético”, porque los productos de peptide hendido son más pequeños que el límite de tamaño renal filtración de 5 nm23 y filtro en orina para producir una señal no invasiva. Por lo tanto, es importante utilizar nanopartículas o portadores con un radio hidrodinámico que es más grand…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Este trabajo fue financiado por un Director de NIH nuevo innovador Award (premio no. DP2HD091793). Q.D.M. es apoyado por la NSF investigación becas postgrado (Grant no. DGE-1650044). B.A.H es apoyado por el nacional institutos de salud GT BioMAT beca de formación bajo la concesión número 5T32EB006343, así como la beca del Presidente de Tech de Georgia. G.A.K. tiene un premio de carrera en la interfaz científica desde el fondo de la recepción de Burroughs. El contenido es responsabilidad exclusiva de los autores y no representan necesariamente las opiniones oficiales de los institutos nacionales de salud.
Materials
| 0.2 µm syringe filters | VWR | 4652 | |
| 18G needle | VWR | 89134-024 | |
| 15 mL conicals | VWR | 89039-670 | |
| 250 mL Erlenmeyer flask | VWR | 89000-362 | |
| Stir bar | VWR | 58949-006 | |
| Hot Plate/Magnetic Stirrer | VWR | 97042-634 | |
| Glacial acetic acid | VWR | 97064-482 | |
| Albumin from Bovine Serum (BSA) | Thermo Fisher | A13100 | |
| Iron (III) chloride hexahydrate | Sigma | 236489 | |
| Iron (II) chloride tetrahydrate | Sigma | 44939 | |
| Epichlorohydrin | Sigma | 45340-500ML-F | |
| DMF | Sigma | D4551 | |
| Ammonium Hydroxide | Sigma | 320145-500ML | |
| Sodium Hydroxide pellets | Sigma | 221465-500G | |
| EDTA | Sigma | E9884 | |
| Sodium Borate | Sigma | B9876 | |
| L-Cysteine | Sigma | 168149-100G | |
| Tris-HCl | Sigma | T5941 | |
| Tris base | Sigma | T6066 | |
| PBS tablets | Sigma | P4417 | |
| Dextran | Pharmacosmos | 5510 0020 9006 | |
| Amicon 15 mL 10k filters, 24 pk | Millipore | UFC901024 | |
| Amicon 15 mL 30k filters, 24 pk | Millipore | UFC903024 | |
| Amicon 15 mL 100k filters, 24 pk | Millipore | UFC910024 | |
| Zetasizer Nano ZS | Malvern Panalytical | NanoZS | |
| Slide-A-Lyzer Dialysis Cassette | LifeTech | 66130 | |
| Dynabeads MyOne Tosylactivated | LifeTech | 65501 | |
| SIA | Life Tech | 22349 | |
| PEG 20k | Laysan Bio | MPEG-SH-20K-1g | |
| Fluorescein Antibody [2A3] | GeneTex | GTX10257 | |
| Hiload 16/600 superdex 200 | GE Healthcare | 45-002-490 | |
| Plate Reader | Fisher | BTCYT5M | |
| BD Insulin Syringes | Fisher | NC0872854 |
Riferimenti
- Lopez-Otin, C., Bond, J. S. Proteases: Multifunctional enzymes in life and disease. Journal of Biological Chemistry. 283 (45), 30433-30437 (2008).
- Hua, Y., Nair, S. Proteases in cardiometabolic diseases: Pathophysiology, molecular mechanisms and clinical applications. Biochimica et Biophysica Acta. 1852 (2), 195-208 (2015).
- Koblinski, J. E., Ahram, M., Sloane, B. F. Unraveling the role of proteases in cancer. Clinica Chimica Acta. 291 (2), 113-135 (2000).
- Lilja, H., Vickers, A., Scardino, P. Measurements of proteases or protease system components in blood to enhance prediction of disease risk or outcome in possible cancer. Journal of Clinical Oncology. 25 (4), 347-348 (2007).
- Jin, H., et al. Flexible surface acoustic wave resonators built on disposable plastic film for electronics and lab-on-a-chip applications. Scientific Reports. 3, 2140 (2013).
- Ma, W., Liu, H. -. T., Long, Y. -. T. Monitoring dopamine quinone-induced dopaminergic neurotoxicity using dopamine functionalized quantum dots. ACS Applied Materials & Interfaces. 7 (26), 14352-14358 (2015).
- Zhang, W. -. H., Ma, W., Long, Y. -. T. Redox-mediated indirect fluorescence immunoassay for the detection of disease biomarkers using dopamine-functionalized quantum dots. Analytical Chemistry. 88 (10), 5131-5136 (2016).
- Ma, W., et al. Investigating electron-transfer processes using a biomimetic hybrid bilayer membrane system. Nature Protocols. 8 (3), 439-450 (2013).
- Holt, B. A., et al. Fc microparticles can modulate the physical extent and magnitude of complement activity. Biomaterials science . 5, 463-474 (2017).
- Edgington, L. E., Verdoes, M., Bogyo, M. Functional imaging of proteases: Recent advances in the design and application of substrate-based and activity-based probes. Current Opinion in Chemical Biology. 15 (6), 798-805 (2011).
- Kleifeld, O., et al. Identifying and quantifying proteolytic events and the natural N terminome by terminal amine isotopic labeling of substrates. Nature Protocols. 6 (10), 1578-1611 (2011).
- Sanman, L. E., Bogyo, M. Activity-based profiling of proteases. Annual Review of Biochemistry. 83 (1), 249-273 (2014).
- Kwong, G. A., et al. Mass-encoded synthetic biomarkers for multiplexed urinary monitoring of disease. Nature Biotechnology. 31 (1), 63-70 (2013).
- Dudani, J. S., Buss, C. G., Akana, R. T. K., Kwong, G. A., Bhatia, S. N. Sustained-release synthetic biomarkers for monitoring thrombosis and inflammation using point-of-care compatible readouts. Advanced Functional Materials. 26 (17), 2919-2928 (2016).
- Meester, R. G. S., et al. Public health impact of achieving 80% colorectal cancer screening rates in the United States by 2018. Cancer. 121 (13), 2281-2285 (2015).
- Mehner, C., et al. Tumor cell-produced matrix metalloproteinase 9 (MMP-9) drives malignant progression and metastasis of basal-like triple negative breast cancer. Oncotarget. 5 (9), 2736-2749 (2014).
- Bremer, C., Tung, C. H., Weissleder, R. In vivo molecular target assessment of matrix metalloproteinase inhibition. Nature Medicine. 7 (6), 743-748 (2001).
- Warren, A. D., et al. Disease detection by ultrasensitive quantification of microdosed synthetic urinary biomarkers. Journal of the American Chemical Society. 136 (39), 13709-13714 (2014).
- Warren, A. D., Kwong, G. A., Wood, D. K., Lin, K. Y., Bhatia, S. N. Point-of-care diagnostics for noncommunicable diseases using synthetic urinary biomarkers and paper microfluidics. Proceedings of the National Academy of Sciences of the United States of America. 111 (10), 3671-3676 (2014).
- Kwong, G. A., et al. Mathematical framework for activity-based cancer biomarkers. Proceedings of the National Academy of Sciences of the United States of America. 112 (41), 12627-12632 (2015).
- Dudani, J. S., Jain, P. K., Kwong, G. A., Stevens, K. R., Bhatia, S. N. Photoactivated spatiotemporally-responsive nanosensors of in vivo protease activity. ACS Nano. 9 (12), 11708-11717 (2015).
- Palmacci, S., Josephson, L. Synthesis of polysaccharide covered superparamagnetic oxide colloids. US patent. , (1991).
- Choi, H. S., et al. Renal clearance of nanoparticles. Nature Biotechnology. 25 (10), 1165-1170 (2007).
- Harris, T. J., von Maltzahn, G., Derfus, A. M., Ruoslahti, E., Bhatia, S. N. Proteolytic actuation of nanoparticle self-assembly. Angewandte Chemie (International edition in English). 45 (19), 3161-3165 (2006).
- Kwon, E. J., Dudani, J. S., Bhatia, S. N. Ultrasensitive tumour-penetrating nanosensors of protease activity. Nature Biomedical Engineering. 1, (2017).
- Villanueva, J., Nazarian, A., Lawlor, K., Tempst, P. Monitoring Peptidase activities in complex proteomes by MALDI-TOF mass spectrometry. Nature Protocols. 4 (8), 1167-1183 (2009).
- Villanueva, J., et al. Differential exoprotease activities confer tumor-specific serum peptidome patterns. The Journal of Clinical Investigation. 116 (1), 271-284 (2006).

