Nanosensors til å oppdage Protease aktivitet i Vivo Noninvasive diagnostikk
Summary
Proteaser er strengt regulert enzymer som er involvert i grunnleggende biologiske prosesser og dysregulated protease aktivitet stasjoner progresjon av komplekse sykdommer som kreft. Denne metoden mål er å skape nanosensors som måler protease aktivitet i vivo ved å produsere en cleavage signal som er synlig fra verten urin og diskriminerer sykdom.
Abstract
Proteaser er multi-funksjonelle enzymer som spesialiserer seg på hydrolyse av peptid-obligasjoner og kontrollere bred biologiske prosesser inkludert homeostase og kunnskap. Videre dysregulated protease aktivitet stasjoner patogenesen og er en funksjonell biomarkør av sykdommer som kreft; Derfor oppgir muligheten til å oppdage protease aktivitet i vivo klinisk relevant informasjon for biomedisinsk diagnostikk. Målet med denne protokollen er å opprette nanosensors som probe protease aktivitet i vivo ved å produsere et kvantifiserbare signal i urinen. Disse protease nanosensors består av to komponenter: en hydrogenion og underlaget. Funksjonene hydrogenion å øke sirkulasjonen half-life og underlaget levering til sykdom målområder. Underlaget er en kort peptid sekvens (6-8 AA), som er utformet for å være spesifikke for en mål protease eller proteaser. Underlaget er konjugert til overflaten av hydrogenion og avbrytes av en journalist, som en fluorescerende markør, for gjenkjenning. Som dysregulated proteaser cleave peptid underlaget, filtreres reporteren i urin for kvantifisering som en biomarkør protease aktivitet. Her beskriver vi byggingen av en nanosensor for matrise metalloproteinase 9 (MMP9), som er forbundet med svulst progresjon og metastasering, deteksjon av kolorektal kreft i en musemodell.
Introduction
Proteaser er multi-funksjonelle enzymer som spesialiserer seg på hydrolyse av peptid-obligasjoner og har betydelig kontroll over mange biologiske prosesser, herunder homeostase, kunnskap og sykdom1. En meditativ tilstand protease aktivitet er forbundet til en rekke sykdommer, inkludert kreft og hjerte-og karsykdommer, gjør proteaser attraktive kandidater for utvikling i klinisk biomarkers2,3. Videre er protease aktivitet funksjonelt knyttet til forskjellige pathogeneses, pasientens utfall og prognosen for sykdom4. Forstand, biosensors er utviklet for å oppdage ulike biologiske fenomener og sykdommer som kreft, nevrodegenerative sykdommer og elektron overføring behandler5,6,7,8 , 9. mer spesifikt, substrat-baserte protease sensorer er utviklet for å oppdage protease aktivitet, og inkluderer fluorogenic sonder for diagnostic imaging10 og isotopically merket peptid substrater for i vitro gjenkjenning av massespektrometri11. I tillegg er aktivitetsbaserte sonder utviklet, som inneholder substrat som regioner som binder eller endre målet protease12. Med denne metoden hemmes irreversibelt målet protease når det aktive området er endret, og analyse krever høsting av vev, som begrenser i vivo programmer. Imidlertid er det viktig å kjenne protease aktivitet i vivo, fordi regulering av protease aktivitet er sterkt avhengig av andre biologiske aktiviteter som tilstedeværelsen av endogene hemmere.
Målet med dette arbeidet er å beskrive utformingen av aktivitetsbaserte nanosensors som oppdager protease aktivitet i vivo ved å produsere en målbar signal i urinen. Denne plattformen er brukt som en noninvasive diagnose for å diskriminere komplekse sykdommer som kreft med dysregulated protease aktivitet som en funksjonell biomarkør. Vår nanosensor består av jernoksid nanopartikler (IONP) konjugert til protease underlag. Disse underlag er avsluttet av en fluorescerende som frigjøres når proteaser cleave underlaget. Disse IONPs sirkulere i vivo, lokalisere til sykdom nettsteder og avdekke underlag til aktive sykdomsassosierte proteaser. Etter cleavage, fluorescerende journalister er utgitt og på grunn av sin lille størrelse, er filtrert i urin, mens uncleaved underlag på IONP forbli i kroppen. Derfor vil en økning i protease aktiviteter i vivo resultere i høyere konsentrasjoner av reporteren i urin (figur 1). Siden vår plattform er en urinprøve, kreves ingen tenkelig plattform og diagnostiske signaler er beriket i urinen.
Denne plattformen kan bli konstruert for å oppdage en rekke sykdommer, inkludert kreft, fibrose og blodpropp13,14. Her beskriver vi utformingen av nanosensors å oppdage høyder i matrise metallopeptidase 9 (MMP9) aktivitet som en biomarkør for tykktarmskreft. Tykktarmskreft er den nest største årsaken til kreftdødsfall i USA, med en anslått 136,800 nye tilfeller og 50,300 dødsfall i 2014 alene15. Colorectal kreftceller produsere MMP9, som har vist å kjøre ondartet progresjon, matrix fornedrelse, samt metastasering16. I tillegg identifisert vi en egnet peptid substrat (PLGVRGK) for MMP9 litteratur17. Denne plattformen kan brukes for tidlig påvisning av kreft og rimelig point-of-care diagnostics13,14,18,19,20,21.
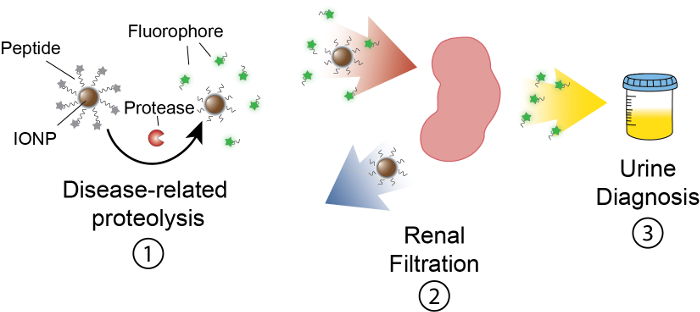
Figur 1: skjematisk av Nanosensor aktivitet i vivo. Nanosensors sirkulerer gjennom kroppen og lokalisere områder av sykdom. Deretter cleave sykdom-relaterte proteaser peptid underlag presentert av IONPs. Størrelsen på kløyvde fragmenter gir nedsatt fortolling, forårsaker dem til å lokalisere i urinen. Etter dyret urinates, kan disse peptid fragmentene analyseres av deres reporter molekylet. Klikk her for å se en større versjon av dette tallet.
Protocol
Representative Results
Discussion
Denne metoden beskriver utviklingen av aktivitetsbaserte nanosensors bestående av protease underlag konjugert til en hydrogenion kjerne. Hendelsen proteolytisk cleavage er kalt “farmakokinetiske bryteren”, fordi kløyvde peptid produkter er mindre enn den nyre størrelse filtrering av 5 nm23 og filter i urin å produsere en noninvasive signal. Derfor er det viktig å bruke nanopartikler eller operatører med en etter radius som er større enn 5 nm, som noe mindre fjernes raskt ved nyrene og forvi…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Dette arbeidet ble finansiert av en NIH nye innovatør regiprisen (Award nr. DP2HD091793). Q.D.M. støttes av NSF Graduate forskning stipend programmet (Grant nr. DGE-1650044). B.A.H støttes av nasjonale institutter for helse GT BioMAT trening stipendet under prisen nummer 5T32EB006343 samt Georgia Tech presidentens fellesskap. G.A.K. holder en Career-pris på vitenskapelige grensesnittet fra Burroughs velkommen fondet. Innholdet er ansvar forfattere og representerer ikke nødvendigvis den offisielle synet til National Institutes of Health.
Materials
| 0.2 µm syringe filters | VWR | 4652 | |
| 18G needle | VWR | 89134-024 | |
| 15 mL conicals | VWR | 89039-670 | |
| 250 mL Erlenmeyer flask | VWR | 89000-362 | |
| Stir bar | VWR | 58949-006 | |
| Hot Plate/Magnetic Stirrer | VWR | 97042-634 | |
| Glacial acetic acid | VWR | 97064-482 | |
| Albumin from Bovine Serum (BSA) | Thermo Fisher | A13100 | |
| Iron (III) chloride hexahydrate | Sigma | 236489 | |
| Iron (II) chloride tetrahydrate | Sigma | 44939 | |
| Epichlorohydrin | Sigma | 45340-500ML-F | |
| DMF | Sigma | D4551 | |
| Ammonium Hydroxide | Sigma | 320145-500ML | |
| Sodium Hydroxide pellets | Sigma | 221465-500G | |
| EDTA | Sigma | E9884 | |
| Sodium Borate | Sigma | B9876 | |
| L-Cysteine | Sigma | 168149-100G | |
| Tris-HCl | Sigma | T5941 | |
| Tris base | Sigma | T6066 | |
| PBS tablets | Sigma | P4417 | |
| Dextran | Pharmacosmos | 5510 0020 9006 | |
| Amicon 15 mL 10k filters, 24 pk | Millipore | UFC901024 | |
| Amicon 15 mL 30k filters, 24 pk | Millipore | UFC903024 | |
| Amicon 15 mL 100k filters, 24 pk | Millipore | UFC910024 | |
| Zetasizer Nano ZS | Malvern Panalytical | NanoZS | |
| Slide-A-Lyzer Dialysis Cassette | LifeTech | 66130 | |
| Dynabeads MyOne Tosylactivated | LifeTech | 65501 | |
| SIA | Life Tech | 22349 | |
| PEG 20k | Laysan Bio | MPEG-SH-20K-1g | |
| Fluorescein Antibody [2A3] | GeneTex | GTX10257 | |
| Hiload 16/600 superdex 200 | GE Healthcare | 45-002-490 | |
| Plate Reader | Fisher | BTCYT5M | |
| BD Insulin Syringes | Fisher | NC0872854 |
Riferimenti
- Lopez-Otin, C., Bond, J. S. Proteases: Multifunctional enzymes in life and disease. Journal of Biological Chemistry. 283 (45), 30433-30437 (2008).
- Hua, Y., Nair, S. Proteases in cardiometabolic diseases: Pathophysiology, molecular mechanisms and clinical applications. Biochimica et Biophysica Acta. 1852 (2), 195-208 (2015).
- Koblinski, J. E., Ahram, M., Sloane, B. F. Unraveling the role of proteases in cancer. Clinica Chimica Acta. 291 (2), 113-135 (2000).
- Lilja, H., Vickers, A., Scardino, P. Measurements of proteases or protease system components in blood to enhance prediction of disease risk or outcome in possible cancer. Journal of Clinical Oncology. 25 (4), 347-348 (2007).
- Jin, H., et al. Flexible surface acoustic wave resonators built on disposable plastic film for electronics and lab-on-a-chip applications. Scientific Reports. 3, 2140 (2013).
- Ma, W., Liu, H. -. T., Long, Y. -. T. Monitoring dopamine quinone-induced dopaminergic neurotoxicity using dopamine functionalized quantum dots. ACS Applied Materials & Interfaces. 7 (26), 14352-14358 (2015).
- Zhang, W. -. H., Ma, W., Long, Y. -. T. Redox-mediated indirect fluorescence immunoassay for the detection of disease biomarkers using dopamine-functionalized quantum dots. Analytical Chemistry. 88 (10), 5131-5136 (2016).
- Ma, W., et al. Investigating electron-transfer processes using a biomimetic hybrid bilayer membrane system. Nature Protocols. 8 (3), 439-450 (2013).
- Holt, B. A., et al. Fc microparticles can modulate the physical extent and magnitude of complement activity. Biomaterials science . 5, 463-474 (2017).
- Edgington, L. E., Verdoes, M., Bogyo, M. Functional imaging of proteases: Recent advances in the design and application of substrate-based and activity-based probes. Current Opinion in Chemical Biology. 15 (6), 798-805 (2011).
- Kleifeld, O., et al. Identifying and quantifying proteolytic events and the natural N terminome by terminal amine isotopic labeling of substrates. Nature Protocols. 6 (10), 1578-1611 (2011).
- Sanman, L. E., Bogyo, M. Activity-based profiling of proteases. Annual Review of Biochemistry. 83 (1), 249-273 (2014).
- Kwong, G. A., et al. Mass-encoded synthetic biomarkers for multiplexed urinary monitoring of disease. Nature Biotechnology. 31 (1), 63-70 (2013).
- Dudani, J. S., Buss, C. G., Akana, R. T. K., Kwong, G. A., Bhatia, S. N. Sustained-release synthetic biomarkers for monitoring thrombosis and inflammation using point-of-care compatible readouts. Advanced Functional Materials. 26 (17), 2919-2928 (2016).
- Meester, R. G. S., et al. Public health impact of achieving 80% colorectal cancer screening rates in the United States by 2018. Cancer. 121 (13), 2281-2285 (2015).
- Mehner, C., et al. Tumor cell-produced matrix metalloproteinase 9 (MMP-9) drives malignant progression and metastasis of basal-like triple negative breast cancer. Oncotarget. 5 (9), 2736-2749 (2014).
- Bremer, C., Tung, C. H., Weissleder, R. In vivo molecular target assessment of matrix metalloproteinase inhibition. Nature Medicine. 7 (6), 743-748 (2001).
- Warren, A. D., et al. Disease detection by ultrasensitive quantification of microdosed synthetic urinary biomarkers. Journal of the American Chemical Society. 136 (39), 13709-13714 (2014).
- Warren, A. D., Kwong, G. A., Wood, D. K., Lin, K. Y., Bhatia, S. N. Point-of-care diagnostics for noncommunicable diseases using synthetic urinary biomarkers and paper microfluidics. Proceedings of the National Academy of Sciences of the United States of America. 111 (10), 3671-3676 (2014).
- Kwong, G. A., et al. Mathematical framework for activity-based cancer biomarkers. Proceedings of the National Academy of Sciences of the United States of America. 112 (41), 12627-12632 (2015).
- Dudani, J. S., Jain, P. K., Kwong, G. A., Stevens, K. R., Bhatia, S. N. Photoactivated spatiotemporally-responsive nanosensors of in vivo protease activity. ACS Nano. 9 (12), 11708-11717 (2015).
- Palmacci, S., Josephson, L. Synthesis of polysaccharide covered superparamagnetic oxide colloids. US patent. , (1991).
- Choi, H. S., et al. Renal clearance of nanoparticles. Nature Biotechnology. 25 (10), 1165-1170 (2007).
- Harris, T. J., von Maltzahn, G., Derfus, A. M., Ruoslahti, E., Bhatia, S. N. Proteolytic actuation of nanoparticle self-assembly. Angewandte Chemie (International edition in English). 45 (19), 3161-3165 (2006).
- Kwon, E. J., Dudani, J. S., Bhatia, S. N. Ultrasensitive tumour-penetrating nanosensors of protease activity. Nature Biomedical Engineering. 1, (2017).
- Villanueva, J., Nazarian, A., Lawlor, K., Tempst, P. Monitoring Peptidase activities in complex proteomes by MALDI-TOF mass spectrometry. Nature Protocols. 4 (8), 1167-1183 (2009).
- Villanueva, J., et al. Differential exoprotease activities confer tumor-specific serum peptidome patterns. The Journal of Clinical Investigation. 116 (1), 271-284 (2006).

