阳性肽载体软骨内运输特性的特征
Summary
该协议确定软骨中阳离子肽载体的均衡吸收、渗透深度和非平衡扩散率。运输特性的特性对于确保有效的生物反应至关重要。这些方法可用于设计最佳充电药物载体,以定位带负充电的组织。
Abstract
体内一些带负电的组织,如软骨,由于其负充电的聚类药物密度高,对靶向药物的输送提出了障碍,因此,需要改进靶向方法,以增加其治疗反应。由于软骨具有高负固定电荷密度,因此药物可以用正电荷药物载体进行改性,以利用静电相互作用,从而增强软骨内药物的运输能力。因此,研究药物携带者的运输对于预测药物在诱导生物反应方面的有效性至关重要。进行了三个实验的设计,可以量化软骨外植中阳离子肽载体的均衡吸收、渗透深度和非均衡扩散率。均衡吸收实验提供了软骨内溶质浓度与周围浴池相比的测量,这对于预测药物载体在提高软骨药物的治疗浓度方面的潜力非常有用。使用共物显微镜进行渗透深度研究,允许从软骨表面扩散到深区对1D溶质扩散的视觉表示,这对于评估溶质是否到达其基质和细胞靶点非常重要。使用定制设计的运输室进行非均衡扩散率研究,通过描述在组织内荧光标记的溶解剂的扩散速率,可以测量与组织基质结合相互作用的强度;这有利于设计软骨的最佳结合强度载体。三种运输实验的结果共同为设计最佳电荷药物载体提供了指导,这些药物载体利用了药物输送应用中的弱和可逆电荷相互作用。这些实验方法也可以用于评价药物和药物载体结合的运输。此外,这些方法可以适用于瞄准其他带负功能的组织,如半月板,角膜和玻璃幽默。
Introduction
药物输送到体内带负电的组织仍然是一个挑战,因为药物无法深入组织以达到细胞和基质靶点1。其中几个组织由密集包装的负电荷聚集组成,在组织内产生高负固定电荷密度(FCD)2,并充当大多数大分子3,4,的传递屏障。然而,在带正电荷的药物携带者的协助下,这种带负电荷的组织屏障实际上可以通过静电电荷相互作用转化为药物库,以持续输送药物1、5、6、7(,5,6,7图1)。
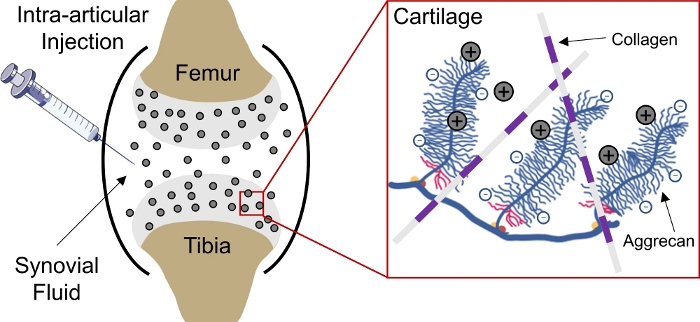
图1:基于电荷的软骨内软骨交付CPC。将CPC在关节空间的关节内注射。带正电荷的CPC和带负电荷的聚集组之间的静电相互作用,通过软骨实现快速和全深度渗透。这个数字已经修改了从维达达瓦米等人4。请单击此处查看此图的较大版本。
最近,短长度的阳离子肽载体(CPC)被设计为创建小型阳离子域,能够携带更大的治疗,以交付给负充电软骨4。为了有效地将药物输送到软骨,用于治疗流行的,8、9和退行性疾病,如骨关节炎(OA)10,药物的治疗浓度必须渗透到组织深处,其中大多数软骨细胞(胆囊细胞)位于组织深处。虽然有几个潜在的疾病修改药物可用,没有一个已获得FDA批准,因为这些不能有效地瞄准软骨12,13。12,因此,评估药物载体的运输特性是预测药物在诱导治疗反应方面的有效性所必需的。在这里,我们设计了三个独立的实验,可用于评估CPC4的均衡吸收率、渗透深度和非均衡扩散率。
为了确保软骨内有足够的药物浓度,可以提供最佳的治疗反应,吸收实验被设计成量化软骨4中的平衡CPC浓度。在此设计中,在软骨与其周围浴池之间的平衡之后,可以使用吸收比确定软骨内(与矩阵绑定或自由)的溶质总量。此比率的计算方法是将软骨内的溶解物浓度与平衡浴的溶解度标准化。原则上,中性溶解体,其通过软骨的扩散不由电荷相互作用辅助,其吸收比将小于1。相反,通过静电相互作用增强的阳离子溶解剂的吸收比大于1。但是,如 CPC 所示,使用最佳正电荷会导致更高的吸收比率(大于 300)4。
虽然软骨内的药物浓度高对于获得治疗效果很重要,但药物在软骨全部厚度中扩散也至关重要。因此,需要进行显示渗透深度的研究,以确保药物到达软骨深处,以便达到基质和细胞靶点,从而提供更有效的治疗。该实验旨在评估溶解液通过软骨的双向扩散,模拟药物在体内关节注射后扩散到软骨。使用共和显微镜进行荧光成像,可以评估渗透到软骨的深度。净粒子电荷在调节药物在基质中扩散的深度方面起着关键作用。需要基于组织 FCD 的最佳净电荷,以便进行阳离子颗粒和阳离子组织基质之间的弱可逆结合相互作用。这意味着任何相互作用都足够弱,使粒子可以脱离矩阵,但可逆的性质,以便它可以绑定到另一个矩阵结合位点在组织4的更深。相反,粒子的正净电荷过多会损害扩散,因为过强的基质结合会防止粒子从软骨表面区域的初始结合位点分离。这将导致生物反应不足,因为大多数目标位点位于组织11的深处。
为了进一步量化结合相互作用的强度,通过软骨分析药物扩散率是有利的。非平衡扩散研究允许比较不同溶解体之间的实时扩散速率。当药物扩散到软骨的浅层、中间和深层区域时,结合相互作用的存在可以极大地改变扩散率。当药物和软骨基质之间存在结合相互作用时,它被定义为有效的扩散性(DEFF)。在这种情况下,一旦所有结合位点被占用,药物的扩散速率由稳态扩散 (DSS ) 控制。不同溶质的DEFF 的比较决定了溶质与基质的相对结合强度。对于给定的溶质,如果 DEFF 和 DSS 在同一数量级内,则意味着在扩散过程中药物和基质之间存在最小的结合。但是,如果DEFF 大于DSS,则存在大量粒子与矩阵结合。
设计的实验单独允许通过软骨对溶质运输进行表征,但是,设计一个带最佳电检的药物载体需要包括所有结果的整体分析。电荷相互作用的弱和可逆性质控制粒子扩散率,并允许高平衡吸收和快速全深度穿透软骨。通过均衡吸收实验,应寻找通过非均衡扩散率研究可以验证的电荷相互作用能表现出高吸收的载体。然而,这些结合相互作用应该是弱和可逆的性质,以允许通过软骨的溶质全厚渗透。理想的药物载体将拥有最佳电荷,使强的结合吸收和高软骨内药物浓度,但不是太强,以阻碍全厚度扩散4。提出的实验将有助于针对药物携带者的电荷组织的设计特征。这些协议用于描述通过软骨4的C CPC运输,但是,这些协议也可以应用于各种药物和药物载体,通过软骨和其他带负电的组织。
Protocol
Representative Results
Discussion
此处描述的方法和协议对靶向带负电组织靶向药物输送领域非常重要。由于这些组织中存在带负电的聚集体高密度,因此会形成屏障,从而阻止药物到达其位于基质深处的细胞靶点。为面对这个突出的挑战,药物可进行改性,以纳入带正药的药载体,,可提高,,,药物在组织1、3、4、14、15、16、17、18、19,3,<sup class="…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
这项工作由美国国防部通过国会指导的医学研究计划(CDMRP)根据W81XWH-17-1-0085合同和国家卫生研究院R03 EB025903-1提供资金。AV由东北大学工程学院院长奖学金资助。
Materials
| 316 Stainless Steel SAE Washer | McMaster-Carr | 91950A044 | For number 5 screw size, 0.14" ID, 0.312" OD |
| 96-Well Polystyrene Plate | Fisherbrand | 12566620 | Black |
| Acrylic Thick Gauge Sheet | Reynolds Polymer | N/A | For non-equilibrium diffusion and 1-D diffusion transport chamber |
| Antibiotic-Antimycotic | Gibco | 15240062 | 100x |
| Bovine Cartilage | Research 87 | N/A | 2-3 weeks old, femoropatellar groove |
| Bovine Serum Albumin | Fisher BioReagents | BP671-1 | |
| CPC+14 | LifeTein | LT1524 | Custom designed peptide |
| CPC+20 | LifeTein | LT1525 | Custom designed peptide |
| CPC+8 | LifeTein | LT1523 | Custom designed peptide |
| Delicate Task Wipers | Kimberly-Clark Professional | 34155 | |
| Dermal Punch | MedBlades | MB5-1 | 3, 4 and 6 mm |
| Economy Plain Glass Microscope Slides | Fisherbrand | 12550A3 | |
| Flat Bottom Cell Culture Plates | Corning Costar | 3595 | Clear, 96 well |
| Flexible Wrapping Film | Bemis Parafilm M Laboratory | 1337412 | |
| Gold Seal Cover Glass | Electron Microscopy Sciences | 6378701 | # 1.5, 18×18 mm |
| Hammer-Driven Hole Punch | McMaster-Carr | 3427A15 | 1/2" Diameter |
| Hammer-Driven Hole Punch | McMaster-Carr | 3427A19 | 3/4" Diameter |
| Laser | Chroma Technology | AT480/30m | Spectrophotometer Laser Light |
| Low-Strength Steel Hex Nut | McMaster-Carr | 90480A007 | 6-32 Thread size |
| LSM 700 Confocal Microscope | Zeiss | LSM 700 | |
| Micro Magnetic Stirring Bars | Bel-Art Spinbar | F37119-0007 | 7×2 mm |
| Multipurpose Neoprene Rubber Sheet | McMaster-Carr | 1370N12 | 1/32" Thickness |
| Non-Fat Dried Bovine Milk | Sigma Aldrich | M7409 | |
| Petri Dish | Chemglass Life Sciences | CGN1802145 | 150 mm diameter |
| Phosphate-Buffered Saline | Corning | 21-040-CMR | 1x |
| Plate Shaker | VWR | 89032-088 | |
| Protease Inhibitors | Thermo Scientific | A32953 | |
| Razor Blades | Fisherbrand | 12640 | |
| R-Cast Acrylic Thin Gauge Sheet | Reynolds Polymer | N/A | Black transport chamber inserts |
| RTV Silicone | Loctite | 234323 | Epoxy, Non-corrosive, clear |
| Scalpel | TedPella | 549-3 | #10, #11 blades |
| Signal Receiver | Chroma Technology | ET515lp | Spectrophotometer Laser Signal Receiver |
| Snap-Cap Microcentrifuge Tubes | Eppendorf | 22363204 | 1.5 mL |
| Spatula | TedPella | 13508 | |
| Synergy H1 Microplate Reader | Biotek | H1M | |
| Zinc-Plated Alloy Steel Socket Head Screw | McMaster-Carr | 90128A153 | 6-32 Thread size, 1" Long |
Riferimenti
- Bajpayee, A. G., Grodzinsky, A. J. Cartilage-targeting drug delivery: can electrostatic interactions help. Nature Reviews Rheumatology. 13 (3), 183-193 (2017).
- Maroudas, A. Transport of solutes through cartilage: permeability to large molecules. Journal of Anatomy. 122, 335-347 (1976).
- Bajpayee, A. G., Wong, C. R., Bawendi, M. G., Frank, E. H., Grodzinsky, A. J. Avidin as a model for charge driven transport into cartilage and drug delivery for treating early stage post-traumatic osteoarthritis. Biomaterials. 35 (1), 538-549 (2014).
- Vedadghavami, A., et al. Cartilage penetrating cationic peptide carriers for applications in drug delivery to avascular negatively charged tissues. Acta Biomaterialia. 93, 258-269 (2019).
- Mehta, S., Akhtar, S., Porter, R. M., Önnerfjord, P., Bajpayee, A. G. Interleukin-1 receptor antagonist (IL-1Ra) is more effective in suppressing cytokine-induced catabolism in cartilage-synovium co-culture than in cartilage monoculture. Arthritis Research & Therapy. 21 (1), 238 (2019).
- Vedadghavami, A., Zhang, C., Bajpayee, A. G. Overcoming negatively charged tissue barriers: Drug delivery using cationic peptides and proteins. Nano Today. 34, 100898 (2020).
- Young, C. C., Vedadghavami, A., Bajpayee, A. G. Bioelectricity for Drug Delivery: The Promise of Cationic Therapeutics. Bioelectricity. , (2020).
- Felson, D. T. Osteoarthritis of the knee. New England Journal of Medicine. 354 (8), 841-848 (2006).
- Wieland, H. A., Michaelis, M., Kirschbaum, B. J., Rudolphi, K. A. Osteoarthritis – An untreatable disease. Nature Reviews Drug Discovery. 4 (4), 331-344 (2005).
- Martel-Pelletier, J. Pathophysiology of osteoarthritis. Osteoarthritis and Cartilage. 7 (4), 371-373 (1999).
- Sophia Fox, A. J., Bedi, A., Rodeo, S. A. The basic science of articular cartilage: Structure, composition, and function. Sports Health. 1 (6), 461-468 (2009).
- Chevalier, X., et al. Intraarticular injection of anakinra in osteoarthritis of the knee: A multicenter, randomized, double-blind, placebo-controlled study. Arthritis Care and Research. 61 (3), 344-352 (2009).
- Cohen, S. B., et al. A randomized, double-blind study of AMG 108 (a fully human monoclonal antibody to IL-1R1) in patients with osteoarthritis of the knee. Arthritis Research and Therapy. 13 (4), 125 (2011).
- Evans, C. H., Kraus, V. B., Setton, L. A. Progress in intra-articular therapy. Nature Reviews Rheumatology. 10 (1), 11-22 (2014).
- He, T., et al. Multi-arm Avidin nano-construct for intra-cartilage delivery of small molecule drugs. Journal of Controlled Release. 318, 109-123 (2020).
- Bajpayee, A. G., Scheu, M., Grodzinsky, A. J., Porter, R. M. A rabbit model demonstrates the influence of cartilage thickness on intra-articular drug delivery and retention within cartilage. Journal of Orthopaedic Research. 33 (5), 660-667 (2015).
- Bajpayee, A. G., Quadir, M. A., Hammond, P. T., Grodzinsky, A. J. Charge based intra-cartilage delivery of single dose dexamethasone using Avidin nano-carriers suppresses cytokine-induced catabolism long term. Osteoarthritis and Cartilage. 24 (1), 71-81 (2016).
- Zhang, C., et al. Avidin-biotin technology to synthesize multi-arm nano-construct for drug delivery. MethodsX. , 100882 (2020).
- Wagner, E. K., et al. Avidin grafted dextran nanostructure enables a month-long intra-discal retention. Scientific Reports. 10.1, 1-14 (2020).
- Troeberg, L., Nagase, H. Proteases involved in cartilage matrix degradation in osteoarthritis. Biochimica et Biophysica Acta – Proteins and Proteomics. 1824 (1), 133-145 (2012).
- Kirk, T. B., Wilson, A. S., Stachowiak, G. The effects of dehydration on the surface morphology of articular cartilage. Journal of Orthopaedic Rheumatology. 6 (2-3), 75-80 (1993).
- Ateshian, G. A., Maas, S., Weiss, J. A. Solute transport across a contact interface in deformable porous media. Journal of Biomechanics. 45 (6), 1023-1027 (2012).
- Arbabi, V., Pouran, B., Weinans, H., Zadpoor, A. A. Multiphasic modeling of charged solute transport across articular cartilage: Application of multi-zone finite-bath model. Journal of Biomechanics. 49 (9), 1510-1517 (2016).
- Arbabi, V., Pouran, B., Zadpoor, A. A., Weinans, H. An experimental and finite element protocol to investigate the transport of neutral and charged solutes across articular cartilage. Journal of Visualized Experiments. 2017 (122), (2017).
- Sampson, S. L., Sylvia, M., Fields, A. J. Effects of dynamic loading on solute transport through the human cartilage endplate. Journal of Biomechanics. 83, 273-279 (2019).
- Bajpayee, A. G., Scheu, M., Grodzinsky, A. J., Porter, R. M. Electrostatic interactions enable rapid penetration, enhanced uptake and retention of intra-articular injected avidin in rat knee joints. Journal of Orthopaedic Research : Official Publication of the Orthopaedic Research Society. 32 (8), 1044-1051 (2014).
- Bajpayee, A. G., et al. Sustained intra-cartilage delivery of low dose dexamethasone using a cationic carrier for treatment of post traumatic osteoarthritis. European Cells & Materials. 34, 341-364 (2017).
- Malda, J., et al. Of Mice, Men and Elephants: The Relation between Articular Cartilage Thickness and Body Mass. PLoS One. 8 (2), 57683 (2013).
- Frisbie, D. D., Cross, M. W., McIlwraith, C. W. A comparative study of articular cartilage thickness in the stifle of animal species used in human pre-clinical studies compared to articular cartilage thickness in the human knee. Veterinary and Comparative Orthopaedics and Traumatology. 19 (3), 142-146 (2006).

