Geautomatiseerde beeldvorming en analyse voor de kwantificering van fluorescerend gelabelde macropinosomen
Summary
Geautomatiseerde assays met behulp van multi-well microplaten zijn voordelige benaderingen voor het identificeren van pathway-regulatoren door de beoordeling van een groot aantal omstandigheden in één experiment mogelijk te maken. Hier hebben we het gevestigde macropinosoombeeldvormings- en kwantificeringsprotocol aangepast aan een 96-well microplaatformaat en bieden we een uitgebreid overzicht voor automatisering met behulp van een multi-mode plaatlezer.
Abstract
Macropinocytose is een niet-specifieke opnameroute in de vloeistoffase waarmee cellen grote extracellulaire lading, zoals eiwitten, pathogenen en celresten, kunnen internaliseren via bulk endocytose. Deze route speelt een essentiële rol in een verscheidenheid aan cellulaire processen, waaronder de regulatie van immuunresponsen en het metabolisme van kankercellen. Gezien dit belang in de biologische functie, kan het onderzoeken van celkweekomstandigheden waardevolle informatie opleveren door regulatoren van deze route te identificeren en omstandigheden te optimaliseren die moeten worden gebruikt bij de ontdekking van nieuwe therapeutische benaderingen. De studie beschrijft een geautomatiseerde beeldvormings- en analysetechniek met behulp van standaard laboratoriumapparatuur en een multi-mode plaatlezer voor celbeeldvorming voor de snelle kwantificering van de macropinocytische index in adherente cellen. De geautomatiseerde methode is gebaseerd op de opname van fluorescerend dextran met een hoog molecuulgewicht en kan worden toegepast op 96-well microplaten om beoordelingen van meerdere omstandigheden in één experiment of vaste monsters gemonteerd op glazen afdekplaten te vergemakkelijken. Deze aanpak is gericht op het maximaliseren van de reproduceerbaarheid en het verminderen van experimentele variatie, terwijl het zowel tijdbesparend als kosteneffectief is.
Introduction
De niet-specifieke endocytische route van macropinocytose stelt cellen in staat om een verscheidenheid aan extracellulaire componenten, waaronder voedingsstoffen, eiwitten, antigenen en pathogenen, te internaliseren door bulkopname van extracellulaire vloeistof en zijn bestanddelen1. Hoewel belangrijk voor de biologie van talrijke celtypen, wordt in toenemende mate beschreven dat de macropinocytoseroute een essentiële rol speelt in de tumorbiologie, waar tumorcellen door macropinocytische opname in staat zijn om te overleven en zich te vermenigvuldigen in de aanwezigheid van een door voedingsstoffen uitgeputte micro-omgeving2,3. De opname van extracellulaire macromoleculen, waaronder albumine en extracellulaire matrix, en necrotisch celpuin, biedt een alternatieve voedingsbron voor biomassaproductie door aminozuren, suikers, lipiden en nucleotiden te creëren door middel van macropinosoom en lysosoom fusie-gemedieerd ladingkatabolisme4,5,6,7,8.
De inductie en regulatie van macropinocytose zijn complex en kunnen variëren afhankelijk van de cellulaire context. Tot nu toe zijn verschillende inductoren van macropinocytose geïdentificeerd en omvatten liganden, zoals epidermale groeifactor (EGF), van bloedplaatjes afgeleide groeifactor (PDGF), galectine-3 en Wnt3A9,10,11,12,13. Bovendien kunnen kweekomstandigheden die de micro-omgeving van de tumor nabootsen, activering van de route veroorzaken. Pancreas ductaal adenocarcinoom (PDAC) tumoren zijn voedingsarm, vooral voor het aminozuur glutamine, waardoor zowel kankercellen als kanker-geassocieerde fibroblasten (CAFs) afhankelijk zijn van macropinocytose voor overleving7,13,14,15. Bovendien kunnen tumorspanningen, zoals hypoxie en oxidatieve stress, deze opruimroute activeren16. Naast de vele extrinsieke beïnvloeders die macropinocytose kunnen induceren, regelen verschillende intracellulaire routes de vorming van macropinosomen. Oncogene Ras-gemedieerde transformatie is voldoende om de macropinocytische machinerie te initiëren, en meerdere kankertypen vertonen oncogene Ras-gedreven constitutieve macropinocytose4,5,9,17. Als alternatief zijn rasactiverings- en Ras-onafhankelijke routes geïdentificeerd om macropinocytose in kankercellen en CAFs10,11,15,18 te activeren. Het gebruik van verschillende in vitro modellen in combinatie met inhibitorbehandelingen heeft geresulteerd in de identificatie van verschillende macropinocytosemodulatoren, waaronder natrium-waterstofwisselaars, de kleine GTPase Rac1, fosfoinositide 3-kinase (PI3K), p21-geactiveerd kinase (Pak) en AMP-geactiveerd eiwitkinase (AMPK)4,13,15 . Gezien de veelheid aan beschreven factoren en aandoeningen die macropinocytose reguleren, is het echter denkbaar dat veel meer modulatoren en stimuli onontdekt blijven. De identificatie van nieuwe modulatoren en stimuli kan worden vergemakkelijkt door geautomatiseerde beoordeling van een groot aantal omstandigheden in een enkel experiment. Deze methodologie kan licht werpen op de factoren die betrokken zijn bij de vorming van macropinosomen en kan de ontdekking van nieuwe kleine moleculen of biologische geneesmiddelen mogelijk maken die zich op deze route richten.
Hier hebben we ons eerder vastgestelde protocol voor het bepalen van de mate van macropinocytose in kankercellen in vitro aangepast naar een 96-well microplaatformaat en geautomatiseerde beeldvorming en kwantificering19,20. Dit protocol is gebaseerd op fluorescerende microscopie, die een standaard is geworden in het veld om macropinocytose in vitro en in vivo te bepalen4,5,6,7,9,10,11,12,13,15,16,17,18, 19,20,21,22. Macropinosomen kunnen worden onderscheiden van andere endocytische routes door hun vermogen om grote macromoleculen te internaliseren, zoals dextran met een hoog molecuulgewicht (d.w.z. 70 kDa)2,3,4,20,21,22,23. Macropinosomen kunnen dus worden gedefinieerd door opname van extracellulair toegediende fluorofoor-gelabelde 70 kDa dextran. Als gevolg hiervan manifesteren macropinocytische blaasjes zich als intracellulaire clusters van fluorescerende puncta met afmetingen variërend van 0,2-5 μm. Deze puncta kunnen microscopisch in beeld worden gebracht en vervolgens worden gekwantificeerd om de mate van macropinocytose in de cel te bepalen – ‘de macropinocytische index’.
In dit protocol worden de essentiële stappen beschreven om macropinosomen in aanhangende cellen in vitro te visualiseren op een 96-well microplaat en coverslips met behulp van standaard laboratoriumapparatuur (figuur 1). Daarnaast worden de aanwijzingen gegeven om de beeldacquisitie en kwantificering van de macropinocytische index te automatiseren met behulp van een multi-mode plaatlezer voor celbeeldvorming. Deze automatisering vermindert tijd, kosten en moeite in vergelijking met onze eerder beschreven protocollen19,20. Bovendien voorkomt het onbedoeld bevooroordeelde beeldvormingsacquisitie en -analyse en verbetert het daardoor de reproduceerbaarheid en betrouwbaarheid. Deze methode kan eenvoudig worden aangepast aan verschillende celtypen of plaatlezers of worden gebruikt om alternatieve macropsoomkenmerken te bepalen, zoals grootte, aantal en locatie. De hierin beschreven methode is vooral geschikt voor de screening van celkweekomstandigheden die macropinocytose induceren, de identificatie van nieuwe modulatoren of optimalisatie van medicijnconcentraties van bekende remmers.
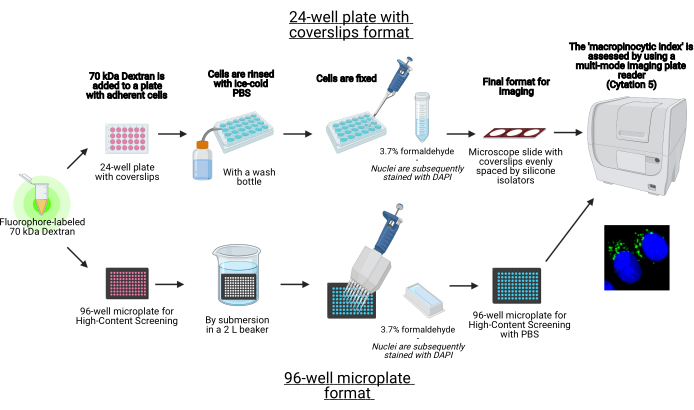
Figuur 1: Schema van de geautomatiseerde assay om de ‘macropinocytische index’ in adherente cellen te bepalen. Gemaakt met BioRender. Klik hier om een grotere versie van deze figuur te bekijken.
Protocol
Representative Results
Discussion
De kwaliteit van de experimenten en gegevensverzameling hangt sterk af van de kwaliteit van de reagentia, de optimalisatie van de instellingen en de netheid van de coverslips en microplaat. De eindresultaten moeten een minimale variatie tussen de replicaties geven; biologische variaties komen echter van nature voor of kunnen anderszins worden veroorzaakt door een aantal factoren. Celdichtheid kan ervoor zorgen dat cellen meer of minder reageren op macropinocytose-inductoren of -remmers. Het is daarom van cruciaal belang …
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Dit werk werd ondersteund door NIH /NCI-subsidies (R01CA207189, R21CA243701) aan C.C. KMO.G. is een ontvanger van een TRDRP Postdoctoral Fellowship Award (T30FT0952). De BioTek Cytation 5 maakt deel uit van de Sanford Burnham Prebys Cell Imaging Core, die financiële steun ontvangt van de NCI Cancer Center Support Grant (P30 CA030199). Figuren 1-3 zijn gemaakt met behulp van BioRender.
Materials
| 0.25% Trypsin | Corning | 25053CI | 0.1% EDTA in HBSS w/o Calcium, Magnesium and Sodium Bicarbonate |
| 1.5 mL Microcentrifuge tube | Fisherbrand | 05-408-129 | |
| 10-cm Tissue culture dish | Greiner Bio-One | 664160 | CELLSTAR |
| 15 mL Centrifuge tube | Fisherbrand | 07-200-886 | |
| 2 L Beaker | Fisherbrand | 02-591-33 | |
| 24-well Tissue culture plate | Greiner Bio-One | 662160 | CELLSTAR |
| 25 mL Reagent reservoir | Genesee Scientific Corporation | 28-121 | |
| 500 mL Beaker | Fisherbrand | 02-591-30 | |
| 6-cm Tissue culture dish | Greiner Bio-One | 628160 | CELLSTAR |
| 8-Channel aspiration adapter | Integra Biosciences | 155503 | |
| 8-Channel aspiration adapter for standard tips | Integra Biosciences | 159024 | |
| 95% Ethanol | Decon Laboratories Inc | 4355226 | |
| Ammonia-free glass cleaner | Sparkle | FUN20500CT | |
| Black 96-well high-content screening microplate | PerkinElmer | 6055300 | CellCarrier-96 Ultra |
| Cotton-tipped applicator | Fisherbrand | 23-400-101 | |
| Coverslips | Fisherbrand | 12-545-80 | 12 mm diameter |
| Cytation 5 Cell Imaging Multi-Mode Reader | Biotek | CYT5FW | |
| DAPI | Millipore Sigma | 5.08741 | |
| Dextran 70 kDa – FITC | Life Technologies | D1822 | Lysine-fixable |
| Dextran 70 kDa – TMR | Life Technologies | D1819 | |
| DMSO | Millipore Sigma | D1435 | |
| DPBS | Corning | 21031CV | Without Calcium and Magnesium |
| Forceps | Fine Science Tools | 11251-20 | Dumont #5 |
| Formaldehyde, 37% | Ricca Chemical | RSOF0010-250A | ACS Reagent Grade |
| Glycerol | Fisher BioReagents | BP229-1 | |
| Hardening fluorescence mounting media | Agilent Tech | S302380-2 | DAKO |
| Hoechst 33342 | Millipore Sigma | B2261 | |
| Hydrochloric acid (HCl) | Fisher Chemical | A144-212 | Certified ACS Plus, 36.5%–38.0% |
| Lint-free wipes | Kimberly-Clark | 34155 | Kimwipes |
| Miscroscope slides | Fisherbrand | 12-544-1 | Premium plain glass |
| Multichannel pipette | Gilson | FA10013 | 8 channels, 0.5–10 µL |
| Multichannel pipette | Gilson | FA10012 | 12 channels, 20–200 µL |
| Multichannel pipette | Gilson | FA10011 | 8 channels, 20–200 µL |
| Parafilm M | Pechiney | PM996 | |
| Plastic wrap | Kirkland Signature | 208733 | Stretch-Tite |
| Silicone isolators | Grace Bio Labs Inc | 664107 | 13 mm Diameter X 0.8 mm Depth ID, 25 mm X 25 mm |
| Slide adapter | Biotek | 1220548 | |
| Wash bottle | Fisherbrand | FB0340922C |
Riferimenti
- Lin, X. P., Mintern, J. D., Gleeson, P. A. Macropinocytosis in different cell types: similarities and differences. Membranes. 10 (8), 21 (2020).
- Recouvreux, M. V., Commisso, C. Macropinocytosis: a metabolic adaptation to nutrient stress in cancer. Frontiers in Endocrinology. 8, (2017).
- Zhang, Y. J., Commisso, C. Macropinocytosis in cancer: a complex signaling network. Trends in Cancer. 5 (6), 332-334 (2019).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497 (7451), 633-637 (2013).
- Kim, S. M., et al. PTEN deficiency and AMPK activation promote nutrient scavenging and anabolism in prostate cancer cells. Cancer Discovery. 8 (7), 866-883 (2018).
- Jayashankar, V., Edinger, A. L. Macropinocytosis confers resistance to therapies targeting cancer anabolism. Nature Communications. 11 (1), (2020).
- Kamphorst, J. J., et al. Human pancreatic cancer tumors are nutrient poor and tumor cells actively scavenge extracellular protein. Ricerca sul cancro. 75 (3), 544-553 (2015).
- Olivares, O., et al. Collagen-derived proline promotes pancreatic ductal adenocarcinoma cell survival under nutrient limited conditions. Nature Communications. 8, (2017).
- Seguin, L., et al. Galectin-3, a druggable vulnerability for KRAS-addicted cancers. Cancer Discovery. 7 (12), 1464-1479 (2017).
- Redelman-Sidi, G., et al. The canonical Wnt pathway drives macropinocytosis in cancer. Ricerca sul cancro. 78 (16), 4658-4670 (2018).
- Tejeda-Munoz, N., Albrecht, L. V., Bui, M. H., De Robertis, E. M. Wnt canonical pathway activates macropinocytosis and lysosomal degradation of extracellular proteins. Proceedings of the National Academy of Sciences of the United States of America. 116 (21), 10402-10411 (2019).
- Schmees, C., et al. Macropinocytosis of the PDGF beta-receptor promotes fibroblast transformation by H-RasG12V. Molecular Biology of the Cell. 23 (13), 2571-2582 (2012).
- Lee, S. -. W., et al. EGFR-Pak signaling selectively regulates glutamine deprivation-induced macropinocytosis. Developmental Cell. 50 (3), 381-392 (2019).
- Recouvreux, M. V., et al. Glutamine depletion regulates Slug to promote EMT and metastasis in pancreatic cancer. Journal of Experimental Medicine. 217 (9), (2020).
- Zhang, Y., et al. Macropinocytosis in cancer-associated fibroblasts is dependent on CaMKK2/ARHGEF2 signaling and functions to support tumor and stromal cell fitness. Cancer Discovery. 11 (7), 1808-1825 (2021).
- Su, H., et al. Cancer cells escape autophagy inhibition via NRF2-induced macropinocytosis. Cancer Cell. 39 (5), 678-693 (2021).
- Bar-Sagi, D., Feramisco, J. R. Induction of membrane ruffling and fluid-phase pinocytosis in quiescent fibroblasts by ras proteins. Science. 233 (4768), 1061-1068 (1986).
- Mishra, R., et al. Stromal epigenetic alterations drive metabolic and neuroendocrine prostate cancer reprogramming. Journal of Clinical Investigation. 128 (10), 4472-4484 (2018).
- Commisso, C., Flinn, R. J., Bar-Sagi, D. Determining the macropinocytic index of cells through a quantitative image-based assay. Nature Protocols. 9 (1), 182-192 (2014).
- Galenkamp, K. M. O., Alas, B., Commisso, C. Quantitation of macropinocytosis in cancer cells. Methods in Molecular Biology. 1928, 113-123 (2019).
- Wang, J. T. H., Teasdale, R. D., Liebl, D. Macropinosome quantitation assay. MethodsX. 1, 36-41 (2014).
- Lee, S. -. W., Alas, B., Commisso, C. Detection and quantification of macropinosomes in pancreatic tumors. Methods in Molecular Biology. 1882, 171-181 (2019).
- Williams, T., Kay, R. R. High-throughput measurement of dictyostelium discoideum macropinocytosis by flow cytometry. Journal of Visualized Experiments: JoVE. (139), e58434 (2018).

