Automatisierte Bildgebung und Analyse zur Quantifizierung fluoreszenzmarkierter Makropinosomen
Summary
Automatisierte Assays mit Multi-Well-Mikroplatten sind vorteilhafte Ansätze zur Identifizierung von Signalwegregulatoren, indem sie die Bewertung einer Vielzahl von Bedingungen in einem einzigen Experiment ermöglichen. Hier haben wir das etablierte Makropinosomen-Bildgebungs- und Quantifizierungsprotokoll an ein 96-Well-Mikroplattenformat angepasst und bieten einen umfassenden Überblick über die Automatisierung mit einem Multimode-Plattenleser.
Abstract
Makropinozytose ist ein unspezifischer Flüssigkeitsphasenaufnahmeweg, der es Zellen ermöglicht, große extrazelluläre Fracht wie Proteine, Krankheitserreger und Zelltrümmer durch Bulk-Endozytose zu internalisieren. Dieser Signalweg spielt eine wesentliche Rolle bei einer Vielzahl von zellulären Prozessen, einschließlich der Regulierung von Immunantworten und des Stoffwechsels von Krebszellen. Angesichts dieser Bedeutung für die biologische Funktion kann die Untersuchung der Zellkulturbedingungen wertvolle Informationen liefern, indem Regulatoren dieses Signalwegs identifiziert und die Bedingungen für die Entdeckung neuartiger therapeutischer Ansätze optimiert werden. Die Studie beschreibt eine automatisierte Bildgebungs- und Analysetechnik unter Verwendung von Standardlaborgeräten und einem zellbildenden Multimode-Plattenleser zur schnellen Quantifizierung des makropinozytären Index in adhärenten Zellen. Die automatisierte Methode basiert auf der Aufnahme von hochmolekularem fluoreszierendem Dextran und kann auf 96-Well-Mikrotiterplatten angewendet werden, um die Beurteilung mehrerer Bedingungen in einem Experiment oder fester Proben auf Glasdeckgläsern zu erleichtern. Dieser Ansatz zielt darauf ab, die Reproduzierbarkeit zu maximieren und die experimentelle Variation zu reduzieren, während er gleichzeitig zeitsparend und kostengünstig ist.
Introduction
Der unspezifische endozytäre Weg der Makropinozytose ermöglicht es Zellen, eine Vielzahl von extrazellulären Komponenten, einschließlich Nährstoffen, Proteinen, Antigenen und Krankheitserregern, durch Massenaufnahme von extrazellulärer Flüssigkeit und ihren Bestandteilen zu internalisieren1. Obwohl wichtig für die Biologie zahlreicher Zelltypen, wird zunehmend beschrieben, dass der Makropinozytoseweg eine wesentliche Rolle in der Tumorbiologie spielt, wo Tumorzellen durch makropinozytäre Aufnahme in der Lage sind, in Gegenwart einer nährstoffarmen Mikroumgebung zu überleben und sich zu vermehren2,3. Die Aufnahme extrazellulärer Makromoleküle, einschließlich Albumin und extrazellulärer Matrix, sowie nekrotischer Zelltrümmer bietet eine alternative Nährstoffquelle für die Biomasseproduktion, indem Aminosäuren, Zucker, Lipide und Nukleotide durch Makropinosomen- und Lysosomenfusions-vermittelte Frachtkatabolismus erzeugt werden4,5,6,7,8.
Die Induktion und Regulation der Makropinozytose ist komplex und kann je nach zellulärem Kontext variieren. Bisher wurden mehrere Induktoren der Makropinozytose identifiziert und umfassen Liganden wie den epidermalen Wachstumsfaktor (EGF), den von Thrombozyten abgeleiteten Wachstumsfaktor (PDGF), Galectin-3 und Wnt3A9,10,11,12,13. Darüber hinaus können Kultivierungsbedingungen, die die Tumormikroumgebung nachahmen, die Aktivierung des Signalwegs auslösen. Tumoren des duktalen Adenokarzinoms (PDAC) der Bauchspeicheldrüse sind nährstoffarm, insbesondere für die Aminosäure Glutamin, die dazu führt, dass sowohl Krebszellen als auch krebsassoziierte Fibroblasten (CAFs) auf Makropinozytose angewiesen sind7,13,14,15. Darüber hinaus können Tumorbelastungen wie Hypoxie und oxidativer Stress diesen Fressweg aktivieren16. Zusätzlich zu den zahlreichen extrinsischen Einflussfaktoren, die Makropinozytose induzieren können, steuern eine Vielzahl von intrazellulären Signalwegen die Bildung von Makropinosomen. Die onkogene Ras-vermittelte Transformation reicht aus, um die makropinozytische Maschinerie zu initiieren, und mehrere Krebsarten weisen eine onkogene Ras-gesteuerte konstitutive Makropinozytose auf4,5,9,17. Alternativ wurden Wildtyp-Ras-Aktivierung und Ras-unabhängige Signalwege identifiziert, um makropinozytose in Krebszellen und CAFs zu aktivieren10,11,15,18. Die Verwendung verschiedener In-vitro-Modelle in Kombination mit Inhibitorbehandlungen hat zur Identifizierung mehrerer Makropinozytosemodulatoren geführt, darunter Natrium-Wasserstoff-Austauscher, die kleine GTPase Rac1, die Phosphoinositid-3-Kinase (PI3K), die p21-aktivierte Kinase (Pak) und die AMP-aktivierte Proteinkinase (AMPK)4,13,15 . Angesichts der Vielzahl der beschriebenen Faktoren und Bedingungen, die die Makropinozytose regulieren, ist es jedoch denkbar, dass noch viel mehr Modulatoren und Reize unentdeckt bleiben. Die Identifizierung neuartiger Modulatoren und Stimuli kann durch die automatisierte Bewertung einer Vielzahl von Bedingungen in einem einzigen Experiment erleichtert werden. Diese Methodik kann Aufschluss über die Faktoren geben, die an der Bildung von Makropinosomen beteiligt sind, und kann die Entdeckung neuartiger kleiner Moleküle oder Biologika ermöglichen, die auf diesen Signalweg abzielen.
Hier haben wir unser bisher etabliertes Protokoll zur Bestimmung des Ausmaßes der Makropinozytose in Krebszellen in vitro auf ein 96-Well-Mikroplattenformat und automatisierte Bildgebung und Quantifizierung angepasst19,20. Dieses Protokoll basiert auf der Fluoreszenzmikroskopie, die zu einem Standard auf dem Gebiet der Bestimmung der Makropinozytose in vitro und in vivo geworden ist4,5,6,7,9,10,11,12,13,15,16,17,18, 19,20,21,22. Makropinosomen können von anderen endozytären Signalwegen durch ihre Fähigkeit unterschieden werden, große Makromoleküle wie hochmolekulares Dextran (d.h. 70 kDa)2,3,4,20,21,22,23 zu internalisieren. Somit können Makropinosomen durch aufnahme von extrazellulär verabreichtem Fluorophor-markiertem 70 kDa Dextran definiert werden. Infolgedessen manifestieren sich makropinozytäre Vesikel als intrazelluläre Cluster fluoreszierender Punktika mit Größen von 0,2-5 μm. Diese Puncta können mikroskopisch abgebildet und anschließend quantifiziert werden, um das Ausmaß der Makropinozytose in der Zelle – den “makropinozytären Index” – zu bestimmen.
In diesem Protokoll werden die wesentlichen Schritte zur Visualisierung von Makropinosomen in adhärenten Zellen in vitro auf einer 96-Well-Mikroplatte und Deckgläsern mit Standardlaborgeräten beschrieben (Abbildung 1). Darüber hinaus werden die Anweisungen zur Automatisierung der Bildaufnahme und Quantifizierung des makropinozytären Index mit einem cell imaging Multimode-Plattenleser bereitgestellt. Diese Automatisierung reduziert Zeit, Kosten und Aufwand im Vergleich zu unseren zuvor beschriebenen Protokollen19,20. Darüber hinaus vermeidet es eine unbeabsichtigt verzerrte Bilderfassung und -analyse und erhöht dadurch die Reproduzierbarkeit und Zuverlässigkeit. Diese Methode kann leicht an verschiedene Zelltypen oder Plattenleser angepasst oder zur Bestimmung alternativer Makropinosomenmerkmale wie Größe, Anzahl und Position verwendet werden. Das hierin beschriebene Verfahren eignet sich insbesondere für das Screening von Zellkulturbedingungen, die makropinozytose induzieren, die Identifizierung neuartiger Modulatoren oder die Optimierung von Wirkstoffkonzentrationen bekannter Inhibitoren.
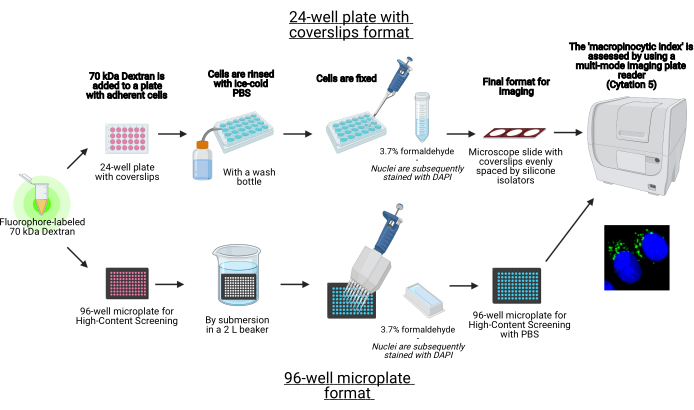
Abbildung 1: Schematische Darstellung des automatisierten Assays zur Bestimmung des “makropinozytären Index” in adhärenten Zellen. Erstellt mit BioRender. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Protocol
Representative Results
Discussion
Die Qualität der Experimente und der Datenerfassung hängt stark von der Qualität der Reagenzien, der Optimierung der Einstellungen und der Sauberkeit der Deckgläser und der Mikrotiterplatte ab. Die Endergebnisse sollten eine minimale Variation zwischen den Replikaten ergeben; Biologische Variationen kommen jedoch natürlich vor oder können anderweitig durch eine Reihe von Faktoren verursacht werden. Die Zelldichte kann dazu führen, dass Zellen mehr oder weniger auf Makropinozytose-Induktoren oder -inhibitoren reagi…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Diese Arbeit wurde durch NIH/NCI-Zuschüsse (R01CA207189, R21CA243701) an C.C unterstützt. KMO.G. erhielt einen TRDRP Postdoctoral Fellowship Award (T30FT0952). Der BioTek Cytation 5 ist Teil des Sanford Burnham Prebys Cell Imaging Core, der finanzielle Unterstützung aus dem NCI Cancer Center Support Grant (P30 CA030199) erhält. Die Abbildungen 1-3 wurden mit BioRender erstellt.
Materials
| 0.25% Trypsin | Corning | 25053CI | 0.1% EDTA in HBSS w/o Calcium, Magnesium and Sodium Bicarbonate |
| 1.5 mL Microcentrifuge tube | Fisherbrand | 05-408-129 | |
| 10-cm Tissue culture dish | Greiner Bio-One | 664160 | CELLSTAR |
| 15 mL Centrifuge tube | Fisherbrand | 07-200-886 | |
| 2 L Beaker | Fisherbrand | 02-591-33 | |
| 24-well Tissue culture plate | Greiner Bio-One | 662160 | CELLSTAR |
| 25 mL Reagent reservoir | Genesee Scientific Corporation | 28-121 | |
| 500 mL Beaker | Fisherbrand | 02-591-30 | |
| 6-cm Tissue culture dish | Greiner Bio-One | 628160 | CELLSTAR |
| 8-Channel aspiration adapter | Integra Biosciences | 155503 | |
| 8-Channel aspiration adapter for standard tips | Integra Biosciences | 159024 | |
| 95% Ethanol | Decon Laboratories Inc | 4355226 | |
| Ammonia-free glass cleaner | Sparkle | FUN20500CT | |
| Black 96-well high-content screening microplate | PerkinElmer | 6055300 | CellCarrier-96 Ultra |
| Cotton-tipped applicator | Fisherbrand | 23-400-101 | |
| Coverslips | Fisherbrand | 12-545-80 | 12 mm diameter |
| Cytation 5 Cell Imaging Multi-Mode Reader | Biotek | CYT5FW | |
| DAPI | Millipore Sigma | 5.08741 | |
| Dextran 70 kDa – FITC | Life Technologies | D1822 | Lysine-fixable |
| Dextran 70 kDa – TMR | Life Technologies | D1819 | |
| DMSO | Millipore Sigma | D1435 | |
| DPBS | Corning | 21031CV | Without Calcium and Magnesium |
| Forceps | Fine Science Tools | 11251-20 | Dumont #5 |
| Formaldehyde, 37% | Ricca Chemical | RSOF0010-250A | ACS Reagent Grade |
| Glycerol | Fisher BioReagents | BP229-1 | |
| Hardening fluorescence mounting media | Agilent Tech | S302380-2 | DAKO |
| Hoechst 33342 | Millipore Sigma | B2261 | |
| Hydrochloric acid (HCl) | Fisher Chemical | A144-212 | Certified ACS Plus, 36.5%–38.0% |
| Lint-free wipes | Kimberly-Clark | 34155 | Kimwipes |
| Miscroscope slides | Fisherbrand | 12-544-1 | Premium plain glass |
| Multichannel pipette | Gilson | FA10013 | 8 channels, 0.5–10 µL |
| Multichannel pipette | Gilson | FA10012 | 12 channels, 20–200 µL |
| Multichannel pipette | Gilson | FA10011 | 8 channels, 20–200 µL |
| Parafilm M | Pechiney | PM996 | |
| Plastic wrap | Kirkland Signature | 208733 | Stretch-Tite |
| Silicone isolators | Grace Bio Labs Inc | 664107 | 13 mm Diameter X 0.8 mm Depth ID, 25 mm X 25 mm |
| Slide adapter | Biotek | 1220548 | |
| Wash bottle | Fisherbrand | FB0340922C |
Riferimenti
- Lin, X. P., Mintern, J. D., Gleeson, P. A. Macropinocytosis in different cell types: similarities and differences. Membranes. 10 (8), 21 (2020).
- Recouvreux, M. V., Commisso, C. Macropinocytosis: a metabolic adaptation to nutrient stress in cancer. Frontiers in Endocrinology. 8, (2017).
- Zhang, Y. J., Commisso, C. Macropinocytosis in cancer: a complex signaling network. Trends in Cancer. 5 (6), 332-334 (2019).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497 (7451), 633-637 (2013).
- Kim, S. M., et al. PTEN deficiency and AMPK activation promote nutrient scavenging and anabolism in prostate cancer cells. Cancer Discovery. 8 (7), 866-883 (2018).
- Jayashankar, V., Edinger, A. L. Macropinocytosis confers resistance to therapies targeting cancer anabolism. Nature Communications. 11 (1), (2020).
- Kamphorst, J. J., et al. Human pancreatic cancer tumors are nutrient poor and tumor cells actively scavenge extracellular protein. Ricerca sul cancro. 75 (3), 544-553 (2015).
- Olivares, O., et al. Collagen-derived proline promotes pancreatic ductal adenocarcinoma cell survival under nutrient limited conditions. Nature Communications. 8, (2017).
- Seguin, L., et al. Galectin-3, a druggable vulnerability for KRAS-addicted cancers. Cancer Discovery. 7 (12), 1464-1479 (2017).
- Redelman-Sidi, G., et al. The canonical Wnt pathway drives macropinocytosis in cancer. Ricerca sul cancro. 78 (16), 4658-4670 (2018).
- Tejeda-Munoz, N., Albrecht, L. V., Bui, M. H., De Robertis, E. M. Wnt canonical pathway activates macropinocytosis and lysosomal degradation of extracellular proteins. Proceedings of the National Academy of Sciences of the United States of America. 116 (21), 10402-10411 (2019).
- Schmees, C., et al. Macropinocytosis of the PDGF beta-receptor promotes fibroblast transformation by H-RasG12V. Molecular Biology of the Cell. 23 (13), 2571-2582 (2012).
- Lee, S. -. W., et al. EGFR-Pak signaling selectively regulates glutamine deprivation-induced macropinocytosis. Developmental Cell. 50 (3), 381-392 (2019).
- Recouvreux, M. V., et al. Glutamine depletion regulates Slug to promote EMT and metastasis in pancreatic cancer. Journal of Experimental Medicine. 217 (9), (2020).
- Zhang, Y., et al. Macropinocytosis in cancer-associated fibroblasts is dependent on CaMKK2/ARHGEF2 signaling and functions to support tumor and stromal cell fitness. Cancer Discovery. 11 (7), 1808-1825 (2021).
- Su, H., et al. Cancer cells escape autophagy inhibition via NRF2-induced macropinocytosis. Cancer Cell. 39 (5), 678-693 (2021).
- Bar-Sagi, D., Feramisco, J. R. Induction of membrane ruffling and fluid-phase pinocytosis in quiescent fibroblasts by ras proteins. Science. 233 (4768), 1061-1068 (1986).
- Mishra, R., et al. Stromal epigenetic alterations drive metabolic and neuroendocrine prostate cancer reprogramming. Journal of Clinical Investigation. 128 (10), 4472-4484 (2018).
- Commisso, C., Flinn, R. J., Bar-Sagi, D. Determining the macropinocytic index of cells through a quantitative image-based assay. Nature Protocols. 9 (1), 182-192 (2014).
- Galenkamp, K. M. O., Alas, B., Commisso, C. Quantitation of macropinocytosis in cancer cells. Methods in Molecular Biology. 1928, 113-123 (2019).
- Wang, J. T. H., Teasdale, R. D., Liebl, D. Macropinosome quantitation assay. MethodsX. 1, 36-41 (2014).
- Lee, S. -. W., Alas, B., Commisso, C. Detection and quantification of macropinosomes in pancreatic tumors. Methods in Molecular Biology. 1882, 171-181 (2019).
- Williams, T., Kay, R. R. High-throughput measurement of dictyostelium discoideum macropinocytosis by flow cytometry. Journal of Visualized Experiments: JoVE. (139), e58434 (2018).

