Misurare l'evoluzione temporale di materiali su scala nanometrica con scattering neutronico a flusso interrotto e a piccolo angolo
Summary
Questo protocollo presenta l’uso di un ambiente di campionamento a flusso interrotto per miscelare rapidamente più soluzioni liquide in situ durante una misura di scattering neutronico a piccolo angolo e per studiare i processi cinetici su scale di lunghezza nanometrica e seconde scale temporali.
Abstract
Questo articolo presenta l’uso di un ambiente di campionamento SANS (small-angle neutron-scattering) a flusso interrotto per miscelare rapidamente campioni liquidi e studiare processi cinetici su scala nanometrica su scale temporali da secondi a minuti. L’ambiente di campionamento a flusso interrotto utilizza pompe a siringa disponibili in commercio per miscelare i volumi desiderati di campioni liquidi che vengono quindi iniettati attraverso un miscelatore dinamico in una cella di vetro al quarzo in circa 1 s. L’acquisizione dei dati SANS risolta nel tempo viene sincronizzata con la miscelazione del campione per seguire l’evoluzione della nanostruttura in soluzione dopo la miscelazione.
Per utilizzare al meglio il tempo del fascio di neutroni, utilizziamo una serie di valvole selettrici di flusso per caricare, risciacquare e asciugare automaticamente la cella tra una misurazione e l’altra, consentendo la raccolta ripetuta dei dati durante più iniezioni di campioni. Le iniezioni di campioni vengono ripetute fino a quando non vengono raccolte sufficienti statistiche di diffusione dei neutroni. La configurazione di miscelazione può essere programmata per variare sistematicamente le condizioni per misurare la cinetica a diversi rapporti di miscelazione, concentrazioni di campione, concentrazioni di additivi e temperature. Il volume minimo di campione richiesto per iniezione è di circa 150 μL a seconda della lunghezza del percorso della cella al quarzo.
I risultati rappresentativi utilizzando questo ambiente campione a flusso interrotto sono presentati per una rapida cinetica di scambio lipidico in presenza di un additivo, la ciclodestrina. Le vescicole si scambiano lipidi esterni (esterni) nell’ordine di secondi e scambiano completamente i lipidi interni ed esterni in poche ore. La misurazione della cinetica dello scambio lipidico richiede una miscelazione in situ per catturare i processi più veloci (secondi) e più lenti (minuti) ed estrarre le costanti di velocità cinetica. Lo stesso ambiente di campionamento può anche essere utilizzato per sondare lo scambio molecolare in altri tipi di campioni liquidi come nanoparticelle lipidiche, proteine, tensioattivi, polimeri, emulsioni o nanoparticelle inorganiche. Misurare le trasformazioni strutturali su scala nanometrica e la cinetica dei sistemi di scambio o reazione fornirà nuove informazioni sui processi che si evolvono su scala nanometrica.
Introduction
Lo scattering neutronico a piccolo angolo (SANS) fornisce un modo unico per misurare le dimensioni, le forme, le interazioni e l’organizzazione di vari materiali su scale di lunghezza da ≈1 nm a ≈100 nm 1,2,3. Strumenti recenti, tra cui gli strumenti VSANS (Very small-angle neutron scattering) con specchi di messa a fuoco, spingono i limiti verso la misurazione di scale di lunghezza ancora più grandi fino a ≈1000 nm 4,5. In generale, il contrasto di scattering unico inerente ai metodi di scattering neutronico offre diversi vantaggi nella misurazione dell’evoluzione temporale delle strutture su scala nanometrica, come l’aggregazione di componenti nelle formulazioni farmaceutiche6, le reazioni di reticolazione e gelificazione nei sistemi polimerici7,8, nella meso cristallizzazione delle proteine di membrana9,10, la degradazione e lo spiegamento delle proteine11,12 e crescita di materiali a base di silice13,14,15. L’esclusivo contrasto di dispersione rende SANS (TR-SANS) risolto nel tempo un utile complemento ad altre misurazioni basate sul flusso interrotto.
I metodi di miscelazione a flusso interrotto sono spesso implementati nello scattering di raggi X a piccolo angolo (SAXS)16,17,18,19,20,21, nella spettroscopia di fluorescenza 22,23,24,25,26 e nella diffusione della luce27,28,29,30, 31,32 esperimenti per studiare i processi cinetici su scale temporali al millisecondo. Un’importante differenza tra SANS e SAXS è che lo scattering neutronico è una tecnica di caratterizzazione non distruttiva e, come tale, SANS può essere utilizzato per misurare lo stesso campione per ore o addirittura giorni senza danni da radiazioni ionizzanti al campione, che possono verificarsi durante esperimenti di diffusione dei raggi X ad alto flusso33. Poiché le misurazioni SANS ripetute non alterano la struttura chimica della molecola o del campione della sonda, l’evoluzione temporale può essere studiata senza effetti del fotosbiancamento, ad esempio, che può complicare le misurazioni cinetiche che si basano sulla fluorescenza23,24. Inoltre, SANS può essere utilizzato per misurare campioni altamente concentrati e otticamente opachi che sono spesso difficili da caratterizzare con tecniche basate sulla luce come la diffusione dinamica della luce.
Oltre a fornire informazioni strutturali su scala nanometrica, SANS può essere utilizzato per sondare la composizione locale di queste strutture attraverso la variazione del contrasto della densità della lunghezza di diffusione dei neutroni. La densità della lunghezza di scattering (SLD) di diversi elementi varia casualmente attraverso la tavola periodica e varia con diversi isotopi dello stesso elemento. Un esempio comunemente sfruttato è l’idrogeno (1H o H) e il deuterio (2H o D), che hanno lunghezze di scattering neutronico molto diverse. Pertanto, i materiali ricchi di idrogeno, come tensioattivi, lipidi, proteine, RNA, DNA e altri polimeri, possono essere distinti dai solventi deuterati utilizzando SANS senza modificare significativamente le proprietà fisiche del sistema. Tuttavia, è importante notare che lo scambio H/D può influenzare la densità, il legame idrogeno e le temperature di transizione di fase nel campione. Tuttavia, la sensibilità unica di SANS ai materiali ricchi di idrogeno è particolarmente utile nella ricerca sulla materia soffice in cui i campioni di interesse hanno un contrasto di diffusione e un segnale inferiori nelle tecniche basate sui raggi X come SAXS. La sostituzione isotopica rende anche SANS un potente strumento per studiare la cinetica di scambio molecolare in materiali ricchi di idrogeno semplicemente mescolando molecole marcate H e D. La sostituzione isotopica è particolarmente utile nei sistemi in cui i coloranti fluorescenti voluminosi sono più grandi delle molecole tensioattive o lipidiche di interesse e possono influenzare la cinetica di scambio34,35.
Le misurazioni SANS risolte nel tempo sono vantaggiose perché l’intensità misurata è una funzione del tempo, della scala di lunghezza e del contrasto SLD. Come tale, gli esperimenti TR-SANS possono essere progettati per sondare i cambiamenti dipendenti dal tempo nelle distribuzioni spaziali e nelle composizioni dei campioni. Questi vantaggi unici di SANS hanno portato a importanti informazioni sui processi cinetici in molti sistemi di materiali morbidi come tensioattivi 36,37,38, emulsioni 39,40,41, lipidi 34,42,43,44,45,46,47,48,49 ,50, e polimeri 51,52,53,54,55,56,57,58,59,60,61,62. La maggior parte degli studi TR-SANS si sono concentrati su scale temporali da minuti a ore. Tuttavia, molti processi cinetici di interesse si verificano sulla seconda scala temporale e sono essenziali per comprendere i meccanismi sottostanti. L’acquisizione di questi primi punti temporali richiede che le soluzioni siano rapidamente miscelate e misurate in situ, in cui la miscelazione è sincronizzata con la raccolta dei dati durante la diffusione della luce a flusso interrotto 27,28,29,30,31,32, fluorescenza 22,23,24,25,26 e raggi X 16,17,18,19,20,21 esperimenti. Questo lavoro descrive l’uso di un ambiente di campionamento progettato per miscelare rapidamente più campioni liquidi e iniettare la miscela in una cella di vetro al quarzo per le misurazioni TR-SANS. Il dispositivo di miscelazione è un adattamento del dispositivo reoSANS capillare63 recentemente sviluppato e utilizza più pompe e valvole a siringa per controllare la miscelazione del campione e automatizzare la pulizia delle celle. Collegando le pompe a siringa a una serie di valvole selettrici di flusso, è possibile miscelare, misurare, risciacquare e asciugare ripetutamente più flussi di ingresso per facilitare le misurazioni TR-SANS sulla scala dei secondi.
La procedura attuale presuppone che i campioni di interesse siano stati identificati e preparati. Ci concentriamo sulla configurazione di miscelazione in situ e sui metodi per raccogliere i dati TR-SANS. I dati di diffusione dei neutroni sono stati raccolti sullo strumento VSANS presso il NIST Center for Neutron Research (NCNR); tuttavia, la procedura dovrebbe essere applicabile ad altri strumenti SANS. I lettori interessati a implementare protocolli simili su altri strumenti SANS dovrebbero consultare gli scienziati locali per determinare la configurazione ottimale dello strumento per massimizzare il flusso di neutroni alla scala di lunghezza desiderata e alla scala temporale più rilevante per i processi cinetici di interesse. I dati qui presentati sono stati raccolti utilizzando la configurazione ad alto flusso “white beam” su VSANS per massimizzare il conteggio dei neutroni alla perdita di risoluzione spaziale5. I carrelli del rivelatore sono stati posizionati per coprire una gamma di vettori di scattering (q), 0,005 Å-1 < q < 0,5 Å-1, corrispondenti a scale di lunghezza da ≈130 nm a ≈13 nm. Il vettore di scattering è definito come q = 4π/λ sin (θ/2) in cui λ è la lunghezza d’onda del neutrone e θ è l’angolo di scattering.
Il dispositivo di miscelazione a flusso interrotto utilizzato per le misurazioni TR-SANS è costituito da più pompe, siringhe di risciacquo, siringhe per campioni, selettori di flusso, nonché un miscelatore dinamico, una cella di campionamento e un contenitore di campioni misti, come mostrato nella Figura 1. Tutti i percorsi sigillati dei fluidi si trovano all’interno di un involucro climatizzato, che include siringhe, valvole, tubi di collegamento, miscelatore dinamico e celle di campionamento. Un condizionatore d’aria termoelettrico programmabile viene utilizzato per controllare la temperatura dell’involucro nell’intervallo da 10 °C a 50 °C entro ±1 °C. Si noti che parte dell’isolamento della custodia è stato rimosso per mostrare le parti funzionanti del dispositivo. L’involucro principale del dispositivo di miscelazione è posizionato su uno stadio traslazionale sulla linea del fascio NG3 VSANS presso l’NCNR. La posizione dell’involucro viene regolata utilizzando lo stadio di traslazione per posizionare la cella campione nel percorso del fascio di neutroni (linea tratteggiata gialla).

Figura 1: Una configurazione di esempio per combinare la miscelazione a flusso interrotto e le misure di scattering neutronico a piccolo angolo sulla linea di fascio VSANS presso il NIST Center for Neutron Research. La configurazione contiene quattro pompe a siringa, due siringhe per il risciacquo con solvente e due siringhe per l’iniezione del campione, quattro valvole selettrici per pompe, due valvole di selezione del miscelatore, un miscelatore dinamico, una cella al quarzo a flusso continuo e un contenitore di campioni misti. I neutroni incidenti si disperdono dal campione misto situato all’interno della cellula campione. Un involucro isolato con finestre al quarzo e un’unità termoelettrica climatizzata viene utilizzata per controllare il campione e tutte le apparecchiature a temperatura costante. La linea tratteggiata gialla mostra il percorso del fascio di neutroni. Barra scala = 10 cm. Fare clic qui per visualizzare una versione più grande di questa figura.
Il dispositivo illustrato nella Figura 1 è configurato con due siringhe campione, due siringhe di risciacquo e una cella campione. I diagrammi di flusso corrispondenti per le diverse fasi del protocollo sono illustrati nella Figura 2. I volumi desiderati dei due diversi campioni vengono iniettati nel miscelatore e nella cella campione (Figura 2A). Una volta riempita la cella di campionamento, la valvola dell’interruttore di ingresso (ISV) e la valvola dell’interruttore di uscita (OSV) vengono chiuse per isolare la cella del campione dal miscelatore dinamico e per impedire la diffusione del campione nella cella durante la raccolta dei dati TR-SANS (Figura 2B). Prima del miscelatore dinamico, il tubo di collegamento varia in lunghezza da 10 cm a 1 m e non influisce sul tempo di ritardo della miscelazione. Tuttavia, i collegamenti dei tubi tra il miscelatore dinamico e la cella di campionamento influiscono sul tempo di ritardo della miscelazione e sul volume di iniezione del campione richiesto. I tubi in acciaio inossidabile pretagliati con diametro interno di 0,04 pollici (1 mm) e lunghezza di 100 mm vengono utilizzati per collegare il miscelatore dinamico, le valvole di selezione del miscelatore (MSV1 e MSV2), ISV e OSV. I tubi fluorurati con diametro interno di 1 mm e lunghezza di 115 mm vengono utilizzati per collegare l’ISV e l’OSV (o l’uscita del miscelatore dinamico) alla cella di campionamento. Il volume totale di vuoto che influenza il tempo di ritardo di miscelazione include il volume di vuoto del miscelatore (0,15 ml), il tubo tra l’uscita del miscelatore e l’ingresso della cella del campione (0,09 ml) e il volume della cella del campione (0,16 ml). In questo esempio, il volume totale del vuoto è 0,4 ml. I volumi di vuoto interno delle valvole sono trascurabili rispetto ai volumi di vuoto di tubi, miscelatori e celle di campionamento. Ad esempio, le valvole selettrici a bassa pressione impiegate (diametro del foro 0,75 mm) contengono volumi di vuoto approssimativi di 4 μL, mentre le valvole selettrici e le valvole di commutazione ad alta pressione (diametro del foro 0,25 mm) contengono volumi vuoti approssimativi di 0,5 μL.
Al termine della misurazione TR-SANS, il campione viene spinto fuori dalla cella con solvente e il solvente di risciacquo viene ripetutamente pompato attraverso la cella per rimuovere il campione residuo e pulire la cella del campione (Figura 2C). Si noti che le siringhe di risciacquo sono collegate a serbatoi di solventi più grandi (ad esempio, acqua ed etanolo) tramite valori di selezione della pompa per garantire che siano disponibili volumi di solvente adeguati per pulire la cella di campionamento tra una corsa e l’altra. Le fonti di solventi, le fonti di campionamento e i contenitori di campioni misti che contengono liquidi infiammabili sono posizionati in un involucro separato senza apparecchiature elettriche per eliminare tutte le possibili fonti di accensione. Inoltre, vengono utilizzati tappi di bottiglia con bloccaggio del vapore per ridurre al minimo i vapori infiammabili e l’evaporazione del solvente. Infine, la cella del campione viene essiccata con un flusso di azoto gassoso per rimuovere il solvente di risciacquo residuo (Figura 2D). La pressione del gas di azoto in ingresso alla valvola selettiva del miscelatore è regolata a circa 2 bar (0,2 MPa, pressione manometrica) utilizzando un regolatore di pressione manuale situato sulla bombola del gas di azoto. Una volta che la cella del campione è sufficientemente pulita ed essiccata, un campione appena miscelato viene iniettato nella cella campione per il successivo ciclo di misurazione (ripetendo la miscelazione e l’iniezione illustrate nel diagramma di flusso nella figura 2A).
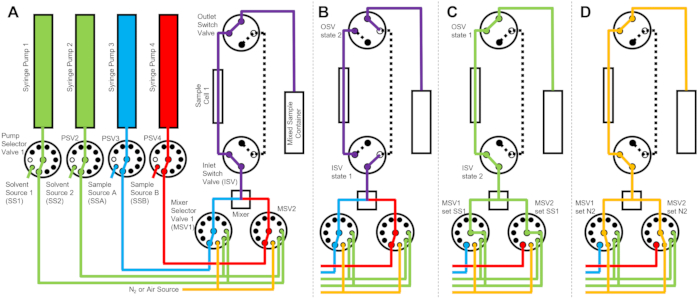
Figura 2: Diagramma di flusso di esempio utilizzando una cella campione, due campioni di miscelazione e due solventi di risciacquo per la pulizia . (A) Miscelazione del campione A (blu) e del campione B (rosso) e quindi flusso del campione misto (viola) nella cella del campione. (B) Durante la raccolta dei dati, lo stato del dispositivo a flusso interrotto in cui le valvole di commutazione ISV e OSV sono chiuse per isolare la cella del campione e impedire la retrodiffusione del campione durante la raccolta dei dati. (C) Le fasi di pulizia in cui la cella campione viene risciacquata con solvente di risciacquo da SS1 (verde) dopo la raccolta dei dati. (D) Fase di essiccazione in cui la cella campione viene essiccata con azoto gassoso (arancione). Abbreviazioni: PSV = valvola selettrice pompa; MSV = valvola selettrice miscelatrice; OSV = valvola interruttore di uscita; ISV = valvola interruttore di ingresso; SS1 = fonte di solvente 1; SSA = fonte di campionamento A; N2 = fonte di azoto gassoso. Fare clic qui per visualizzare una versione ingrandita di questa figura.
La Figura 3 mostra i diagrammi di flusso per una versione leggermente diversa in cui la configurazione di miscelazione è configurata con due celle di campionamento separate collegate alle stesse valvole di commutazione (Figura 3A). Mentre i dati TR-SANS vengono raccolti nella cella campione 1, la cella campione 2 viene risciacquata (Figura 3B) e asciugata (Figura 3C). Quando la raccolta dei dati è completa per la cella campione 1, la valvola dell’interruttore di ingresso indirizza un campione appena miscelato nella cella campione 2 per la raccolta dei dati (Figura 3D). Mentre i dati TR-SANS vengono raccolti nella cella campione 2, la cella campione 1 viene risciacquata e asciugata (Figura 3E). Questo processo parallelo e alternato tra due celle campione riduce al minimo il tempo tra le successive iniezioni di campioni e massimizza l’uso del tempo del fascio di neutroni.
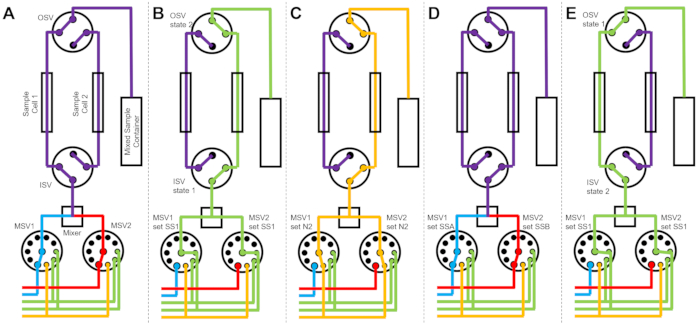
Figura 3: Diagramma di flusso di esempio utilizzando due celle a campione, due campioni che si mescolano e due solventi di risciacquo per la pulizia. (A) Mescolare il campione A (blu) e il campione B (rosso) e quindi far confluire il campione misto (viola) nella cella 1. (B) Lo stato del dispositivo di arresto del flusso durante la raccolta dei dati sulla cella campione 1 mentre la cella campione 2 viene risciacquata con solvente da SS1 (verde). (C) Lo stato del dispositivo di interruzione del flusso durante la raccolta dei dati sulla cella campione 1 mentre la cella campione 2 è essiccata con azoto gassoso (arancione). (D) Una volta completata la raccolta dei dati della cella campione 1, un nuovo campione (viola) viene immediatamente miscelato e confluito nella cella campione 2. (E) Lo stato del dispositivo di arresto del flusso durante la raccolta dei dati sulla cella campione 2 mentre la cella campione 1 viene risciacquata con solvente da SS1 (verde). Mentre una cella campione viene misurata, l’altra cella campione viene pulita e asciugata. Il processo di misurazione del flusso interrotto alterna due celle campione per ridurre al minimo il tempo tra le successive iniezioni di miscelazione del campione. Abbreviazioni: PSV = valvola selettrice pompa; MSV = valvola selettrice miscelatrice; OSV = valvola interruttore di uscita; ISV = valvola interruttore di ingresso; SS1 = fonte di solvente 1; SSA = fonte di campionamento A; N2 = fonte di azoto gassoso. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Di seguito è descritto un protocollo passo-passo per collegare le pompe e le tubazioni, adescare il sistema, risciacquare e asciugare la cella del campione e iniettare il campione misto. Sebbene la configurazione a cella singola sia dimostrata per semplicità (Figura 2), la configurazione modulare flessibile, il protocollo e gli script possono essere facilmente modificati per implementare più pompe a siringa, valvole, miscelatori o configurazioni di celle campione, come la configurazione a due celle campione mostrata nella Figura 3. I dati rappresentativi della velocità di conteggio dei neutroni grezzi raccolti durante i cicli di iniezione di miscelazione e pulizia sono mostrati nella Figura 4, mentre la cinetica di scambio lipidico misurata a 3 diverse temperature e l’intensità diffusa normalizzata estratta corrispondente alla frazione di lipidi scambiati sono mostrati rispettivamente nella Figura 5 e nella Figura 6.
Protocol
Representative Results
Discussion
La procedura attuale descrive il dispositivo di miscelazione e le fasi per eseguire misure TR-SANS a flusso interrotto. Il dispositivo e il protocollo sono ottimizzati per campioni liquidi a bassa viscosità in cui le scale temporali di interesse sono ≈1 s a 5 min. Per scale temporali superiori a 5 minuti, mescolare manualmente i campioni e caricarli in celle di dispersione standard può essere più facile e desiderabile, specialmente per campioni ad alta viscosità, gel o paste. L’accesso a scale temporali inferiori a…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
L’accesso al VSANS NG3 è stato fornito dal Center for High-Resolution Neutron Scattering, una partnership tra il National Institute of Standards and Technology e la National Science Foundation ai sensi dell’accordo n. DMR-2010792. M.H.L.N riconosce il finanziamento fornito da Mitacs Globalink (Canada). L’identificazione di qualsiasi prodotto commerciale o nome commerciale è per favorire la comprensione e non implica l’approvazione o la raccomandazione da parte del National Institute of Standards and Technology.
Materials
| Dynamic mixer | Analytical Scientific Instruments | 462-0150A | Magnetically coupled rotor, binary dynamic mixer assembly (ternary type available), 0.15 mL dead volume (larger dead volume available) |
| Fluoropolymer tubing | IDEX Health & Science | 1507L | PFA Tubing Natural 1/16 inch OD x 0.040 inch ID x 50 ft |
| Fluoropolymer 1/4-28 flangeless fittings | IDEX Health & Science | XP-245 | PFA flangeless fitting with ferrules, 1/4-28 threading, 1/16 inch OD tubing |
| Glass syringes | Hamilton Company | 81660 | Hamilton 1000 series syringes, 10 mL (81660), model 1010 C syr, 1/4"-28 thread termination, other volumes available |
| High-pressure flow selector valves | Vici Valco | C85X-1570EUTB | Vici 10 position selector valves, 15000 psi max, 0.25 mm bore, 1/16 inch OD tubing, 10-32 coned threaded ports, USB universal actuator |
| High-pressure switch valves | Vici Valco | C82X-1574EUHB | Vici 4 port switch valves, 15000 psi max, 0.25 mm bore, 1/16 inch OD tubing, 10-32 coned threaded ports, USB universal actuator |
| High-pressure syringes | Cetoni | A2019000358 | 3 mL stainless steel syringe, 510 bar max, 21 mL/min flow rate max |
| Low-pressure flow selector valves | Vici Valco | C25-3180EUHB | Vici 10 position selector valves, max 250 psi liquid, 0.75 mm bore, 1/16 inch OD tubing, 1/4-28 threaded ports, USB universal actuator |
| neMESYS high-pressure syringe pumps | Cetoni | A3921000103 | Max force 2600 N |
| neMESYS mid-pressure syringe pumps | Cetoni | A3921000131 | Max force 1000 N |
| Power supply | Cetoni | A3921000127 | Base 600, supplies power for up to 4 high pressure pumps |
| Quartz flow-through sample cell | Starna Scientific | 3-2.30-Q-1/TC | Quartz micro flow cells, 2 mm path length (1 mm available), 2 mm by 2 mm by 30 mm internal dimension |
| Quartz windows | Technical Glass Products | NA | GE 124 Clear fused quartz ground and polished plates, 11.75 inch by 23.75 inch by 0.375 inch thick |
| Stainless steel 10-32 coned compression fittings | IDEX Health & Science | U-321X, U-320X | 316 stainless steel ferrule (U-321X) and nut (U-320X) -Valco type, 10-32 coned, for 1/16 inch OD stainless steel tubing |
| Stainless steel tubing | IDEX Health & Science | U-102 | Stainless Steel Tubing 1/16 inch OD x 0.020 inch ID, 10 cm, various precut lengths available |
| Syringe pump control software | Cetoni | T6000000004 | QmixElements software for nemesys pumps, QmixSDK software development kit |
| Thermoelectric air conditioner | EIC Solutions | AAC-140C-4XT-HC | Thermoelectric air conditioner mounted on insulated enclosure to control the pump, valve, mixer, and sample temperature |
| T-slot railing | McMaster-Carr | 47065T103 | Aluminum t-slotted railing (1.5 inch by 1.5 inch) cut to various lengths |
| Vapor locking bottle caps | Cole-Parmer | EW-12018-02 | Four 304 SS port inserts, 1/4"-28 threads, GL45 bottle cap size, PTFE body, SS threads, PP collar |
Riferimenti
- Melnichenko, Y. B., Wignall, G. D. Small-angle neutron scattering in materials science: Recent practical applications. Journal of Applied Physics. 102 (2), 021101 (2007).
- Grillo, I., Borsali, R., Pecora, R. Small-angle neutron scattering and applications in soft condensed matter. Soft Matter Characterization. , (2008).
- Hollamby, M. J. Practical applications of small-angle neutron scattering. Physical Chemistry Chemical Physics. 15 (26), 10566-10579 (2013).
- Pipich, V., Fu, Z. KWS-3: Very small angle diffractor with focusing mirror. Journal of large-scale research. 1, 31 (2015).
- Barker, J. G., Kline, S., et al. . 2019 NCNR Annual Report, Special Publication (NIST SP). , (2019).
- Gilbert, P. H., et al. Preservative induced polysorbate 80 micelle aggregation. Journal of Pharmaceutical Sciences. 10 (6), 2395-2404 (2021).
- Terashima, T., et al. In situ and time-resolved small-angle neutron scattering observation of star polymer formation via arm-linking reaction in ruthenium-catalyzed living radical polymerization. Macromolecules. 43 (19), 8218-8232 (2010).
- Hashimoto, K., Fujii, K., Nishi, K., Shibayama, M. Ion gel network formation in an ionic liquid studied by time-resolved small-angle neutron scattering. The Journal of Physical Chemistry B. 122 (40), 9419-9424 (2018).
- Conn, C. E., et al. Membrane protein structures in lipid bilayers; small-Angle neutron scattering with contrast-matched bicontinuous cubic phases. Frontiers in Chemistry. 8, 619470 (2021).
- van’t Hag, L., et al. Protein-eye view of the in meso crystallization mechanism. Langmuir. 35 (25), 8344-8356 (2019).
- Mahieu, E., et al. Observing protein degradation by the PAN-20S proteasome by time-resolved neutron scattering. Biophysical Journal. 119 (2), 375-388 (2020).
- Ibrahim, Z., et al. Time-resolved neutron scattering provides new insight into protein substrate processing by a AAA+ unfoldase. Scientific Reports. 7 (1), 40948 (2017).
- Hollamby, M. J., et al. Growth of mesoporous silica nanoparticles monitored by time-resolved small-angle neutron scattering. Langmuir. 28 (9), 4425-4433 (2012).
- Blin, J. L., Impéror-Clerc, M. Mechanism of self-assembly in the synthesis of silica mesoporous materials: in situ studies by X-ray and neutron scattering. Chemical Society Reviews. 42 (9), 4071-4082 (2013).
- Impéror-Clerc, M., Grillo, I., Khodakov, A. Y., Durand, D., Zholobenko, V. L. New insights into the initial steps of the formation of SBA-15 materials: an in situ small angle neutron scattering investigation. Chemical Communications. 8, 834-836 (2007).
- Narayanan, T., Rüter, A., Olsson, U. SAXS/WAXS investigation of amyloid-β(16-22) peptide nanotubes. Frontiers in Bioengineering and Biotechnology. 9, 654349 (2021).
- Angelov, B., et al. DNA/Fusogenic lipid nanocarrier assembly: millisecond structural dynamics. The Journal of Physical Chemistry Letters. 4 (11), 1959-1964 (2013).
- Amann, M., et al. Kinetic pathways for polyelectrolyte coacervate micelle formation revealed by time-resolved synchrotron SAXS. Macromolecules. 52 (21), 8227 (2019).
- Varga, Z., Wacha, A., Bóta, A. Osmotic shrinkage of sterically stabilized liposomes as revealed by time-resolved small-angle X-ray scattering. Journal of Applied Crystallography. 47 (1), 35-40 (2014).
- Panine, P., Finet, S., Weiss, T. M., Narayanan, T. Probing fast kinetics in complex fluids by combined rapid mixing and small-angle X-ray scattering. Advances in Colloid and Interface Science. 127 (1), 9-18 (2006).
- Grillo, I. Applications of stopped-flow in SAXS and SANS. Current Opinion in Colloid & Interface Science. 14 (6), 402-408 (2009).
- Gomez-Hens, A., Perez-Bendito, D. The stopped-flow technique in analytical chemistry. Analytica Chimica Acta. 242, 147-177 (1991).
- Patel, J. T., Belsham, H. R., Rathbone, A. J., Friel, C. T. Use of stopped-flow fluorescence and labeled nucleotides to analyze the ATP turnover cycle of kinesins. Journal of Visualized Experiments: JoVE. (92), e52142 (2014).
- Biro, F. N., Zhai, J., Doucette, C. W., Hingorani, M. M. Application of stopped-flow kinetics methods to investigate the mechanism of action of a DNA repair protein. Journal of Visualized Experiments: JoVE. (37), e1874 (2010).
- Raney, K. D., Sowers, L. C., Millar, D. P., Benkovic, S. J. A fluorescence-based assay for monitoring helicase activity. Proceedings of the National Academy of Sciences of the United States of America. 91 (14), 6644-6648 (1994).
- Roder, H., Maki, K., Cheng, H. Early events in protein folding explored by rapid mixing methods. Chemical reviews. 106 (5), 1836-1861 (2006).
- Milon, A., et al. Osmotic swelling of unilamellar vesicles by the stopped-flow light scattering method. Influence of vesicle size, solute, temperature, cholesterol and three α,ω-dihydroxycarotenoids. Biochimica et Biophysica Acta (BBA) – Biomembranes. 859 (1), 1-9 (1986).
- Gast, K., Nöppert, A., Müller-Frohne, M., Zirwer, D., Damaschun, G. Stopped-flow dynamic light scattering as a method to monitor compaction during protein folding. European Biophysics Journal. 25 (3), 211-219 (1997).
- Antoun, A., Pavlov, M. Y., Tenson, T., Ehrenberg, M. M. Ribosome formation from subunits studied by stopped-flow and Rayleigh light scattering. Biological Procedures Online. 6, 35-54 (2004).
- Zhu, Z., Armes, S. P., Liu, S. pH-Induced micellization kinetics of ABC triblock copolymers measured by stopped-flow light scattering. Macromolecules. 38 (23), 9803-9812 (2005).
- Ye, J., et al. Comparative study of temperature-induced association of cyclic and linear poly(N-isopropylacrylamide) chains in dilute solutions by laser light scattering and stopped-flow temperature jump. Macromolecules. 41 (12), 4416-4422 (2008).
- Liu, X., et al. Early stage kinetics of polyelectrolyte complex coacervation monitored through stopped-flow light scattering. Soft Matter. 12 (44), 9030-9038 (2016).
- Garman, E. F., Weik, M. X-ray radiation damage to biological samples: recent progress. Journal of Synchrotron Radiation. 26 (4), 907-911 (2019).
- Garg, S., Porcar, L., Woodka, A. C., Butler, P. D., Perez-Salas, U. Noninvasive neutron scattering measurements reveal slower cholesterol transport in model lipid membranes. Biophysical Journal. 101 (2), 370-377 (2011).
- Marquardt, D., et al. 1H NMR shows slow phospholipid flip-flop in gel and fluid bilayers. Langmuir. 33 (15), 3731-3741 (2017).
- Egelhaaf, S. U., Olsson, U., Schurtenberger, P. Time-resolved SANS for surfactant phase transitions. Physica B: Condensed Matter. 276-278, 326-329 (2000).
- Tabor, R. F., Eastoe, J., Grillo, I. Time-resolved small-angle neutron scattering as a lamellar phase evolves into a microemulsion. Soft Matter. 5 (10), 2125-2129 (2009).
- Gradzielski, M., Bergmeier, M., Hoffmann, H., Müller, M., Grillo, I. Vesicle gel formed by a self-organization process. The Journal of Physical Chemistry B. 104 (49), 11594-11597 (2000).
- Lee, Y. -. T., Li, D. S., Pozzo, L. D. Kinetic analysis of ultrasound-induced oil exchange in oil-in-water emulsions through contrast variation time-resolved small-sngle neutron scattering. Langmuir. 35 (47), 15204-15213 (2019).
- Lee, Y. -. T., Pozzo, L. D. Contrast-variation time-resolved small-angle neutron scattering analysis of oil-exchange kinetics between oil-in-water emulsions stabilized by anionic surfactants. Langmuir. 35 (47), 15192-15203 (2019).
- Roger, K., Olsson, U., Schweins, R., Cabane, B. Emulsion ripening through molecular exchange at droplet contacts. Angewandte Chemie International Edition. 54 (5), 1452-1455 (2015).
- Nakano, M., Fukuda, M., Kudo, T., Endo, H., Handa, T. Determination of Interbilayer and Transbilayer Lipid Transfers by Time-Resolved Small-Angle Neutron Scattering. Physical Review Letters. 98 (23), 238101 (2007).
- Nakano, M., et al. Flip-flop of phospholipids in vesicles: kinetic analysis with time-resolved small-angle neutron scattering. The Journal of Physical Chemistry B. 113 (19), 6745-6748 (2009).
- Nguyen, M. H. L., et al. Methanol accelerates DMPC flip-flop and transfer: A SANS study on lipid dynamics. Biophysical Journal. 116 (5), 755-759 (2019).
- Nguyen, M. H. L., et al. Peptide-induced Lipid flip-flop in asymmetric liposomes measured by small angle neutron scattering. Langmuir. 35 (36), 11735-11744 (2019).
- Nguyen, M. H. L., et al. Time-resolved SANS reveals pore-forming peptides cause rapid lipid reorganization. New Journal of Chemistry. 45 (1), 447-456 (2021).
- Xia, Y., et al. Effects of nanoparticle morphology and acyl chain length on spontaneous lipid transfer rates. Langmuir. 31 (47), 12920-12928 (2015).
- Xia, Y., et al. Morphology-induced defects enhance lipid transfer rates. Langmuir. 32 (38), 9757-9764 (2016).
- Maric, S., et al. Time-resolved small-angle neutron scattering as a probe for the dynamics of lipid exchange between human lipoproteins and naturally derived membranes. Scientific Reports. 9 (1), 7591 (2019).
- Nielsen, J. E., Bjørnestad, V. A., Pipich, V., Jenssen, H., Lund, R. Beyond structural models for the mode of action: How natural antimicrobial peptides affect lipid transport. Journal of Colloid and Interface Science. 582, 793-802 (2021).
- Willner, L., Poppe, A., Allgaier, J., Mokenbusch, M., Richter, D. TIme-resolved SANS for the determintioan of unimer exchange kinetics in block copolymer micelles. Europhysics Letters. 55 (5), 667 (2001).
- Lund, R., Willner, L., Stellbrink, J., Lindner, P., Richter, D. Logarithmic chain-exchange kinetics of diblock copolymer micelles. Physical Review Letters. 96 (6), 068302 (2006).
- Lund, R., Willner, L., Richter, D., Dormidontova, E. E. Equilibrium chain exchange kinetics of diblock copolymer micelles: Tuning and logarithmic relaxation. Macromolecules. 39 (13), 4566-4575 (2006).
- Lund, R., Willner, L., Richter, D., Abe, A., Lee, K. S., Leibler, L., Kobayashi, S. Kinetics of block copolymer micelles studied by small-angle scattering methods. in Controlled Polymerization and Polymeric Structures. Advances in Polymer Science. , 51 (2013).
- Choi, S. -. H., Lodge, T. P., Bates, F. S. Mechanism of molecular exchange in diblock copolymer micelles: hypersensitivity to core chain length. Physical Review Letters. 104 (4), 047802 (2010).
- Choi, S. -. H., Bates, F. S., Lodge, T. P. Molecular exchange in ordered diblock copolymer micelles. Macromolecules. 44 (9), 3594-3604 (2011).
- Lu, J., Bates, F. S., Lodge, T. P. Chain exchange in binary copolymer micelles at equilibrium: confirmation of the independent chain hypothesis. ACS Macro Letters. 2 (5), 451-455 (2013).
- Lu, J., Bates, F. S., Lodge, T. P. Remarkable effect of molecular architecture on chain exchange in triblock copolymer micelles. Macromolecules. 48 (8), 2667-2676 (2015).
- Kelley, E. G., et al. Size evolution of highly amphiphilic macromolecular solution assemblies via a distinct bimodal pathway. Nature Communications. 5 (1), 3599 (2014).
- Murphy, R. P., Kelley, E. G., Rogers, S. A., Sullivan, M. O., Epps, T. H. Unlocking chain exchange in highly amphiphilic block polymer micellar systems: influence of agitation. ACS Macro Letters. 3 (11), 1106-1111 (2014).
- Schantz, A. B., et al. PEE-PEO block copolymer exchange rate between mixed micelles is detergent and temperature activated. Macromolecules. 50 (6), 2484-2494 (2017).
- Lantz, K. A., et al. Cavitation enables switchable and rapid block polymer exchange under high-χN conditions. Macromolecules. 51 (17), 6967-6975 (2018).
- Murphy, R. P., et al. Capillary RheoSANS: measuring the rheology and nanostructure of complex fluids at high shear rates. Soft Matter. 16 (27), 6285-6293 (2020).
- Stopped Flow Sans. usnistgov Available from: https://github.com/usnistgov/stopped-flow-sans (2021)
- Kline, S. Reduction and analysis of SANS and USANS data using IGOR Pro. Journal of Applied Crystallography. 39 (6), 895-900 (2006).
- Doktorova, M., et al. Preparation of asymmetric phospholipid vesicles for use as cell membrane models. Nature Protocols. 13 (9), 2086-2101 (2018).
- Huang, Z., London, E. Effect of cyclodextrin and membrane lipid structure upon cyclodextrin-lipid interaction. Langmuir. 29 (47), 14631-14638 (2013).
- Sugiura, T., Ikeda, K., Nakano, M. Kinetic analysis of the methyl-β-cyclodextrin-mediated intervesicular transfer of pyrene-labeled phospholipids. Langmuir. 32 (51), 13697-13705 (2016).
- Scott, H. L., et al. On the mechanism of bilayer separation by extrusion, or why your LUVs are not really unilamellar. Biophysical Journal. 117 (8), 1381-1386 (2019).
- Dicko, C., et al. NUrF-Optimization of in situ UV-vis and fluorescence and autonomous characterization techniques with small-angle neutron scattering instrumentation. Review of Scientific Instruments. 91 (7), 075111 (2020).

