Респирометрия высокого разрешения для оценки биоэнергетики в клетках и тканях с использованием камерных и пластинчатых респирометров
Summary
Оценка окислительного фосфорилирования с помощью респирометров высокого разрешения стала неотъемлемой частью функционального анализа митохондрий и клеточного энергетического обмена. Здесь мы представляем протоколы анализа клеточного энергетического метаболизма с использованием камерных и микропластинчатых респирометров высокого разрешения и обсуждаем ключевые преимущества каждого устройства.
Abstract
Респирометрия высокого разрешения (HRR) позволяет контролировать окислительное фосфорилирование в режиме реального времени для анализа отдельных клеточных энергетических состояний и оценки дыхательных комплексов с использованием диверсифицированных протоколов титрования субстрат-разъединитель-ингибитор (SUIT). Здесь демонстрируется использование двух устройств респирометрии высокого разрешения, а также представлена базовая коллекция протоколов, применимых для анализа культивируемых клеток, волокон скелетной и сердечной мышц, а также мягких тканей, таких как мозг и печень. Протоколы для культивируемых клеток и тканей предусмотрены для камерного респирометра и культивируемых клеток для респирометра на основе микропластин, оба охватывают стандартные протоколы дыхания. Для сравнения, разработанные CRISPR клетки HEK293 с дефицитом митохондриальной трансляции, вызывающей множественный дефицит дыхательной системы, используются с обоими устройствами для демонстрации клеточных дефектов дыхания. Оба респирометра позволяют комплексно измерять клеточное дыхание с их соответствующими техническими достоинствами и пригодностью в зависимости от исследуемого вопроса исследования и модели.
Introduction
Митохондрии выполняют ключевое обеспечение энергией и представляют собой компартментированную органеллу, способствующую существенным клеточным биоэнергетическим и метаболическим процессам, таким как анаболизм нуклеотидов, липидов и аминокислот, биогенез железо-серного кластера и участвуют в передаче сигналов, таких как контролируемая гибель клеток 1,2,3 . Митохондриальная биоэнергетика посредством окислительного фосфорилирования способствует практически всем клеточным процессам внутри клетки, и, следовательно, митохондриальные дисфункции первичного или вторичного происхождения связаны с широким спектром заболеваний 4,5. Митохондриальная дисфункция включает в себя не только изменения в структуре или плотности митохондрий, но и в качестве и регуляции дыхательной системы6. Этот качественный элемент включает в себя управление субстратом, характеристики связи, посттрансляционные модификации, динамику крист и дыхательные суперкомплексы 7,8. Поэтому точный анализ митохондриальной биоэнергетики для экспериментальных и диагностических подходов к оценке энергетического обмена клетки важен для здоровья и болезней.
Митохондриальное окислительное фосфорилирование (OXPHOS) представляет собой последовательность реакций в дыхательной системе или системе переноса электронов (ETS) для генерации клеточной энергии через аденозинтрифосфат (АТФ)9. Мультиферментативная стадия для использования энергии от потока электронов через комплексы I и II к комплексу IV генерирует электрохимический протонный градиент через внутреннюю митохондриальную мембрану, впоследствии используемый для фосфорилирования аденозиндифосфата (АДФ) до АТФ через комплекс V (F1FO АТФ-синтаза) (Рисунок 1А).
Во-первых, два электронных носителя образуются во время трикарбоксового цикла (TCA), гликолиза и пируватного окисления: никотинамидадениндинуклеотид (NADH) и дигидрофлавинадениндинуклеотид (FADH2). NADH окисляется в комплексе I (NADH дегидрогеназа), в ходе которого два электрона переносятся в коэнзим Q (хинон восстанавливается до хинола), в то время как протоны закачиваются в межмембранное пространство (IMS). Во-вторых, комплекс II (сукцинатдегидрогеназа) окисляет FADH2 и подает электроны в коэнзим Q без перекачки протонов. В-третьих, в комплексе III (цитохром c оксидоредуктаза) электроны из коэнзима Q переносятся в цитохром c, в то время как протоны закачиваются в IMS. В-четвертых, цитохром c переносит электроны в комплекс IV (цитохром c оксидаза), конечный комплекс для перекачки протонов, и где кислород функционирует как акцептор электронов для ассимиляции протонов, в конечном итоге образуя воду. Именно этот кислород потребляют митохондрии, который можно измерить с помощью оксиграфа. Наконец, протоны, полученные из комплекса I, комплекса III и комплекса IV, используются для вращения комплекса V, тем самым генерируя АТФ9.
Важно отметить, что перенос электронов происходит не только линейным образом, иначе обозначаемым как цепь переноса электронов. Вместо этого электроны могут быть перенесены в пул коэнзима Q через несколько дыхательных путей и облегчают конвергентный поток электронов. NADH-субстраты и сукцинат, например, могут входить через комплекс I и комплекс II соответственно. Электроны от окисления жирных кислот могут быть пожертвованы через электрон-переносящий флавопротеиновый комплекс. Действительно, всесторонний анализ OXPHOS требует целостного подхода с соответствующими топливными субстратами (рисунок 1A).
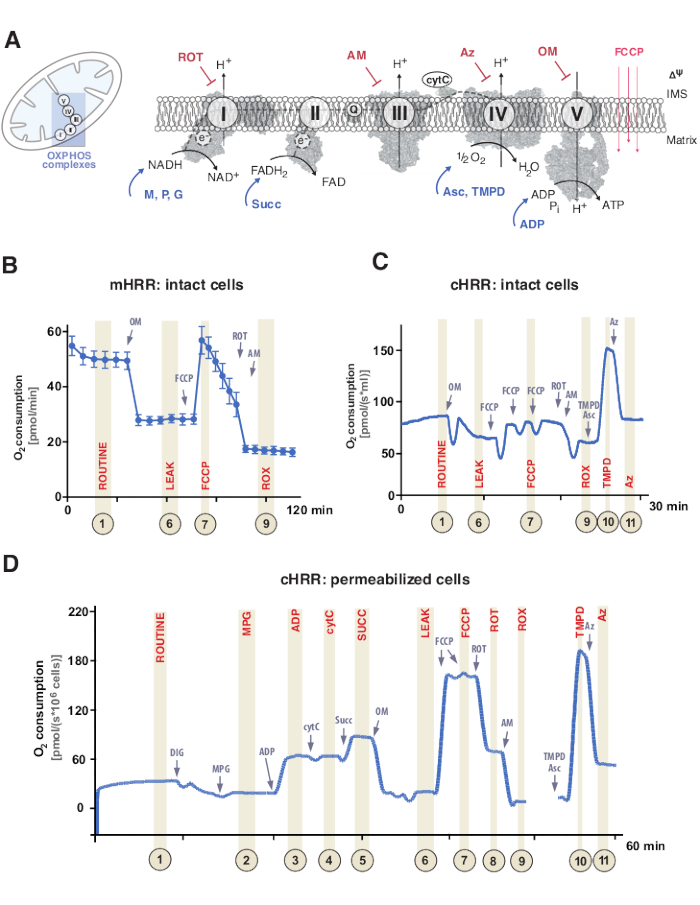
Рисунок 1: Митохондриальное окислительное фосфорилирование и специфические протоколы субстрата и ингибитора. (А) Митохондрии и схема системы переноса электронов (CI-CIV) и митохондриальная F1F0 АТФ-синтаза (CV). Все структуры из PDB. На рисунках изображены только субстраты и ингибиторы, описанные в этом исследовании). (B) Образец следа потока кислорода в неповрежденных ячейках HEK293 с использованием стандартного протокола в устройстве mHRR. (C) Образец следа потока кислорода в неповрежденных ячейках HEK293 с использованием стандартного протокола в устройстве cHRR. (D) Образец следа потока кислорода в пермеабилизированных фибробластах человека от здорового донора с соответствующим протоколом SUIT. Сокращения: 1 = Рутинное дыхание неповрежденных клеток; 2 = состояние 2; 3 = государство 3(I); 4 = состояние 3(I) с cytC; 5 = состояние 3 (I+II); 6 = Утечка(ОМ); 7 = емкость ETS; 8 = S(ROT); 9 = ROX; 10 = TMPD; 11 = Az. ROT = Ротенон, AM = Антимицин, АТФ = Аденозинтрифосфат, Az = Азид, OM = Олигомицин, FCCP = Карбонилцианид-трифтор-метоксифенилгидразон; Asc = Аскорбат, TMPD = N,N,N’,N’-тетраметил-p-фенилендиамин, Succ = Сукцинат, M = Малат, P = Пируват, ADP = Аденозиндифосфат, NAD = Никотинамиддениндинуклеотид, IMS = Межмембранное пространство, FAD = Флавинадениндинуклеотид. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Анализ емкости митохондриального OXPHOS с использованием HRR стал инструментальным биохимическим методом диагностической ценности не только для первичных митохондриальных дефектов10,11, но и для всех других областей биологии, таких как рак и старение12 лет. HRR позволяет определить клеточное дыхание путем анализа митохондриальной емкости OXPHOS, которая непосредственно отражает индивидуальную или комбинированную недостаточность митохондриального дыхательного комплекса и косвенно связана с клеточной дисфункцией и измененным энергетическим метаболизмом9. Методологически измерения дыхания выполняются с использованием клеток, тканей или изолированных митохондрий 11,13,14, с замороженным материалом, только частично подходящим15,16. Показано, что замороженная ткань имеет неповрежденную ETS с сохраненной суперкомплексной стабильностью15. Таким образом, в отличие от традиционных промежуточных продуктов TCA, соответствующие субстраты непосредственно подаются в ETS. Однако связь между ETS и синтезом АТФ теряется, поскольку целостность мембраны нарушается из-за повреждения замораживанием (образование кристаллов льда).
Эксперименты по дыханию обычно проводятся при физиологической температуре 37 °C для эндотерм в непроницаемых или пермеабилизированных клетках или тканях. В то время как первый рассматривает цитозольный метаболический контекст, последний обеспечивает энергетический вклад отдельных комплексов OXPHOS и АТФазы путем добавления специфических субстратов (и ингибиторов). Последовательность и вариация субстратов и ингибиторов привели к разработке разнообразного массива протоколовSUIT 17 и анализов18 для решения различных научных вопросов функции OXPHOS (рассмотрено в разделе12). Основной протокол клеточного дыхания оценивает четыре различных состояния: i) рутинное дыхание – дыхание в соответствующей дыхательной среде без какого-либо добавления субстратов или ингибиторов, потребляющих только эндогенные субстраты. Это состояние может выявить общий OXPHOS или вторично-индуцированные дефекты дыхания, вызванные, например, измененными профилями метаболитов. Далее добавление ингибитора АТФазы олигомицина выявляет проницаемость внутренней митохондриальной мембраны к протонам, определяемую как ii) утечка дыхания. Последующее титрование протонофора, такого как разъединитель карбонилцианида-трифтор-метоксифенилгидразон (FCCP), позволяет определить состояние, при котором емкость ETS максимальна в режиме открыто-трансмембранного протонного контура, определяемом как iii) несвязанное дыхание. Важно отметить, что несвязанное состояние может также возникать при экспериментальных вмешательствах из-за чрезмерного механического повреждения митохондриальных мембран. И наоборот, несвязанное состояние относится к дыхательному разъединению внутренним механизмом, который физиологически контролируется. Наконец, полное ингибирование ИТС путем добавления комплекса III ингибитора антимицина и комплекса I ингибитора ротенона определяет остаточное потребление кислорода (ROX) от немитохондриальных процессов, потребляющих кислород (Рисунок 1A-C).
Митохондриальная биоэнергетика состоит из пяти различных состояний дыхания19,20. Дыхание в состоянии 1 не имеет каких-либо дополнительных субстратов или АДФ, за исключением того, что эндогенно доступно. После добавления АДФ, но все же, без субстратов, достигается дыхание состояния 2. Когда добавляются подложки, позволяющие переносить электроны и синтез АТФ, достигается дыхание состояния 3. В этом состоянии емкость OXPHOS может быть определена при насыщенных концентрациях АДФ, неорганических фосфатов, кислорода, NADH- и сукцинат-связанных субстратов. Состояние дыхания 4 или дыхание LEAK может быть определено как состояние без АДФ или химически ингибированных АТФ-синтаз при наличии достаточного количества субстратов. Наконец, когда весь кислород обеднен (бескислородный) в условиях закрытой камеры, наблюдается дыхание в состоянии 5.
Существует несколько методов оценки клеточных энергетических состояний14 с двумя устройствами, доминирующими в текущей оценке OXPHOS в реальном времени путем анализа потребления кислорода, измеренного как функция снижения кислорода с течением времени в системе с закрытой камерой с различной применимостью в зависимости от экспериментальной модели и исследовательского вопроса: респирометр высокого разрешения Oroboros 2k и внеклеточный анализатор потока Seahorse XF. Оба прибора регистрируют скорость потребления кислорода как снижение пикомолей (пмоль) кислорода (О2) в секунду как абсолютное значение в камере или микропластине скважины. Удельное потребление кислорода на массу получают путем нормализации соответствующего потребления кислорода в определенном буферном рецепте на количество клеток (миллионы), вес ткани (мг) или количество белка.
O2k (Oroboros Instruments) представляет собой закрытую двухкамерную систему, оснащенную полярографическим датчиком кислорода (сокращенно камерный респирометр высокого разрешения: cHRR). Каждая экспериментальная камера вмещает 2 мл жидкости, которая поддерживается однородной магнитными мешалками. Полярографический датчик кислорода использует амперометрический подход для измерения кислорода: он содержит катод золота, анод хлорида серебра / серебра, а между раствором KCI создается электрохимическая ячейка, на которую подается напряжение (0,8 В). Кислород из пробирной среды диффундирует через 25-мкм фторированную этиленпропиленовую мембрану (O 2-проницаемую) и подвергается восстановлению на катоде, производя перекись водорода. На аноде серебро окисляется перекисью водорода, генерируя электрический ток. Этот электрический ток (ампер) линейно связан с парциальным давлением кислорода. Парциальное давление кислорода и коэффициент растворимости кислорода пробирной среды используются для расчета концентрации кислорода. Поскольку парциальное давление кислорода зависит от экспериментальной температуры, а полярографические измерения чувствительны к температуре, колебания температуры нуждаются в точном (±0,002 °C) регулировании нагревательным блоком Пельтье. Температура может контролироваться в диапазоне 4 °C и 47 °C.
Внеклеточный анализатор потока Seahorse XF (Agilent) представляет собой пластинчатую систему с 24- или 96-луночным форматом микропластин, в которой три флуоресцентных электрода измеряют потребление кислорода с течением времени в каждой скважине (сокращенно респирометр высокого разрешения на основе микропластин: mHRR). Максимум четыре порта в картридже для анализа доступны для автоматического впрыска во время анализа. Анализ содержит несколько циклов, каждый из которых состоит из трех фаз: 1) смешивание, 2) ожидание и 3) измерение. Во время фазы измерения датчики опускаются в микропластинку, создавая временно закрытую камеру, содержащую объем 7-10 мкл для измерения излучаемого света. Этот свет излучается встроенными в полимер флуорофорами на кончике сенсорных зондов, которые ощущают O2 на основе закалки фосфоресценции. Интенсивность флуоресцентного сигнала пропорциональна O2 и зависит от температуры датчика и пробирной среды. Поэтому точная оценка кислорода требует относительного подхода с фоновой скважиной без какой-либо выборки. Восстановление концентрации кислорода происходит во время фазы перемешивания, когда датчик перемещается вверх и вниз, чтобы смешать объем над временной камерой. Каждый цикл вычисляет одну норму потребления кислорода. Температура может контролироваться в диапазоне 16 °C и 42 °C.
HRR является золотым стандартом для оценки клеточной биоэнергетики при первичных и митохондриальных заболеваниях и общем клеточном метаболизме. В этом исследовании представлены основные протоколы HRR для оценки функции OXPHOS в клетках и тканях.
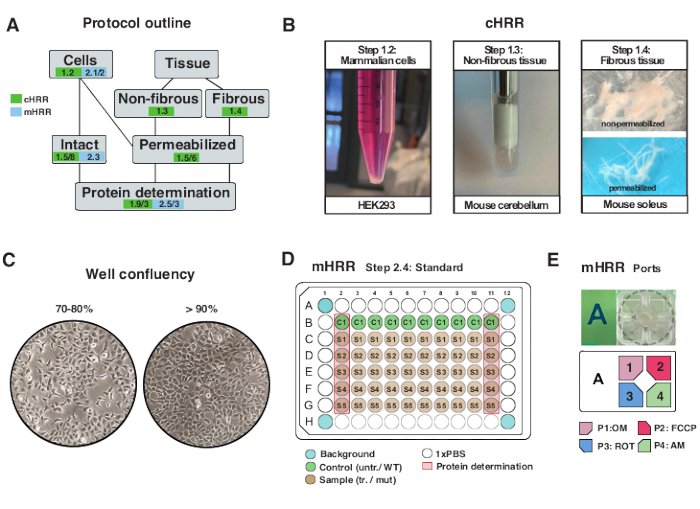
Рисунок 2: Рабочий процесс для клеточных и тканевых препаратов для cHRR и клеточной подготовки к mHRR респирометрии. (A) Краткое описание предоставленных протоколов. (B) Клетки млекопитающих (этап 1.2): гранулы HEK293, равные 3 x 106 клеткам (левая панель). Неволокнистая ткань (этап 1.3): Получение лизата мозжечка мышей в 2 мл тефлонового гончара (средняя панель). Сапонин-индуцированная пермеабилизация скелетных мышц (шаг 1.4) правая панель) для cHRR-респирометрии. (C) Стандартная схема посева микропластин (этап 2.4) и проверка слияния для анализа эукариотических клеток (HEK293) для респирометрии mHRR. (Д, Д) Схема загрузки инжекторного порта для респирометрии mHRR (шаг 2.4). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Protocol
Representative Results
Discussion
Традиционно митохондриальная биоэнергетика изучалась с помощью кислородных электродов типа Кларка. Однако отсутствие разрешения и пропускной способности оправдывало технический прогресс. На сегодняшний день O2k (называемый cHRR) и анализатор потока Seahorse XF96 (называемый mHRR) широко распро…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Эта работа была поддержана финансированием Академии Финляндии (C.B.J), Фонда Магнуса Эрнрута (C.B.J)) и докторской стипендии Интегрированной высшей школы наук о жизни (R.A.).
Materials
| 2 mL Potter-Elvehjem Glass/PTFE Tissue Grinder/Homogenizer | Omni International | 07-358029 | |
| 95% O2, 5% CO2 medical gas mixture | Potter for tissue grinding | ||
| ADP | Sigma | A 4386 | |
| Antimycin A | Sigma | A 8674 | Chemical |
| Ascorbate | Merck | PHR1279-1G | Chemical, dissolve in ethanol |
| BSA (fatty accid free) | Sigma | A 6003 | Chemical |
| CaCO3 | Sigma | C 4830 | Chemical |
| Cytochrome c | Sigma | C 7752 | Chemical |
| Digitonin | Sigma | D 5628 | Chemical |
| Dithiothreitol | Sigma | D 0632 | Chemical, dissolve in DMSO |
| D-Sucrose | Roth | 4621.1 | Chemical |
| Dulbecco’s modified Eagle’s medium (High glucose) | Fisher Scientific | 41965-039 | Chemical |
| Dulbecco’s modified Eagle’s medium (No Glucose) | Fisher Scientific | A14430-01 | |
| EGTA | Sigma | E 4378 | |
| Etomoxir | Sigma | E1905 | Chemical |
| Falcon 15 ml Conical Centrifuge Tubes | Fisher Scientific | AM12500 | Chemical |
| Falcon 50 ml Conical Centrifuge Tubes | Fisher Scientific | AM12501 | |
| FCCP | Sigma | C 2920 | |
| Glucose | Sigma | G7021 | Chemical, dissolve in ethanol |
| Glutamate | Sigma | G 1626 | Chemical |
| GlutaMax (100x) (200 nM L-alanyl-L-glutamine dipeptide) | Fisher Scientific | 35050061 | Chemical |
| HEK293 cells | ATTC | CRL-1573 | |
| Hemocytometer | Fisher Scientific | 0267151B | Instrument for cell counting |
| Hepes | Sigma | H 7523 | Chemical |
| Imidazole | Fluka | 56750 | Chemical |
| KCl | Merck | 1.04936 | Chemical |
| L-carnitine | Sigma | C0283 | Chemical |
| Malate | Sigma | M 1000 | Chemical |
| MES hydrate | Sigma | M8250 | Chemical |
| MgCl2 | Sigma | M 9272 | Chemical |
| Na2ATP | Sigma | A 2383 | Chemical |
| Na2Phosphocreatine | Sigma | P 7936 | Chemical |
| Na-pyruvate (100 mM) (100x) | Fisher Scientific | 11360070 | |
| NEAA (Non-essential amino acids) 100x | Fisher Scientific | 11140035 | |
| Normal FBS (10x) | Fisher Scientific | 10500064 | |
| O2k-Core: Oxygraph-2k | Oroboros Instruments | 10000-02 | High-resolution respirometry instrument |
| O2k-Titration Set | Oroboros Instruments | 20820-03 | Hamilton syringes for chemical injections |
| Oligomycin | Sigma | O 4876 | Chemical, dissolve in ethanol |
| Palmitoylcarnitine | Sigma | P 4509 | Chemical |
| Penicillin-Streptomycin | Fisher Scientific | 15140122 | |
| Pierce BCA Protein Assay Kit | Fisher Scientific | 23227 | |
| Pyruvate | Sigma | P 2256 | Chemical |
| RIPA-Buffer | Fisher Scientific | 89900 | Chemical |
| Rotenone | Sigma | R 8875 | Chemical, dissolve in ethanol |
| Saponin | Sigma | S7900 | Chemical |
Seahorse XF DMEM assay medium pack, pH 7.4 |
Agilent, Santa Clara, CA |
103680-100 | |
| Seahorse XFe96 Extracellular Flux Analyzer | Agilent, Santa Clara, CA |
High-throughput respirometry instrument | |
| Seahorse XFe96 FluxPak | Agilent, Santa Clara, CA |
Includes assay plates, cartridges, loading guides for transferring compounds to the assay cartridge, and calibrant solution. |
|
| Small scissors | Fisher Scientific | 08-951-20 | |
| Sodium azide | Sigma | S2002 | Chemical |
| Succinate | Sigma | S 2378 | Chemical |
| Taurine | Sigma | T 8691 | Chemical |
| TMPD | Sigma | T 3134 | Chemical |
| Trypan Blue solution | Merck | 72-57-1 | Chemical |
| Trypsin 0.25% EDTA | Fisher Scientific | 25200056 | |
| Two thin-edged forceps | Fisher Scientific | 12-000-122 | |
| Uridine stock (500x) | Sigma | U3750 | Chemical |
Riferimenti
- McBride, H. M., Neuspiel, M., Wasiak, S. Mitochondria: More than just a powerhouse. Current Biology. 16 (14), 551-560 (2006).
- Mehta, M. M., Weinberg, S. E., Chandel, N. S. Mitochondrial control of immunity. Beyond ATP. Nature Reviews Immunology. 17 (10), 608-620 (2017).
- Spinelli, J. B., Haigis, M. C. The multifaceted contributions of mitochondria to cellular metabolism. Nature Cell Biology. 20 (7), 745-754 (2018).
- Gnaiger, E. Capacity of oxidative phosphorylation in human skeletal muscle. New perspectives of mitochondrial physiology. International Journal of Biochemistry and Cell Biology. 41 (10), 1837-1845 (2009).
- Gorman, G. S., et al. Mitochondrial diseases. Nature Reviews Disease Primers. 2, 1-23 (2016).
- Boushel, R., Gnaiger, E., Schjerling, P., Skovbro, M., Kraunsøe, R., Dela, F. Patients with type 2 diabetes have normal mitochondrial function in skeletal muscle. Diabetologia. 50 (4), 790-796 (2007).
- Cogliati, S., et al. Mitochondrial cristae shape determines respiratory chain supercomplexes assembly and respiratory efficiency. Cell. 155 (1), 160-171 (2013).
- Kühlbrandt, W. Structure and function of mitochondrial membrane protein complexes. BMC Biology. 13, 1-11 (2015).
- Gnaiger, E. Mitochondrial pathways and Respiratory control. An introduction to OXPHOS analysis. Bioenergetics communications. 5th ed. , (2020).
- Jackson, C. B., et al. Mutations in SDHD lead to autosomal recessive encephalomyopathy and isolated mitochondrial complex II deficiency. Journal of Medical Genetics. 51 (3), 170-175 (2014).
- Pesta, D., Gnaiger, E. High-resolution respirometry: OXPHOS protocols for human cells and permeabilized fibers from small biopsies of human muscle. Methods in Molecular Biology. 810, 25-58 (2012).
- Horan, M. P., Pichaud, N., Ballard, J. W. O. Review: Quantifying mitochondrial dysfunction in complex diseases of aging. Journals of Gerontology – Series A Biological Sciences and Medical Sciences. 67 (10), 1022-1035 (2012).
- Doerrier, C., Garcia-Souza, L. F., Krumschnabel, G., Wohlfarter, Y., Mészáros, A. T., Gnaiger, E. High-resolution fluorespirometry and oxphos protocols for human cells, permeabilized fibers from small biopsies of muscle, and isolated mitochondria. Methods in Molecular Biology. 1782, 31-70 (2018).
- Zhang, J., et al. Measuring energy metabolism in cultured cells, including human pluripotent stem cells and differentiated cells. Nature Protocols. 7 (6), 1068-1085 (2012).
- García-Roche, M., Casal, A., Carriquiry, M., Radi, R., Quijano, C., Cassina, A. Respiratory analysis of coupled mitochondria in cryopreserved liver biopsies. Redox Biology. 17, 207-212 (2018).
- Acin-Perez, R., et al. A novel approach to measure mitochondrial respiration in frozen biological samples. The EMBO Journal. 39 (13), 1-18 (2020).
- Cell metabolism assay kits. Seahorse assay kits and media Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-lits-reagents-cell-assay-media (2021)
- Chance, B., Williams, G. R. A method for the localization of sites for oxidative phosphorylation. Nature. 176 (4475), 250-254 (1955).
- Gnaiger, E., et al. Mitochondrial respiratory states and rates. MitoFit Preprint Arch. , (2019).
- Gnaiger, E. O2k-procedures: SOP O2k quality control 1: Polarographic oxygen sensors and accuracy of calibration Section Page. Oroboros. 03 (18), 1-21 (2020).
- Robinson, B. H., Petrova-Benedict, R., Buncic, J. R., Wallace, D. C. Nonviability of cells with oxidative defects in galactose medium: A screening test for affected patient fibroblasts. Biochemical Medicine and Metabolic Biology. 48 (2), 122-126 (1992).
- King, M. P., Attardi, G. Human cells lacking mtDNA: Repopulation with exogenous mitochondria by complementation. Science. 246 (4929), 500-503 (1989).
- Makrecka-Kuka, M., Krumschnabel, G., Gnaiger, E. High-resolution respirometry for simultaneous measurement of oxygen and hydrogen peroxide fluxes in permeabilized cells, tissue homogenate and isolated mitochondria. Biomolecules. 5 (3), 1319-1338 (2015).
- Fasching, M., Gnaiger, E. O2k quality control 2: Instrumental oxygen background correction and accuracy of oxygen flux. Mitochondrial Physiology Network. 14 (06), 1-14 (2016).
- Gnaiger, E., Lassnig, B., Kuznetsov, A., Rieger, G., Margreiter, R. Excess capacity of cytochrome c oxidase. Journal of Experimental Biology. 1139, 1129-1139 (1998).
- Gnaiger, E., et al. Mitochondria in the Cold. Life in the Cold. , 431-442 (2000).
- Fontana-Ayoub, M., Fasching, E., Gnaiger, Selected media and chemicals for respirometry with mitochondrial preparations. Mitochondrial Physiology Network. 02 (17), 1-9 (2014).
- Gerencser, A. A., et al. Quantitative microplate-based respirometry with correction for oxygen diffusion. Analytical Chemistry. 81 (16), 6868-6878 (2009).
- Krumschnabel, G., Eigentler, A., Fasching, M., Gnaiger, E. Use of safranin for the assessment of mitochondrial membrane potential by high-resolution respirometry and fluorometry. Methods in Enzymology. 542, 163-181 (2014).
- Nászai, A., Terhes, E., Kaszaki, J., Boros, M., Juhász, L. Ca(2+)N it be measured? Detection of extramitochondrial calcium movement with high-resolution fluorespirometry. Scientific Reports. 9 (1), 1-13 (2019).
- Pajak, B., et al. 2-Deoxy-d-Glucose and its analogs: From diagnostic to therapeutic agents. International Journal of Molecular Sciences. 21 (1), 234 (2019).
- Mercier-Letondal, P., Marton, C., Godet, Y., Galaine, J. Validation of a method evaluating T cell metabolic potential in compliance with ICH Q2 (R1). Journal of Translational Medicine. 19 (1), 1-15 (2021).
- Sauerbeck, A., et al. Analysis of regional brain mitochondrial bioenergetics and susceptibility to mitochondrial inhibition utilizing a microplate based system. Journal of Neuroscience Methods. 198 (1), 36-43 (2011).
- Jackman, M. R., Willis, W. T. Characteristics of mitochondria isolated from type I and type IIb skeletal muscle. American Journal of Physiology – Cell Physiology. 270 (2), 673-678 (1996).
- Ponsot, E., et al. Mitochondrial tissue specificity of substrates utilization in rat cardiac and skeletal muscles. Journal of Cellular Physiology. 203 (3), 479-486 (2005).
- Schönfeld, P., Reiser, G. Why does brain metabolism not favor burning of fatty acids to provide energy-Reflections on disadvantages of the use of free fatty acids as fuel for brain. Journal of Cerebral Blood Flow and Metabolism. 33 (10), 1493-1499 (2013).
- Calderon-Dominguez, M., Mir, J. F., Fucho, R., Weber, M., Serra, D., Herrero, L. Fatty acid metabolism and the basis of brown adipose tissue function. Adipocyte. 5 (2), 98-118 (2016).
- Divakaruni, A. S., Rogers, G. W., Murphy, A. N. Measuring mitochondrial function in permeabilized cells using the seahorse XF analyzer or a clark-type oxygen electrode. Current Protocols in Toxicology. 2014, 1-16 (2014).
- Iuso, A., Repp, B., Biagosch, C., Terrile, C., Prokisch, H. Assessing mitochondrial bioenergetics in isolated mitochondria from various mouse tissues using Seahorse XF96 analyzer. Methods in Molecular Biology. 1567, 217-230 (2017).
- Rogers, G. W., et al. High throughput microplate respiratory measurements using minimal quantities of isolated mitochondria. PLoS ONE. 6 (7), 21746 (2011).
- Jordá, A., Zaragozá, R., Portolés, M., Báguena-Cervellera, R., Renau-Piqueras, J. Long-term high-protein diet induces biochemical and ultrastructural changes in rat liver mitochondria. Archives of Biochemistry and Biophysics. 265 (2), 241-248 (1988).
- Jackson, C. B., Gallati, S., Schaller, A. QPCR-based mitochondrial DNA quantification: Influence of template DNA fragmentation on accuracy. Biochemical and Biophysical Research Communications. 423 (3), 441-447 (2012).
- Hirsch, H. M. Tissue autoxidation inhibitors: II. The presence of inhibitor in intact cells; Assay of liver and hepatoma effect on radio-oxidations. Ricerca sul cancro. 16 (11), 1076-1082 (1956).
- Picard, M., et al. Mitochondrial structure and function are disrupted by standard Isolation methods. PLoS ONE. 6 (3), 18317 (2011).
- Tanumihardja, E., Slaats, R. H., Van Der Meer, A. D., Passier, R., Olthuis, W., Van Den Berg, A. Measuring both pH and O2 with a single On-Chip sensor in cultures of human pluripotent stem cell-derived cardiomyocytes to track induced changes in cellular metabolism. ACS Sensors. 6 (1), 267-274 (2021).
- Harms, F., Stolker, R. J., Mik, E. Cutaneous respirometry as novel technique to monitor mitochondrial function: A feasibility study in healthy volunteers. PLoS ONE. 11 (7), 159544 (2016).
- Levitsky, Y., et al. Micro-respirometry of whole cells and isolated mitochondria. RSC Advances. 9 (57), 33257-33267 (2019).

