챔버 및 플레이트 기반 호흡계를 사용하여 세포 및 조직의 생물 에너지를 평가하기위한 고해상도 호흡 측정법
Summary
고분해능 호흡계를 사용하여 산화 인산화를 평가하는 것은 미토콘드리아와 세포 에너지 대사의 기능 분석의 필수적인 부분이되었습니다. 여기에서는 챔버 및 마이크로 플레이트 기반 고해상도 호흡계를 사용하여 세포 에너지 대사를 분석하기위한 프로토콜을 제시하고 각 장치의 주요 이점에 대해 논의합니다.
Abstract
고분해능 호흡측정법(HRR)을 통해 개별 세포 에너지 상태 분석 및 다양한 기질-언커플러-억제제 적정(SUIT) 프로토콜을 사용하여 호흡기 복합체를 평가하기 위해 산화적 인산화를 실시간으로 모니터링할 수 있습니다. 여기에서는 두 개의 고해상도 호흡 측정 장치의 용도가 입증되며, 배양 된 세포, 골격 및 심장 근육 섬유, 뇌 및 간과 같은 연조직의 분석에 적용 할 수있는 프로토콜의 기본 모음이 제시됩니다. 배양된 세포 및 조직을 위한 프로토콜은 표준 호흡 프로토콜을 포괄하는 마이크로플레이트 기반 호흡계를 위한 챔버 기반 호흡계 및 배양된 세포를 위해 제공된다. 비교 목적을 위해, 다수의 호흡기 시스템 결핍을 야기하는 미토콘드리아 번역이 결핍된 CRISPR 조작된 HEK293 세포는 호흡에서 세포 결함을 입증하기 위해 두 장치와 함께 사용된다. 두 호흡계는 연구중인 연구 질문 및 모델에 따라 각각의 기술적 장점과 적합성으로 세포 호흡을 포괄적으로 측정 할 수 있습니다.
Introduction
미토콘드리아는 에너지의 주요 공급을 충족하고 뉴클레오티드, 지질 및 아미노산의 동화 작용, 철 – 황 클러스터 생물 발생과 같은 필수 세포 생물 에너지 및 대사 과정에 기여하는 구획화 된 소기관이며 통제 된 세포 사멸과 같은 신호 전달에 연루되어 있습니다 1,2,3 . 산화적 인산화를 통한 미토콘드리아 생물에너지학은 세포 내의 거의 모든 세포 과정에 기여하며, 결과적으로, 일차 또는 이차 기원의 미토콘드리아 기능장애는 광범위한 질병 상태 4,5와 연관된다. 미토콘드리아 기능 장애는 구조 또는 미토콘드리아 밀도의 변화뿐만 아니라 호흡기의 질과 조절을 포함합니다6. 이 정성적 요소는 기질 제어, 결합 특성, 번역 후 변형, 크리스타 역학 및 호흡 초복합체 7,8을 포함합니다. 따라서, 세포의 에너지 대사를 평가하기 위한 실험 및 진단 접근법을 위한 미토콘드리아 생물에너지학의 정확한 분석은 건강 및 질병에서 중요하다.
미토콘드리아 산화 인산화 (OXPHOS)는 아데노신 삼인산염 (ATP)9을 통한 세포 에너지의 생성을위한 호흡계 또는 전자 전달 시스템 (ETS) 내의 일련의 반응입니다. 복합체 I 및 II를 통한 전자 흐름으로부터 콤플렉스 IV로의 에너지를 이용하는 다중 효소적 단계는 내부 미토콘드리아 막을 가로질러 전기화학적 양성자 구배를 생성하고, 이어서 복합 V(F1FO ATP 합성효소)를 통해 ATP로의 아데노신 디포스페이트(ADP)의 인산화에 이용된다(도 1A).
먼저, 2개의 전자 담체는 트리카르복실 사이클(TCA), 당분해 및 피루베이트 산화 동안 생성된다: 니코틴아미드 아데닌 디뉴클레오타이드(NADH) 및 디히드로플라빈 아데닌 디뉴클레오타이드(FADH2). NADH는 콤플렉스 I (NADH 탈수소 효소)에서 산화되며, 그 동안 두 개의 전자가 코엔자임 Q로 전달되고 (퀴논은 퀴놀로 환원됨), 양성자는 막간 공간 (IMS)으로 펌핑됩니다. 둘째, 착물 II (숙시네이트 탈수소효소)는 FADH2를 산화시키고 양성자를 펌핑하지 않고 전자를 코엔자임 Q에 공급한다. 셋째, 콤플렉스 III (시토크롬 c 산화환원효소)에서, 코엔자임 Q로부터의 전자는 시토크롬 c로 전달되고, 양성자는 IMS로 펌핑된다. 넷째, 시토크롬 c는 전자를 양성자를 펌핑하는 최종 복합체인 콤플렉스 IV(Cytochrome c oxidase)로 전달하고, 여기서 산소는 양성자를 동화시키는 전자 수용체로서 기능하여 궁극적으로 물을 형성한다. 미토콘드리아가 소비하는 것은 이 산소이며, 이는 옥시그래프로 측정될 수 있다. 마지막으로, 콤플렉스 I, 콤플렉스 III, 및 콤플렉스 IV로부터 생성된 양성자는 콤플렉스 V를 회전시키는데 사용되어, ATP9를 생성한다.
중요하게도, 전자 전달은 선형 방식으로 발생할뿐만 아니라, 그렇지 않으면 전자 수송 사슬로 표시된다. 대신, 전자는 다수의 호흡 경로를 통해 코엔자임 Q 풀로 전달될 수 있고 수렴 전자 흐름을 촉진할 수 있다. NADH-기질 및 숙시네이트는 예를 들어, 각각 콤플렉스 I 및 콤플렉스 II를 통해 들어갈 수 있다. 지방산 산화로부터의 전자는 전자 전달 플라보단백질 복합체를 통해 공여될 수 있다. 실제로 OXPHOS를 포괄적으로 분석하려면 적절한 연료 기판을 사용한 전체적인 접근 방식이 필요합니다(그림 1A).
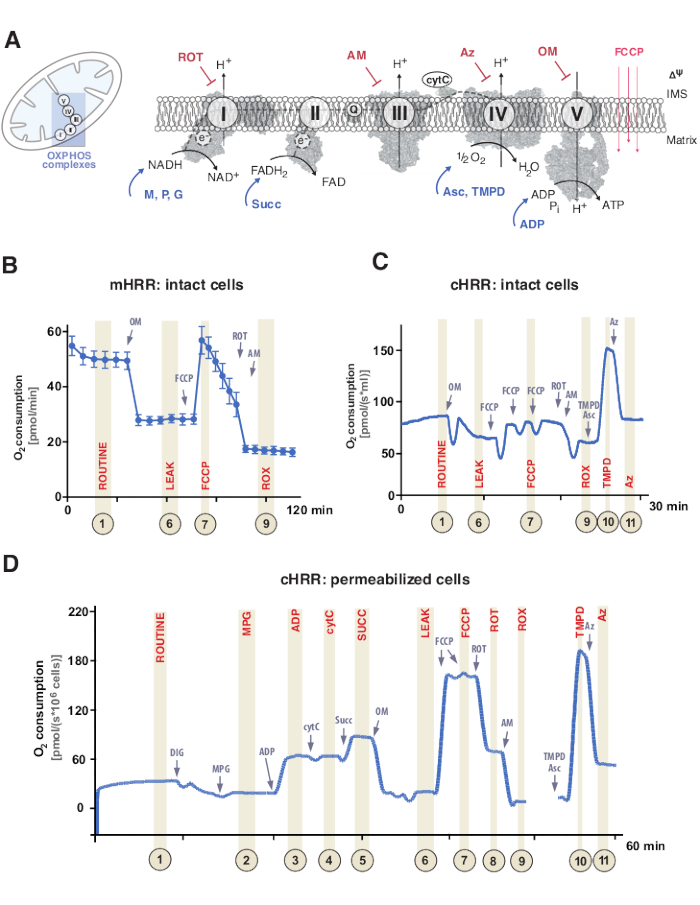
도 1: 미토콘드리아 산화 인산화 및 특정 기질 및 저해제 프로토콜. (A) 미토콘드리온 및 전자 전달 시스템 (CI-CIV) 및 미토콘드리아F1F0ATP 합성 효소 (CV)의 계획. 모든 구조물은 PDB로부터이다. 도면은 본 연구에 기재된 기질 및 억제제만을 묘사한다). (b) mHRR 장치에서 표준 프로토콜을 사용하는 무손상 HEK293 세포에서 산소 플럭스의 샘플 트레이스. (c) cHRR 장치에서 표준 프로토콜을 사용하는 무손상 HEK293 세포에서 산소 플럭스의 샘플 트레이스. (d) 각각의 SUIT 프로토콜을 갖는 건강한 공여자로부터의 투과화된 인간 섬유아세포에서의 산소 플럭스의 샘플 트레이스. 약어: 1 = 손상되지 않은 세포의 일상적인 호흡; 2 = 상태 2; 3 = 상태 3(I); 4 = cytC가 있는 상태 3(I); 5 = 상태 3 (I+II); 6 = 누출(OM); 7 = ETS 용량; 8 = S(ROT); 9 = ROX; 10 = TMPD; 11 = Az. ROT = 로테논, AM = 안티마이신, ATP = 아데노신 트리포스페이트, Az = 아지드, OM = 올리고마이신, FCCP = 카르보닐 시아나이드 파라트리플루오로메톡시페닐히드라존; Asc = 아스코르베이트, TMPD = N,N,N’,N’-테트라메틸-p-페닐렌디아민, Succ = 숙시네이트, M = 말레이트, P = 피루베이트, ADP = 아데노신 디포스페이트, NAD = 니코틴아미드 아데닌 디뉴클레오티드, IMS = 막간 공간, FAD = 플라빈 아데닌 디뉴클레오티드. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
HRR을 이용한 미토콘드리아 OXPHOS 용량 분석은 1차 미토콘드리아 결함10,11뿐만 아니라 암 및 노화 12와 같은 생물학의 다른 모든 영역으로 확장되는 진단 가치의 도구 생화학 적 방법이되었습니다. HRR은 개별 또는 복합 미토콘드리아 호흡 복합체 결핍을 직접 반영하고 간접적으로 세포 기능 장애 및 변경된 에너지 대사와 관련이있는 미토콘드리아 OXPHOS 용량의 분석에 의해 세포 호흡의 결정을 허용합니다9. 방법론적으로, 호흡 측정은 세포, 조직 또는 단리된 미토콘드리아(11,13,14)를 사용하여 수행되며, 동결된 물질은 부분적으로만 적합한 물질(15,16)을 사용한다. 동결 조직은 초복합체 안정성을 유지하는 무손상 ETS를 갖는 것으로 나타났다(15). 따라서, 전통적인 TCA 중간체와는 달리, 각각의 기질은 ETS로 직접 공급된다. 그러나, ETS와 ATP 합성 사이의 결합은 동결 손상(얼음 결정 형성)을 통해 막 완전성이 손상됨에 따라 손실된다.
호흡 실험은 일반적으로 비투과화 또는 투과화된 세포 또는 조직에서 흡열에 대해 37°C의 생리학적 온도에서 일어난다. 전자는 세포질 대사 맥락을 고려하는 반면, 후자는 특정 기질 (및 억제제)의 첨가를 통해 개별 OXPHOS 복합체 및 ATPase의 에너지 적 기여를 제공한다. 기질 및 억제제의 서열 및 변이는 OXPHOS 기능의 다양한 과학적 질문을 다루기 위해 SUIT 프로토콜17 및 분석 18의 다양한 어레이의 개발로 이어졌다 (12에서 검토). 세포 호흡의 기본 프로토콜은 네 가지 다른 상태를 평가합니다 : i) 일상적인 호흡 – 기질이나 억제제를 첨가하지 않고 각각의 호흡 매체에서 호흡하지만 내인성 기질을 소비합니다. 이러한 상태는 예를 들어, 변경된 대사산물 프로파일에 의해 야기된 일반적인 OXPHOS 또는 이차-유도된 호흡 결함을 나타낼 수 있다. 다음으로, ATPase 억제제인 올리고마이신의 첨가는 ii) 누출 호흡으로 정의되는 양성자에 대한 미토콘드리아 내부 막의 투과성을 드러낸다. 언커플러 카르보닐 시아나이드 p-트리플루오로메톡시페닐히드라존(FCCP)과 같은 프로토노포어의 후속 적정은 iii) 결합되지 않은 호흡으로 정의되는 개방 막횡단 양성자 회로 모드에서 ETS 용량이 최대인 상태를 결정할 수 있게 한다. 중요하게도, 결합되지 않은 상태는 또한 미토콘드리아 막에 대한 과도한 기계적 손상을 통한 실험적 개입에 의해 발생할 수 있다. 반대로, 비결합 상태는 생리학적으로 조절되는 내재적 메카니즘에 의해 호흡 언커플링을 지칭한다. 마지막으로, 콤플렉스 III 억제제인 안티마이신 및 콤플렉스 I 억제제 로테논을 첨가함으로써 ETS의 완전한 억제는 비미토콘드리아 산소 소모 공정으로부터의 잔류 산소 소비량(ROX)을 결정한다(도 1A-C).
미토콘드리아 생물에너지학은 다섯 개의 뚜렷한 호흡 상태(19,20)로 구성된다. 상태 1 호흡은 내인성으로 이용가능한 것을 제외하고는 어떠한 추가적인 기질 또는 ADP도 없다. ADP를 첨가한 후에도, 여전히 기질이 없으나, 상태 2 호흡이 달성된다. 기판이 추가되어 전자 전달 및 ATP 합성을 허용하면 상태 3 호흡에 도달합니다. 이 상태에서, OXPHOS 용량은 ADP, 무기 포스페이트, 산소, NADH- 및 숙시네이트-연결된 기질의 포화 농도에서 정의될 수 있다. 상태 4 호흡 또는 LEAK 호흡은 충분한 기질을 가지면서 ADP 또는 화학적으로 억제된 ATP 합성효소가 없는 상태로 정의될 수 있다. 마지막으로, 닫힌 챔버 설정에서 모든 산소가 고갈(anoxic)될 때, 상태 5 호흡이 관찰된다.
실험 모델 및 연구 질문에 따라 상이한 적용성을 갖는 폐쇄 챔버 시스템에서 시간에 따른 산소 감소의 함수로서 측정되는 산소 소비의 분석을 통해 OXPHOS의 현재 실시간 평가를 지배하는 두 개의 장치를 사용하여 세포 에너지 상태(14 )를 평가하기 위한 몇 가지 방법이 존재한다: Oroboros 2k 고분해능 호흡계와 Seahorse XF 세포외 플럭스 분석기. 두 장치 모두 챔버 또는 마이크로플레이트 웰 내의 절대값으로서 초당 산소(O2)의 피코몰(pmol)의 감소로서 산소 소모율을 기록한다. 질량당 특정 산소 소비량은 세포 수(백만), 조직 중량(mg), 또는 단백질 양당 특정 완충 레시피에서 각각의 산소 소비를 정상화함으로써 얻어진다.
O2k(Oroboros Instruments)는 편광 산소 센서(챔버 기반 고해상도 호흡계: cHRR)가 장착된 폐쇄형 2챔버 시스템입니다. 각 실험 챔버는 자기 교반기에 의해 균질하게 유지되는 2 mL의 액체를 보유한다. 편광 산소 센서는 산소를 측정하기 위해 양면계 접근 방식을 사용합니다 : 금 음극, 은/염화은 양극, KCI 용액 사이에 전압(0.8V)이 가해지는 전기화학 전지를 생성합니다. 분석 매질로부터의 산소는 25 μm 플루오르화 에틸렌 프로필렌 막 (O2-투과성)을 통해 확산되고 캐소드에서 환원을 겪고, 과산화수소를 생성한다. 양극에서 은은 과산화수소에 의해 산화되어 전류를 생성합니다. 이러한 전류(암페어)는 분위 산소 압력과 선형적으로 관련된다. 산소의 분압 및 분석 매질의 산소 용해도 인자는 산소 농도를 계산하는데 사용된다. 산소 분압은 실험 온도에 의존하고 편광 측정은 온도에 민감하기 때문에 온도 변동은 펠티에 가열 블록에 의한 정밀한(±0.002°C) 조절이 필요합니다. 온도는 4°C 및 47°C의 범위 내에서 제어될 수 있다.
Seahorse XF 세포외 플럭스 분석기(애질런트)는 24웰 또는 96웰 마이크로플레이트 포맷의 플레이트 기반 시스템으로, 세 개의 형광 전극이 각 웰에서 시간에 따른 산소 소비량을 측정합니다(마이크로플레이트 기반 고분해능 호흡계: mHRR). 분석 카트리지 내의 최대 네 개의 포트는 분석 동안 자동 주입을 위해 이용가능하다. 분석에는 여러 주기가 포함되며, 각 주기에는 1) 혼합, 2) 대기 및 3) 측정의 세 단계가 있습니다. 측정 단계 동안, 센서 프로브는 마이크로플레이트 내로 하강되어 방출된 광을 측정하기 위해 7-10 μL 부피를 포함하는 일시적으로 닫힌 챔버를 생성한다. 이 광은 센서 프로브의 팁에 폴리머 포매된 형광단에 의해 방출되며, 이는 인광 담금질에 기초하여O2 를 감지한다. 형광 신호의 강도는O2 에 비례하고 센서 및 분석 매질의 온도에 의해 영향을 받는다. 따라서, 정확한 산소 추정은 어떠한 샘플도 없이 배경 우물을 갖는 상대적인 접근법을 필요로 한다. 산소 농도 복원은 혼합 단계에서 센서가 임시 챔버 위의 부피를 혼합하기 위해 위아래로 움직일 때 발생합니다. 각 사이클은 하나의 산소 소모율을 계산합니다. 온도는 16°C 및 42°C의 범위 내에서 제어될 수 있다.
HRR은 원발성 및 미토콘드리아 관련 질환 및 일반적인 세포 대사에서 세포 생물 에너지를 평가하는 황금 표준입니다. 이 연구에서는 세포 및 조직에서 OXPHOS 기능을 평가하기 위해 HRR에 대한 기본 프로토콜이 제공됩니다.
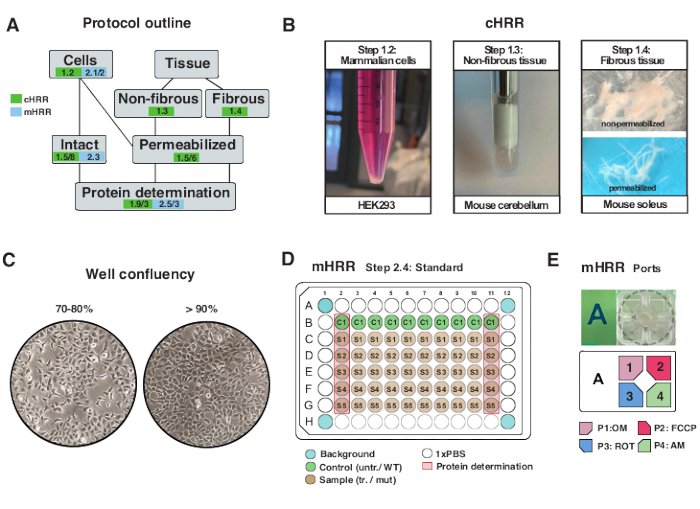
그림 2: cHRR을 위한 세포 및 조직 제제를 위한 워크플로우 및 mHRR 호흡측정을 위한 세포 준비 . (A) 제공된 프로토콜의 개요. (b) 포유동물 세포 (단계 1.2): 3 x 106 세포와 동등한 HEK293 펠릿 (왼쪽 패널). 비섬유성 조직 (단계 1.3): 2 mL 테프론 포터 (중간 패널) 중의 뮤린 소뇌 용해물의 제조. 사포닌-유도된 골격근 투과 (단계 1.4) cHRR 호흡측정을 위한 우측 패널. (c) mHRR 호흡측정법을 위한 표준 마이크로플레이트 시딩 레이아웃(단계 2.4) 및 진핵 세포(HEK293)의 분석을 위한 컨플루언시 확인. (D, E) mHRR 호흡 측정을 위한 주입 포트 로딩 방식(단계 2.4). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Protocol
Representative Results
Discussion
전통적으로 미토콘드리아 생물에너지학은 클락형 산소전극으로 연구되어 왔다. 그러나 해상도와 처리량의 부족은 기술 발전을 보장합니다. 현재까지 O2k (cHRR이라고 함) 및 Seahorse XF96 Flux Analyzer (mHRR이라고 함)는 세포 생물 에너지 분야에서 널리 채택되었습니다. 여기에서는 cHRR 또는 mHRR을 사용하여 미토콘드리아 호흡 평가를 통해 세포 에너지 대사를 분석하기위한 이해할 수있는 프로토콜 모음을…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
이 연구는 핀란드 아카데미 (C.B.J), Magnus Ehrnroot Foundation (C.B.J) 및 통합 생명 과학 대학원 (R.A.)의 박사 학위 펠로우십의 기금으로 지원되었습니다.
Materials
| 2 mL Potter-Elvehjem Glass/PTFE Tissue Grinder/Homogenizer | Omni International | 07-358029 | |
| 95% O2, 5% CO2 medical gas mixture | Potter for tissue grinding | ||
| ADP | Sigma | A 4386 | |
| Antimycin A | Sigma | A 8674 | Chemical |
| Ascorbate | Merck | PHR1279-1G | Chemical, dissolve in ethanol |
| BSA (fatty accid free) | Sigma | A 6003 | Chemical |
| CaCO3 | Sigma | C 4830 | Chemical |
| Cytochrome c | Sigma | C 7752 | Chemical |
| Digitonin | Sigma | D 5628 | Chemical |
| Dithiothreitol | Sigma | D 0632 | Chemical, dissolve in DMSO |
| D-Sucrose | Roth | 4621.1 | Chemical |
| Dulbecco’s modified Eagle’s medium (High glucose) | Fisher Scientific | 41965-039 | Chemical |
| Dulbecco’s modified Eagle’s medium (No Glucose) | Fisher Scientific | A14430-01 | |
| EGTA | Sigma | E 4378 | |
| Etomoxir | Sigma | E1905 | Chemical |
| Falcon 15 ml Conical Centrifuge Tubes | Fisher Scientific | AM12500 | Chemical |
| Falcon 50 ml Conical Centrifuge Tubes | Fisher Scientific | AM12501 | |
| FCCP | Sigma | C 2920 | |
| Glucose | Sigma | G7021 | Chemical, dissolve in ethanol |
| Glutamate | Sigma | G 1626 | Chemical |
| GlutaMax (100x) (200 nM L-alanyl-L-glutamine dipeptide) | Fisher Scientific | 35050061 | Chemical |
| HEK293 cells | ATTC | CRL-1573 | |
| Hemocytometer | Fisher Scientific | 0267151B | Instrument for cell counting |
| Hepes | Sigma | H 7523 | Chemical |
| Imidazole | Fluka | 56750 | Chemical |
| KCl | Merck | 1.04936 | Chemical |
| L-carnitine | Sigma | C0283 | Chemical |
| Malate | Sigma | M 1000 | Chemical |
| MES hydrate | Sigma | M8250 | Chemical |
| MgCl2 | Sigma | M 9272 | Chemical |
| Na2ATP | Sigma | A 2383 | Chemical |
| Na2Phosphocreatine | Sigma | P 7936 | Chemical |
| Na-pyruvate (100 mM) (100x) | Fisher Scientific | 11360070 | |
| NEAA (Non-essential amino acids) 100x | Fisher Scientific | 11140035 | |
| Normal FBS (10x) | Fisher Scientific | 10500064 | |
| O2k-Core: Oxygraph-2k | Oroboros Instruments | 10000-02 | High-resolution respirometry instrument |
| O2k-Titration Set | Oroboros Instruments | 20820-03 | Hamilton syringes for chemical injections |
| Oligomycin | Sigma | O 4876 | Chemical, dissolve in ethanol |
| Palmitoylcarnitine | Sigma | P 4509 | Chemical |
| Penicillin-Streptomycin | Fisher Scientific | 15140122 | |
| Pierce BCA Protein Assay Kit | Fisher Scientific | 23227 | |
| Pyruvate | Sigma | P 2256 | Chemical |
| RIPA-Buffer | Fisher Scientific | 89900 | Chemical |
| Rotenone | Sigma | R 8875 | Chemical, dissolve in ethanol |
| Saponin | Sigma | S7900 | Chemical |
Seahorse XF DMEM assay medium pack, pH 7.4 |
Agilent, Santa Clara, CA |
103680-100 | |
| Seahorse XFe96 Extracellular Flux Analyzer | Agilent, Santa Clara, CA |
High-throughput respirometry instrument | |
| Seahorse XFe96 FluxPak | Agilent, Santa Clara, CA |
Includes assay plates, cartridges, loading guides for transferring compounds to the assay cartridge, and calibrant solution. |
|
| Small scissors | Fisher Scientific | 08-951-20 | |
| Sodium azide | Sigma | S2002 | Chemical |
| Succinate | Sigma | S 2378 | Chemical |
| Taurine | Sigma | T 8691 | Chemical |
| TMPD | Sigma | T 3134 | Chemical |
| Trypan Blue solution | Merck | 72-57-1 | Chemical |
| Trypsin 0.25% EDTA | Fisher Scientific | 25200056 | |
| Two thin-edged forceps | Fisher Scientific | 12-000-122 | |
| Uridine stock (500x) | Sigma | U3750 | Chemical |
Riferimenti
- McBride, H. M., Neuspiel, M., Wasiak, S. Mitochondria: More than just a powerhouse. Current Biology. 16 (14), 551-560 (2006).
- Mehta, M. M., Weinberg, S. E., Chandel, N. S. Mitochondrial control of immunity. Beyond ATP. Nature Reviews Immunology. 17 (10), 608-620 (2017).
- Spinelli, J. B., Haigis, M. C. The multifaceted contributions of mitochondria to cellular metabolism. Nature Cell Biology. 20 (7), 745-754 (2018).
- Gnaiger, E. Capacity of oxidative phosphorylation in human skeletal muscle. New perspectives of mitochondrial physiology. International Journal of Biochemistry and Cell Biology. 41 (10), 1837-1845 (2009).
- Gorman, G. S., et al. Mitochondrial diseases. Nature Reviews Disease Primers. 2, 1-23 (2016).
- Boushel, R., Gnaiger, E., Schjerling, P., Skovbro, M., Kraunsøe, R., Dela, F. Patients with type 2 diabetes have normal mitochondrial function in skeletal muscle. Diabetologia. 50 (4), 790-796 (2007).
- Cogliati, S., et al. Mitochondrial cristae shape determines respiratory chain supercomplexes assembly and respiratory efficiency. Cell. 155 (1), 160-171 (2013).
- Kühlbrandt, W. Structure and function of mitochondrial membrane protein complexes. BMC Biology. 13, 1-11 (2015).
- Gnaiger, E. Mitochondrial pathways and Respiratory control. An introduction to OXPHOS analysis. Bioenergetics communications. 5th ed. , (2020).
- Jackson, C. B., et al. Mutations in SDHD lead to autosomal recessive encephalomyopathy and isolated mitochondrial complex II deficiency. Journal of Medical Genetics. 51 (3), 170-175 (2014).
- Pesta, D., Gnaiger, E. High-resolution respirometry: OXPHOS protocols for human cells and permeabilized fibers from small biopsies of human muscle. Methods in Molecular Biology. 810, 25-58 (2012).
- Horan, M. P., Pichaud, N., Ballard, J. W. O. Review: Quantifying mitochondrial dysfunction in complex diseases of aging. Journals of Gerontology – Series A Biological Sciences and Medical Sciences. 67 (10), 1022-1035 (2012).
- Doerrier, C., Garcia-Souza, L. F., Krumschnabel, G., Wohlfarter, Y., Mészáros, A. T., Gnaiger, E. High-resolution fluorespirometry and oxphos protocols for human cells, permeabilized fibers from small biopsies of muscle, and isolated mitochondria. Methods in Molecular Biology. 1782, 31-70 (2018).
- Zhang, J., et al. Measuring energy metabolism in cultured cells, including human pluripotent stem cells and differentiated cells. Nature Protocols. 7 (6), 1068-1085 (2012).
- García-Roche, M., Casal, A., Carriquiry, M., Radi, R., Quijano, C., Cassina, A. Respiratory analysis of coupled mitochondria in cryopreserved liver biopsies. Redox Biology. 17, 207-212 (2018).
- Acin-Perez, R., et al. A novel approach to measure mitochondrial respiration in frozen biological samples. The EMBO Journal. 39 (13), 1-18 (2020).
- Cell metabolism assay kits. Seahorse assay kits and media Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-lits-reagents-cell-assay-media (2021)
- Chance, B., Williams, G. R. A method for the localization of sites for oxidative phosphorylation. Nature. 176 (4475), 250-254 (1955).
- Gnaiger, E., et al. Mitochondrial respiratory states and rates. MitoFit Preprint Arch. , (2019).
- Gnaiger, E. O2k-procedures: SOP O2k quality control 1: Polarographic oxygen sensors and accuracy of calibration Section Page. Oroboros. 03 (18), 1-21 (2020).
- Robinson, B. H., Petrova-Benedict, R., Buncic, J. R., Wallace, D. C. Nonviability of cells with oxidative defects in galactose medium: A screening test for affected patient fibroblasts. Biochemical Medicine and Metabolic Biology. 48 (2), 122-126 (1992).
- King, M. P., Attardi, G. Human cells lacking mtDNA: Repopulation with exogenous mitochondria by complementation. Science. 246 (4929), 500-503 (1989).
- Makrecka-Kuka, M., Krumschnabel, G., Gnaiger, E. High-resolution respirometry for simultaneous measurement of oxygen and hydrogen peroxide fluxes in permeabilized cells, tissue homogenate and isolated mitochondria. Biomolecules. 5 (3), 1319-1338 (2015).
- Fasching, M., Gnaiger, E. O2k quality control 2: Instrumental oxygen background correction and accuracy of oxygen flux. Mitochondrial Physiology Network. 14 (06), 1-14 (2016).
- Gnaiger, E., Lassnig, B., Kuznetsov, A., Rieger, G., Margreiter, R. Excess capacity of cytochrome c oxidase. Journal of Experimental Biology. 1139, 1129-1139 (1998).
- Gnaiger, E., et al. Mitochondria in the Cold. Life in the Cold. , 431-442 (2000).
- Fontana-Ayoub, M., Fasching, E., Gnaiger, Selected media and chemicals for respirometry with mitochondrial preparations. Mitochondrial Physiology Network. 02 (17), 1-9 (2014).
- Gerencser, A. A., et al. Quantitative microplate-based respirometry with correction for oxygen diffusion. Analytical Chemistry. 81 (16), 6868-6878 (2009).
- Krumschnabel, G., Eigentler, A., Fasching, M., Gnaiger, E. Use of safranin for the assessment of mitochondrial membrane potential by high-resolution respirometry and fluorometry. Methods in Enzymology. 542, 163-181 (2014).
- Nászai, A., Terhes, E., Kaszaki, J., Boros, M., Juhász, L. Ca(2+)N it be measured? Detection of extramitochondrial calcium movement with high-resolution fluorespirometry. Scientific Reports. 9 (1), 1-13 (2019).
- Pajak, B., et al. 2-Deoxy-d-Glucose and its analogs: From diagnostic to therapeutic agents. International Journal of Molecular Sciences. 21 (1), 234 (2019).
- Mercier-Letondal, P., Marton, C., Godet, Y., Galaine, J. Validation of a method evaluating T cell metabolic potential in compliance with ICH Q2 (R1). Journal of Translational Medicine. 19 (1), 1-15 (2021).
- Sauerbeck, A., et al. Analysis of regional brain mitochondrial bioenergetics and susceptibility to mitochondrial inhibition utilizing a microplate based system. Journal of Neuroscience Methods. 198 (1), 36-43 (2011).
- Jackman, M. R., Willis, W. T. Characteristics of mitochondria isolated from type I and type IIb skeletal muscle. American Journal of Physiology – Cell Physiology. 270 (2), 673-678 (1996).
- Ponsot, E., et al. Mitochondrial tissue specificity of substrates utilization in rat cardiac and skeletal muscles. Journal of Cellular Physiology. 203 (3), 479-486 (2005).
- Schönfeld, P., Reiser, G. Why does brain metabolism not favor burning of fatty acids to provide energy-Reflections on disadvantages of the use of free fatty acids as fuel for brain. Journal of Cerebral Blood Flow and Metabolism. 33 (10), 1493-1499 (2013).
- Calderon-Dominguez, M., Mir, J. F., Fucho, R., Weber, M., Serra, D., Herrero, L. Fatty acid metabolism and the basis of brown adipose tissue function. Adipocyte. 5 (2), 98-118 (2016).
- Divakaruni, A. S., Rogers, G. W., Murphy, A. N. Measuring mitochondrial function in permeabilized cells using the seahorse XF analyzer or a clark-type oxygen electrode. Current Protocols in Toxicology. 2014, 1-16 (2014).
- Iuso, A., Repp, B., Biagosch, C., Terrile, C., Prokisch, H. Assessing mitochondrial bioenergetics in isolated mitochondria from various mouse tissues using Seahorse XF96 analyzer. Methods in Molecular Biology. 1567, 217-230 (2017).
- Rogers, G. W., et al. High throughput microplate respiratory measurements using minimal quantities of isolated mitochondria. PLoS ONE. 6 (7), 21746 (2011).
- Jordá, A., Zaragozá, R., Portolés, M., Báguena-Cervellera, R., Renau-Piqueras, J. Long-term high-protein diet induces biochemical and ultrastructural changes in rat liver mitochondria. Archives of Biochemistry and Biophysics. 265 (2), 241-248 (1988).
- Jackson, C. B., Gallati, S., Schaller, A. QPCR-based mitochondrial DNA quantification: Influence of template DNA fragmentation on accuracy. Biochemical and Biophysical Research Communications. 423 (3), 441-447 (2012).
- Hirsch, H. M. Tissue autoxidation inhibitors: II. The presence of inhibitor in intact cells; Assay of liver and hepatoma effect on radio-oxidations. Ricerca sul cancro. 16 (11), 1076-1082 (1956).
- Picard, M., et al. Mitochondrial structure and function are disrupted by standard Isolation methods. PLoS ONE. 6 (3), 18317 (2011).
- Tanumihardja, E., Slaats, R. H., Van Der Meer, A. D., Passier, R., Olthuis, W., Van Den Berg, A. Measuring both pH and O2 with a single On-Chip sensor in cultures of human pluripotent stem cell-derived cardiomyocytes to track induced changes in cellular metabolism. ACS Sensors. 6 (1), 267-274 (2021).
- Harms, F., Stolker, R. J., Mik, E. Cutaneous respirometry as novel technique to monitor mitochondrial function: A feasibility study in healthy volunteers. PLoS ONE. 11 (7), 159544 (2016).
- Levitsky, Y., et al. Micro-respirometry of whole cells and isolated mitochondria. RSC Advances. 9 (57), 33257-33267 (2019).

