실시간 세포 대사 플럭스 분석기를 사용하여 조골세포 생물에너지 모니터링
Summary
실시간 세포 대사 플럭스 분석은 pH 및 산소 센서를 사용하여 미토콘드리아 및 글리콜 아데노신 삼인산염 생산에 해당하는 산소 소모율 및 세포외 산성화 속도를 측정합니다. 원고는 조골 세포의 에너지 상태와 세포 생물 에너지 상태의 특성화 및 해석을 이해하는 방법을 설명합니다.
Abstract
조골 세포에 의한 뼈 형성은 골격 항상성을 유지하고 궁극적으로 골절을 예방하기 위해 적절한 뼈 획득 및 뼈 회전율을위한 필수 과정입니다. 피크 골량을 최적화하고 다양한 근골격계 질환 (즉, 폐경 후 골다공증, 신경성 식욕 부진증, 제 1 형 및 2 형 당뇨병)과 싸우기 위해 골 생물학 분야에서 놀라운 노력이 이루어졌으며 분화 과정 전반에 걸쳐 조골 세포를 완전히 특성화했습니다. 매트릭스 단백질과 미네랄화 소포를 분비하는 성숙한 조골세포의 주된 역할을 감안할 때, 이러한 과정은 엄청난 양의 세포 에너지 또는 아데노신 삼인산염 (ATP)을 필요로한다는 것이 주목 받았다. 전반적인 세포 에너지 상태는 종종 세포 생물 에너지 요법이라고하며, 세포 요구를 충족시키기 위해 ATP를 유도하기 위해 기질 가용성을 감지하는 일련의 대사 반응을 포함합니다. 따라서, 현재의 방법은 원발성 뮤린 골수 기질 세포 (BMSCs)를 분리하고 조골 세포 분화의 다양한 단계에서 실시간 세포 대사 플럭스 분석기를 사용하여 생체 에너지 상태를 모니터링하는 과정을 자세히 설명합니다. 중요하게도, 이러한 데이터는 대사 프로파일이 조골세포 분화 전반에 걸쳐 극적으로 변화한다는 것을 입증하였다. 따라서, 이러한 생리학적으로 관련된 세포 유형을 사용하는 것은 세포의 생물에너지 상태가 어떻게 전체 기능을 조절할 수 있는지를 완전히 인식하기 위해 요구된다.
Introduction
조골 세포에 의한 뼈의 형성은 파골 세포에 의한 뼈의 조정 된 파괴 또는 재 흡수를 동반합니다. 조골 세포 뼈 형성과 파골세포 재 흡수 사이의 균형은 골격 항상성에 필수적인 뼈 회전율 또는 리모델링을 설명하는 결합 과정입니다. 조골 세포 기능 장애는 뼈 형성 장애를 일으키고 골다공증 1,2,3을 포함한 다양한 질병을 초래합니다. 골수 기질 줄기 세포 (BMSCs)를 조골 세포 전구체 및 성숙 조골 세포로의 Ex vivo / in vitro 분화는 시간이 지남에 따라 배양 용기에서 미네랄 화 된 골 매트릭스의 형성 및 침착을 초래합니다 4,5,6. 조골 세포에 의한 이러한 뼈 형성은 상당한 양의 세포 에너지를 필요로합니다. 구체적으로, 콜라겐 합성 및 분비는 세포 ATP에 크게 의존하는 것으로 나타났다 : ADP 비율, 그리고 아마도, 미네랄화 된 소포 밀매 및 분비는 추가적인 ATP 7,8,9,10,11을 필요로한다. 많은 연구자들은 조골 세포 생성 및 조골 세포 기능의 과정이 뼈 형성12,13,14,15,16의 대사 요구를 충족시키기 위해 적절한 에너지 공급을 필요로한다는 것을 입증했습니다. 따라서, 이 방법의 목표는 실시간 세포 대사 플럭스 분석기를 사용하여 조골세포 분화 전반에 걸쳐 일차, 뮤린 기질 세포의 생체에너지 상태를 특성화하는 것이다. 이러한 기술은 골격 항상성에 대한 더 나은 이해를 개발하는 데 도움이되며, 이는 궁극적으로 골격 장애를 개선 할 수있는 새로운 치료 옵션의 개발로 이어질 수 있습니다.
실시간 세포 대사 플럭스 분석기는 각각 미토콘드리아 및 글리콜 ATP 생산에 해당하는 살아있는 조골세포의 산소 소모율(OCR) 및 세포외 산성화 속도(ECAR)를 측정하는 데 사용할 수 있습니다. 이 방법론의 기본은 포도당이 젖산으로 전환되는 동안 젖산 당 하나의 H + 이온이 방출되어 ECAR 값에 반영된 매체 pH를 변경한다는 사실입니다. 반대로, TCA(트리카르복실산) 사이클 동안, 미토콘드리아를 통한 산화적 인산화는 산소를 이용하거나 소비함으로써CO2를 생성하고, 따라서 OCR을 모니터링하는 것은 이러한 대사 과정을 반영한다. 분석기는 세포 외 미세 환경에서 OCR과 ECAR을 동시에 실시간으로 측정하여 세포 생물 에너지 6,17을 연구 할 때 엄청난 잠재력을 허용합니다. 또한 이러한 분석을 수행하는 것은 실험 목표에 따라 비교적 간단하고 쉽게 사용자 정의 할 수 있습니다. 유사한 기술들이 면역계(18,19), 암 개시 및 진행(20)의 T-세포 대사 조절, 대사 증후군(21,22)에 기여하는 다수의 다른 세포 유형들을 더 이해하기 위해 이용되었다.
대체 기술에 비해 실시간 대사 플럭스 분석기의 장점은 (1) 살아있는 세포의 세포 생체 에너지를 실시간으로 측정 할 수있는 능력, (2) 상대적으로 적은 수의 세포로 분석을 수행 할 수있는 능력 (5,000 세포만큼 낮은 필요), (3) 고처리량 96-well 시스템에서 여러 치료법을 병렬로 조작하는 주입 포트, (4) 정상화를 위해 방사성 표지가없는 자동화 된 세포 이미저의 사용18, 23,24년. 다음의 방법은 분석기를 사용하여 조골세포 분화 전반에 걸쳐 뮤린 BMSCs에서 세포 생물에너지를 모니터링하는 일반화되었지만 상세한 설명을 제공하는 것을 목표로 한다. 일상적으로 수행되는 분석이 포함될 것이며; 그러나 많은 기술과 방법과 마찬가지로 개별 실험실에서 실험에 대한 구체적인 세부 사항을 결정하는 것이 좋습니다.
분석 및 다양한 유형의 분석 가능: 실험 결과의 신뢰성과 일관성을 보장하면서 세포의 생물에너지를 연구하기 위해 다양한 분석 키트 및 시약을 사용할 수 있습니다. 또한 데스크탑 소프트웨어는 쉽게 사용자 정의 할 수있는 분석 템플릿을 제공합니다. 상기 분석은 상이한 대사 파라미터를 측정하기 위한 사용자의 요구에 기초하여 정의될 수 있다. 이러한 분석은 실험 목표 및/또는 과학적 질문에 기초하여 다양한 방식으로 변형될 수 있다. 예를 들어, 네 개의 주사 포트로, 다수의 화합물이 분석 배지에 주입되어 각각의 대사 경로에 특이적인 세포 반응을 분석할 수 있다.
세포 에너지 표현형 시험: 이 분석은 살아있는 세포의 대사 표현형과 대사 잠재력을 측정합니다. 이 분석은 또한 경로 특이적 신진 대사에 대한 일반화 된 아이디어를 얻는 첫 번째 단계로 권장됩니다. ATP 합성효소의 억제제인 올리고마이신 A와 카보닐시아나이드 4-(트리플루오로메톡시)페닐히드라존(FCCP)-미토콘드리아 언커플링제의 혼합물이 세포 에너지 잠재력을 이해하기 위해 주입된다. 올리고마이신 A의 주입은 ATP의 합성을 억제하여, 세포가 그들의 에너지 요구를 충족시킬 수 있도록 당분해 속도(ECAR)의 증가를 초래한다; 한편, FCCP의 주입은 미토콘드리아 막의 탈분극으로 인해 더 높은 OCR을 초래한다. 본질적으로,이 분석은 기초 대사 호흡을 묘사하고, 이중 주사, 푸시 또는 스트레스에 이어 대사 반응을 묘사합니다. 이러한 파라미터에 기초하여, 소프트웨어는 시간25,26에 따라 세포를 호기성, 정지, 글리콜 또는 에너지 상태로 분류함으로써 세포의 OCR 및 ECAR을 플로팅한다.
ATP 실시간 생산 속도 분석 : 이것은 글리코 분해와 미토콘드리아 호흡으로부터 동시에 세포 ATP 생산을 측정합니다. 이 분석은 두 가지 에너지 경로로부터의 대사 이동을 정량적으로 측정하고 시간에 따른 미토콘드리아 및 글리콜 ATP 생산 속도에 대한 데이터를 제공합니다. 이 분석은 기저 OCR 및 ECAR 데이터를 얻은 다음 로테논 + 안티마이신 A 혼합물의 주입을 통한 올리고마이신 A와 글리콜 ATP 생산 비율 (미토콘드리아 기능의 총 억제)의 주입을 통해 미토콘드리아 ATP 생성률을 계산하여 미토콘드리아 산성화17,27을 초래합니다.
세포 미토콘드리아 스트레스 테스트 (또는 세포 미토 스트레스 테스트) : 이것은 ATP와 연결된 호흡을 통해 미토콘드리아 기능을 측정하고, 세포 생물 에너지를 정량화하고, 미토콘드리아 기능 장애를 확인하고, 스트레스에 대한 세포의 반응을 측정합니다. 기저 및 예비 호흡 용량, ATP 연결 호흡, 최대 호흡 및 비미토콘드리아 산소 소비를 포함하는 다양한 파라미터가 하나의 분석에서 수득될 수 있다. 이 분석은 올리고마이신 A, FCCP (미토콘드리아 비커플링제), 로테논/안티마이신 A 억제제의 혼합물의 순차적 주사를 수반하여 미토콘드리아 기능에 대한 이들의 효과를 효율적으로 분석한다28.
유연성 미토 연료 플렉스 테스트 : 이것은 그들의 억제제의 존재 및 부재에 의해 세 가지 일차 미토콘드리아 연료의 산화에 의해 미토콘드리아 호흡 속도를 측정한다. 포도당, 글루타민 및 지방산의 순차적 억제는 세포의 의존성, 용량 및 유연성과 다양한 세포 경로에서 세포의 의존성을 측정하여 에너지 수요를 충족시키는 데 도움이됩니다. 미토콘드리아가 다른 연료를 산화시켜 차단된 관심 경로의 요구를 충족시킬 수 없을 때, 세포는 의존성 상태로 들어간다. 세포의 용량은 관심있는 경로의 억제에 이어 다른 두 가지 대안적인 경로의 억제에 의해 계산된다. 세포의 유연성은 억제 된 경로의 연료 요구를 보상하고 충족시키는 미토콘드리아의 능력을 이해하는 데 도움이됩니다. 그것은 세포의 용량에서 세포의 의존성을 뺀 것으로 계산됩니다. 세 가지 상이한 억제제가 독립적으로 또는 두 개의 혼합물로서 사용되어 분석 파라미터를 효과적으로 계산한다. 2-시아노-3-(1-페닐-1H-인돌-3-일)-2-프로페노산(UK5099)은 당분해에서 피루베이트 담체를 차단함으로써 글루코스의 산화를 억제한다. 비스-2-(5-페닐아세트아미도-1,3,4-티아디아졸-2-일)(BPTES) 에틸 설파이드는 글루타민 산화 경로를 억제하고, 에토목시르는 장쇄 지방산29의 산화를 억제한다.
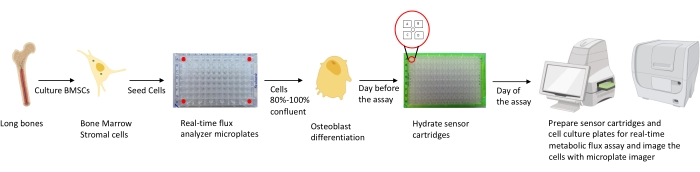
그림 1 : 분석을 위해 조골세포를 배양하고 준비하기위한 방법론의 개략적 표현. 뮤린 BMSC는 긴 뼈에서 분리되고, 배양되고, 25,000 세포/웰 밀도의 96-웰 플레이트에 시딩된다. 조골세포 특이적 배지에서 이들 세포를 배양하는 것은 이들이 분화를 시작하기 위해 80%-100% 컨플루언시에 도달할 때 시작된다. 분석은 분화의 다른 단계에서 수행된다. 카트리지 플레이트는 분석 하루 전에 수화된다. 분석 당일, 분석 요구 사항에 따라 센서 카트리지의 포트에 다른 억제제가 주입되고 교정 버퍼가 96-웰 교정 플레이트에 추가됩니다. 교정 후, 실시간 세포 대사 플럭스 분석이 수행되고, 이어서 마이크로플레이트 이미저를 사용하여 세포 배양 마이크로플레이트를 이미징하여 실시간 세포 대사 플럭스 분석기 데이터를 세포 수로 정규화한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Protocol
Representative Results
Discussion
실시간 세포 대사 플럭스 분석기는 다양한 조건에서 세포 에너지를 탐색하는 데 사용할 수 있습니다. 이 프로토콜은 BMSCs의 효율적인 단리, 적절한 세포 배양 플레이트에서 세포 배양, 성숙 조골세포로의 분화를 보여주며, 이는 세포외 플럭스 분석기를 사용하는 다양한 분석에 사용될 수 있다. 또한, 센서 카트리지의 수화, 주입 포트의 로딩, 분석 수행, 데이터의 정규화 및 데이터 분석을 포함한 ?…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
이 연구는 국립 보건원 (NIH) 국립 관절염 및 근골격계 및 피부 질환 연구소 (NIAMS) 그랜트 AR072123 및 국립 노화 연구소 (NIA) 그랜트 AG069795 (ERR)의 지원을 받았다.
Materials
| 0.25% Trypsin EDTA | Sigma-Aldrich | T4049 | |
| 2-cyano-3-(1-phenyl-1H-indol-3-yl)-2-propenoic acid | Sigma – Aldrich | PZ0160 | UK5099 |
| Antimycin A | Sigma – Aldrich | A8674 | |
| Ascorbic acid | Sigma-Aldrich | A4544-100G | |
| Bis-2-(5-phenylacetamido-1,3,4-thiadiazol-2-yl)ethyl sulfide | Sigma – Aldrich | SML0601 | BPTES |
| Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone | Sigma – Aldrich | C2920 | FCCP |
| Cytation 5 imaging reader | BioTek | N/A | Microplate imager |
| Etomoxir sodium salt hydrate | Sigma – Aldrich | E1905 | |
| Hoechst 33342 Solution (20 mM) | Thermo Scientific | 62249 | |
| Insulin | Sigma – Aldrich | I6634 | |
| Oleic Acid-Albumin from bovine serum | Sigma – Aldrich | O3008 | |
| Oligomycin A – 5 mg | Sigma – Aldrich | 75351 | |
| Rotenone | Sigma – Aldrich | R8875-1G | |
| Seahorse XF 1.0 M Glucose Solution | Agilent Technologies | 103577-100 | |
| Seahorse XF 100mM Pyruvate Solution | Agilent Technologies | 103578-100 | |
| Seahorse XF 200mM Glutamine solution | Agilent Technologies | 103579-100 | |
| Seahorse XF DMEM media | Agilent Technologies | 103575-100 | DMEM assay media eith 5mM HEPES, pH 7.4, without phenol red, sodium bicarbonate, glucose, pyruvate, and L-glutamine |
| Seahorse XFe96 Analyzer | Agilent Technologies | S7800B | Real- Time Metabolic flux analyzer |
| Seahorse XFe96 FluxPak | Agilent Technologies | 102416-100 | Includes XFe96 Sensor cartridges, Cell culture microplates, and Seahorse XF Calibrant solution |
| The Cell imaging 1.1.0.11 software | Agilent Technologies – BioTek | ||
| Wave software 2.6.1 | Agilent Technologies | ||
| β-glycerol phosphate | Sigma-Aldrich | G9422-50G |
Riferimenti
- Rodan, G. A. Bone homeostasis. Proceedings of the National Academy of Sciences of the United States of America. 95 (23), 13361-13362 (1998).
- Nakahama, K. I. Cellular communications in bone homeostasis and repair. Cellular and Molecular Life Sciences. 67 (23), 4001-4009 (2010).
- Kim, J. M., Lin, C., Stavre, Z., Greenblatt, M. B., Shim, J. H. Osteoblast-osteoclast communication and bone homeostasis. Cells. 9 (9), 2073 (2020).
- Gao, J., et al. SIRT3/SOD2 maintains osteoblast differentiation and bone formation by regulating mitochondrial stress. Cell Death and Differentiation. 25 (2), 229-240 (2018).
- Baron, R. Molecular mechanisms of bone resorption by the osteoclast. The Anatomical Record. 224 (2), 317-324 (1989).
- Tian, L., Rosen, C. J., Guntur, A. R. Mitochondrial Function and Metabolism of Cultured Skeletal Cells. Methods in Molecular Biology. 2230, 437-447 (2021).
- Zanotelli, M. R., et al. Regulation of ATP utilization during metastatic cell migration by collagen architecture. Molecular Biology of the Cell. 29 (1), 1-9 (2018).
- Gonzales, S., Wang, C., Levene, H., Cheung, H. S., Huang, C. Y. C. ATP promotes extracellular matrix biosynthesis of intervertebral disc cells. Cell and Tissue Research. 359 (2), 635-642 (2015).
- Kruse, N. J., Bornstein, P. The metabolic requirements for transcellular movement and secretion of collagen. Journal of Biological Chemistry. 250 (13), 4841-4847 (1975).
- Rendina-Ruedy, E., Guntur, A. R., Rosen, C. J. Intracellular lipid droplets support osteoblast function. Adipocyte. 6 (3), 250-258 (2017).
- Sinnott-Armstrong, N., et al. A regulatory variant at 3q21.1 confers an increased pleiotropic risk for hyperglycemia and altered bone mineral density. Cell Metabolism. 33 (3), 615-628 (2021).
- Esen, E., Lee, S. Y., Wice, B. M., Long, F. PTH promotes bone anabolism by stimulating aerobic glycolysis via IGF signaling. Journal of Bone and Mineral Research. 30 (11), 1959-1968 (2015).
- Borle, A. B., Nichols, N., Nichols, G. Metabolic studies of bone in vitro: I. Normal bone. Journal of Biological Chemistry. 235, 1206-1210 (1960).
- Borle, A. B., Nichols, N., Nichols, G. Metabolic studies of bone in vitro: II. The metabolic patterns of accretion and resorption. Journal of Biological Chemistry. 235, 1211-1214 (1960).
- Adamek, G., Felix, R., Guenther, H. L., Fleisch, H. Fatty acid oxidation in bone tissue and bone cells in culture. Characterization and hormonal influences. The Biochemical Journal. 248 (1), 129-137 (1987).
- Frey, J. L., et al. Wnt-Lrp5 signaling regulates fatty acid metabolism in the osteoblast. Molecular and Cellular Biology. 35 (11), 1979-1991 (2015).
- Romero, N., Rogers, G., Neilson, A., Dranka, B. P. . Quantifying cellular ATP production rate using agilent seahorse XF technology. , (2018).
- vander Windt, G., Chang, C., Pearce, E. Measuring bioenergetics in T cells using a Seahorse Extracellular Flux Analyzer. Current Protocols in Immunology. 113, 1 (2016).
- Traba, J., Miozzo, P., Akkaya, B., Pierce, S. K., Akkaya, M. An optimized protocol to analyze glycolysis and mitochondrial respiration in lymphocytes. Journal of Visualized Experiments:JoVE. (117), e54918 (2016).
- Noel, P., et al. Preparation and metabolic assay of 3-dimensional spheroid co-cultures of pancreatic cancer cells and fibroblasts. Journal of Visualized Experiments:JoVE. (126), e56081 (2017).
- Nicholls, D., et al. Bioenergetic profile experiment using C2C12 myoblast cells. Journal of Visualized Experiments: JoVE. (46), e2511 (2010).
- Sakamuri, S. S. V. P., et al. Measurement of respiratory function in isolated cardiac mitochondria using Seahorse XFe24 Analyzer: applications for aging research. GeroScience. 40 (3), 347-356 (2018).
- . What are the advantages of using Seahorse XF technology Available from: https://wwwagilent.com/en/support/cell-analysis/advantages-of-using-xf-tech (2018)
- Horan, M. P., Pichaud, N., Ballard, J. W. O. Review: Quantifying mitochondrial dysfunction in complex diseases of aging. Journals of Gerontology – Series A Biological Sciences and Medical Sciences. 67 (10), 1022-1035 (2012).
- . XF cell energy phenotype test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740884 (2021)
- Leung, D. T. H., Chu, S. Measurement of oxidative stress: Mitochondrial function using the seahorse system. Methods in Molecular Biology. 1710, 285-293 (2018).
- . XF ATP rate assay Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740889 (2021)
- . XF cell mito stress test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740885 (2021)
- . XF cell mito fuel flex test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740888 (2021)
- Maridas, D. E., Rendina-Ruedy, E., Le, P. T., Rosen, C. J. Isolation, culture, and differentiation of bone marrow stromal cells and osteoclast progenitors from mice. Journal of Visualized Experiments: JoVE. (131), e56750 (2018).
- Wei, J., et al. Glucose uptake and Runx2 synergize to orchestrate osteoblast differentiation and bone formation. Cell. 161 (7), 1576-1591 (2015).
- Zoch, M. L., Abou, D. S., Clemens, T. L., Thorek, D. L. J., Riddle, R. C. In vivo radiometric analysis of glucose uptake and distribution in mouse bone. Bone Research. 4, 16004 (2016).
- Divakaruni, A. S., Paradyse, A., Ferrick, D. A., Murphy, A. N., Jastroch, M. Analysis and interpretation of microplate-based oxygen consumption and pH data. Methods in Enzymology. 547, 309-354 (2014).
- Kam, Y., Jastromb, N., Clayton, J., Held, P., Dranka, B. . Normalization of agilent seahorse XF data by in-situ cell counting using a BioTek cytation 5 application note. , (2017).

