Uso del analizador de flujo metabólico celular en tiempo real para monitorear la bioenergética de osteoblastos
Summary
El ensayo de flujo metabólico celular en tiempo real mide la tasa de consumo de oxígeno y la tasa de acidificación extracelular, que corresponde a la producción mitocondrial y glicolítica de trifosfato de adenosina, utilizando sensores de pH y oxígeno. El manuscrito explica un método para comprender el estado energético de los osteoblastos y la caracterización e interpretación del estado bioenergético celular.
Abstract
La formación ósea por osteoblastos es un proceso esencial para la adquisición ósea adecuada y el recambio óseo para mantener la homeostasis esquelética y, en última instancia, prevenir la fractura. En el interés tanto de optimizar el pico de masa ósea como de combatir diversas enfermedades musculoesqueléticas (es decir, osteoporosis posmenopáusica, anorexia nerviosa, diabetes mellitus tipo 1 y 2), se han realizado esfuerzos increíbles en el campo de la biología ósea para caracterizar completamente los osteoblastos a lo largo de su proceso de diferenciación. Dado el papel principal de los osteoblastos maduros para secretar proteínas de la matriz y vesículas de mineralización, se ha observado que estos procesos requieren una cantidad increíble de energía celular, o trifosfato de adenosina (ATP). El estado general de la energía celular a menudo se conoce como bioenergética celular, e incluye una serie de reacciones metabólicas que detectan la disponibilidad de sustrato para derivar ATP para satisfacer las necesidades celulares. Por lo tanto, el método actual detalla el proceso de aislamiento de las células estromales primarias de la médula ósea murina (BMSC) y el monitoreo de su estado bioenergético utilizando el analizador de flujo metabólico celular en tiempo real en varias etapas de la diferenciación de osteoblastos. Es importante destacar que estos datos han demostrado que el perfil metabólico cambia drásticamente a lo largo de la diferenciación de osteoblastos. Por lo tanto, se requiere el uso de este tipo de célula fisiológicamente relevante para apreciar completamente cómo el estado bioenergético de una célula puede regular la función general.
Introduction
La formación de hueso por el osteoblasto se acompaña de destrucción coordinada o reabsorción de huesos por osteoclastos. El equilibrio entre la formación de hueso osteoblástico y la reabsorción de osteoclastos es un proceso acoplado que describe el recambio óseo o la remodelación, que es esencial para la homeostasis esquelética. La disfunción osteoblástica conduce a una formación ósea deteriorada y da lugar a diversas enfermedades, incluida la osteoporosis 1,2,3. La diferenciación ex vivo/in vitro de células madre del estroma de la médula ósea (BMSC) a precursores de osteoblastos y osteoblastos maduros da como resultado la formación y deposición de la matriz ósea mineralizada en el vaso de cultivo a lo largo del tiempo 4,5,6. Esta formación ósea por el osteoblasto requiere una cantidad significativa de energía celular. Específicamente, se ha demostrado que la síntesis y secreción de colágeno dependen en gran medida de las proporciones celulares de ATP: ADP, y presumiblemente, el tráfico y la secreción de vesículas mineralizadas requieren ATPadicional 7,8,9,10,11. Muchos investigadores han demostrado que el proceso de osteoblastogénesis y función osteoblástica requiere un suministro adecuado de energía para satisfacer la demanda metabólica de formación ósea 12,13,14,15,16. Por lo tanto, el objetivo de este método es caracterizar el estado bioenergético de las células del estroma murino primario a lo largo de la diferenciación de osteoblastos utilizando el analizador de flujo metabólico celular en tiempo real. Estas técnicas ayudan a desarrollar una mejor comprensión de la homeostasis esquelética, lo que en última instancia puede conducir al desarrollo de nuevas opciones terapéuticas capaces de mejorar los trastornos esqueléticos.
El analizador de flujo metabólico celular en tiempo real se puede utilizar para medir la tasa de consumo de oxígeno (OCR) y la tasa de acidificación extracelular (ECAR) de los osteoblastos vivos, que corresponde a la producción de ATP mitocondrial y glicolítico, respectivamente. Fundamental para esta metodología es el hecho de que un ion H+ por lactato se libera durante la glucólisis en la conversión de glucosa en lactato, lo que altera el pH de los medios reflejado en los valores de ECAR. Por el contrario, durante el ciclo del TCA (ácido tricarboxílico), la fosforilación oxidativa a través de las mitocondrias produce CO2 utilizando o consumiendo oxígeno, y por lo tanto el monitoreo de OCR refleja este proceso metabólico. El analizador mide tanto OCR como ECAR en el microambiente extracelular simultáneamente y en tiempo real, lo que permite un tremendo potencial al estudiar la bioenergética celular 6,17. Además, realizar estos ensayos es relativamente sencillo y fácilmente personalizable dependiendo del objetivo experimental. Se han empleado técnicas similares para comprender mejor la regulación metabólica de las células T del sistema inmunitario18,19, el inicio del cáncer y la progresión20, junto con otros múltiples tipos de células que contribuyen a los síndromes metabólicos21,22.
Las ventajas del analizador de flujo metabólico en tiempo real sobre las técnicas alternativas incluyen (1) la capacidad de medir la bioenergética celular de las células vivas en tiempo real, (2) la capacidad de realizar ensayos con un número relativamente pequeño de células (requiere tan solo 5.000 células), (3) los puertos de inyección para manipular paralelamente múltiples tratamientos en un sistema de 96 pocillos de alto rendimiento, (4) el uso de imágenes celulares automatizadas sin etiquetas radiactivas para la normalización18, 23,24. Los siguientes métodos tienen como objetivo proporcionar una descripción generalizada pero detallada del monitoreo de la bioenergética celular en BMSC murinas a lo largo de la diferenciación de osteoblastos utilizando el analizador. Incluirá ensayos realizados rutinariamente; sin embargo, al igual que con muchas técnicas y métodos, se recomienda encarecidamente que los laboratorios individuales determinen detalles específicos para sus experimentos.
Selección de ensayos y diferentes tipos de ensayos disponibles: Una amplia variedad de kits de ensayo y reactivos están disponibles para estudiar la bioenergética de las células, al tiempo que se garantiza la fiabilidad y consistencia de los resultados experimentales. Además, el software de escritorio también ofrece plantillas de ensayo que se pueden personalizar fácilmente. El ensayo se puede definir en función de las necesidades del usuario para medir diferentes parámetros metabólicos. Estos ensayos pueden ser modificados de varias maneras en función del objetivo experimental y/o la cuestión científica. Por ejemplo, con cuatro puertos de inyección, se pueden inyectar múltiples compuestos en los medios de ensayo para analizar la respuesta celular específica de cada vía metabólica.
Prueba de fenotipo de energía celular: Este ensayo mide el fenotipo metabólico y el potencial metabólico de las células vivas. Este ensayo también se recomienda como el primer paso para tener una idea generalizada del metabolismo específico de la vía. Se inyecta una mezcla de oligomicina A-un inhibidor de la ATP sintasa y cianuro de carbonilo 4-(trifluorometoxi) fenilhidrazona (FCCP), un agente de desacoplamiento mitocondrial para comprender el potencial de energía celular. La inyección de oligomicina A inhibe la síntesis de ATP, lo que resulta en un aumento en la tasa de glucólisis (ECAR) para permitir que las células satisfagan sus demandas de energía; por otro lado, la inyección de FCCP resulta en un mayor OCR debido a la despolarización de la membrana mitocondrial. Esencialmente, este ensayo representa la respiración metabólica basal, y después de las inyecciones duales, empujones o tensiones, la respuesta metabólica. Sobre la base de estos parámetros, el software traza OCR y ECAR de las células clasificando las células como estado aeróbico, quiescente, glucolítico o energético a lo largo del tiempo25,26.
Ensayo de tasa de producción en tiempo real de ATP: Esto mide la producción celular de ATP simultáneamente a partir de la glucólisis y la respiración mitocondrial. Este ensayo mide cuantitativamente los cambios metabólicos de las dos vías de energía y proporciona datos sobre las tasas de producción de ATP mitocondrial y glicolítico a lo largo del tiempo. El ensayo obtiene datos basales de OCR y ECAR seguidos del cálculo de la tasa de producción de ATP mitocondrial a través de la inyección de oligomicina A y la tasa de producción de ATP glicolítico a través de la inyección de rotenona + mezcla de antimicina A (inhibición total de la función mitocondrial), lo que resulta en acidificación mitocondrial17,27.
Prueba de esfuerzo de mitocondrias celulares (o prueba de esfuerzo de mito celular): Esto mide la función mitocondrial a través de la respiración ligada al ATP, cuantifica la bioenergética celular, identifica la disfunción mitocondrial y mide la respuesta de las células al estrés. Varios parámetros, incluida la capacidad respiratoria basal y sobrante, la respiración ligada a ATP, la respiración máxima y el consumo de oxígeno no mitocondrial, se pueden obtener en un solo ensayo. Este ensayo implica inyecciones secuenciales de oligomicina A, FCCP (agente desacoplamiento mitocondrial), una mezcla de inhibidores de rotenona /antimicina A para analizar eficientemente el efecto de estos en la función mitocondrial28.
Prueba de flexibilidad de flexión de combustible mito: Esto mide la tasa de respiración mitocondrial por la oxidación de los tres combustibles mitocondriales primarios por la presencia y ausencia de sus inhibidores. La inhibición secuencial de glucosa, glutamina y ácidos grasos ayuda a medir la dependencia, capacidad y flexibilidad de las células y la dependencia de las células en varias vías celulares para satisfacer la demanda de energía. Cuando las mitocondrias no pueden satisfacer las demandas de la vía bloqueada de interés oxidando otros combustibles, las células entran en un estado de dependencia. La capacidad de las células se calcula mediante la inhibición de las otras dos vías alternativas seguida de la inhibición de la vía de interés. La flexibilidad de las células ayuda a comprender la capacidad de las mitocondrias para compensar y satisfacer las necesidades de combustible de la vía inhibida. Se calcula restando la dependencia de las células de la capacidad de las células. Tres inhibidores diferentes se utilizan de forma independiente o como una mezcla de dos para calcular eficazmente los parámetros del ensayo. El ácido 2-ciano-3-(1-fenil-1H-indol-3-il)-2-propenoico (UK5099) inhibe la oxidación de la glucosa al bloquear el portador de piruvato en la glucólisis. El sulfuro de etilo bis-2-(5-fenilacetamidado-1,3,4-tiadiazol-2-il) (BPTES) inhibe la vía de oxidación de la glutamina, y el etomoxir inhibe la oxidación de los ácidos grasos de cadena larga29.
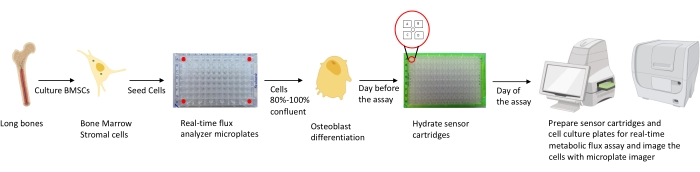
Figura 1: Representación esquemática de la metodología de cultivo y preparación de osteoblastos para su análisis. Las BMSC murinas se aíslan de huesos largos, se cultivan y se siembran en placas de 96 pocillos a una densidad de 25,000 células / pozo. El cultivo de estas células en medios específicos de osteoblastos se inicia cuando alcanzan el 80%-100% de confluencia para iniciar su diferenciación. Los ensayos se realizan en diferentes etapas de diferenciación. Las placas de los cartuchos se hidratan un día antes del ensayo. El día del ensayo, se inyectan diferentes inhibidores en los puertos de los cartuchos del sensor según los requisitos del ensayo, y se agrega un búfer de calibración a la placa de calibración de 96 pocillos. Después de la calibración, se realiza el ensayo de flujo metabólico celular en tiempo real, seguido de la obtención de imágenes de la microplaca de cultivo celular utilizando el generador de imágenes de microplacas para normalizar los datos del analizador de flujo metabólico celular en tiempo real con el recuento de células. Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
El analizador de flujo metabólico celular en tiempo real se puede utilizar para explorar la energía celular en diferentes condiciones. El protocolo ilustra el aislamiento eficiente de las BMSC, el cultivo de células en placas de cultivo celular apropiadas y su diferenciación a osteoblastos maduros, que se pueden usar para diversos ensayos utilizando el analizador de flujo extracelular. Además, también se explican en detalle los pasos críticos del ensayo de flujo metabólico celular en tiempo real, incluida la hidr…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Este trabajo fue apoyado por el Instituto Nacional de Salud (NIH) Instituto Nacional de Artritis y Enfermedades Musculoesqueléticas y de la Piel (NIAMS) Subvención AR072123 y el Instituto Nacional sobre el Envejecimiento (NIA) Subvención AG069795 (a ERR).
Materials
| 0.25% Trypsin EDTA | Sigma-Aldrich | T4049 | |
| 2-cyano-3-(1-phenyl-1H-indol-3-yl)-2-propenoic acid | Sigma – Aldrich | PZ0160 | UK5099 |
| Antimycin A | Sigma – Aldrich | A8674 | |
| Ascorbic acid | Sigma-Aldrich | A4544-100G | |
| Bis-2-(5-phenylacetamido-1,3,4-thiadiazol-2-yl)ethyl sulfide | Sigma – Aldrich | SML0601 | BPTES |
| Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone | Sigma – Aldrich | C2920 | FCCP |
| Cytation 5 imaging reader | BioTek | N/A | Microplate imager |
| Etomoxir sodium salt hydrate | Sigma – Aldrich | E1905 | |
| Hoechst 33342 Solution (20 mM) | Thermo Scientific | 62249 | |
| Insulin | Sigma – Aldrich | I6634 | |
| Oleic Acid-Albumin from bovine serum | Sigma – Aldrich | O3008 | |
| Oligomycin A – 5 mg | Sigma – Aldrich | 75351 | |
| Rotenone | Sigma – Aldrich | R8875-1G | |
| Seahorse XF 1.0 M Glucose Solution | Agilent Technologies | 103577-100 | |
| Seahorse XF 100mM Pyruvate Solution | Agilent Technologies | 103578-100 | |
| Seahorse XF 200mM Glutamine solution | Agilent Technologies | 103579-100 | |
| Seahorse XF DMEM media | Agilent Technologies | 103575-100 | DMEM assay media eith 5mM HEPES, pH 7.4, without phenol red, sodium bicarbonate, glucose, pyruvate, and L-glutamine |
| Seahorse XFe96 Analyzer | Agilent Technologies | S7800B | Real- Time Metabolic flux analyzer |
| Seahorse XFe96 FluxPak | Agilent Technologies | 102416-100 | Includes XFe96 Sensor cartridges, Cell culture microplates, and Seahorse XF Calibrant solution |
| The Cell imaging 1.1.0.11 software | Agilent Technologies – BioTek | ||
| Wave software 2.6.1 | Agilent Technologies | ||
| β-glycerol phosphate | Sigma-Aldrich | G9422-50G |
Riferimenti
- Rodan, G. A. Bone homeostasis. Proceedings of the National Academy of Sciences of the United States of America. 95 (23), 13361-13362 (1998).
- Nakahama, K. I. Cellular communications in bone homeostasis and repair. Cellular and Molecular Life Sciences. 67 (23), 4001-4009 (2010).
- Kim, J. M., Lin, C., Stavre, Z., Greenblatt, M. B., Shim, J. H. Osteoblast-osteoclast communication and bone homeostasis. Cells. 9 (9), 2073 (2020).
- Gao, J., et al. SIRT3/SOD2 maintains osteoblast differentiation and bone formation by regulating mitochondrial stress. Cell Death and Differentiation. 25 (2), 229-240 (2018).
- Baron, R. Molecular mechanisms of bone resorption by the osteoclast. The Anatomical Record. 224 (2), 317-324 (1989).
- Tian, L., Rosen, C. J., Guntur, A. R. Mitochondrial Function and Metabolism of Cultured Skeletal Cells. Methods in Molecular Biology. 2230, 437-447 (2021).
- Zanotelli, M. R., et al. Regulation of ATP utilization during metastatic cell migration by collagen architecture. Molecular Biology of the Cell. 29 (1), 1-9 (2018).
- Gonzales, S., Wang, C., Levene, H., Cheung, H. S., Huang, C. Y. C. ATP promotes extracellular matrix biosynthesis of intervertebral disc cells. Cell and Tissue Research. 359 (2), 635-642 (2015).
- Kruse, N. J., Bornstein, P. The metabolic requirements for transcellular movement and secretion of collagen. Journal of Biological Chemistry. 250 (13), 4841-4847 (1975).
- Rendina-Ruedy, E., Guntur, A. R., Rosen, C. J. Intracellular lipid droplets support osteoblast function. Adipocyte. 6 (3), 250-258 (2017).
- Sinnott-Armstrong, N., et al. A regulatory variant at 3q21.1 confers an increased pleiotropic risk for hyperglycemia and altered bone mineral density. Cell Metabolism. 33 (3), 615-628 (2021).
- Esen, E., Lee, S. Y., Wice, B. M., Long, F. PTH promotes bone anabolism by stimulating aerobic glycolysis via IGF signaling. Journal of Bone and Mineral Research. 30 (11), 1959-1968 (2015).
- Borle, A. B., Nichols, N., Nichols, G. Metabolic studies of bone in vitro: I. Normal bone. Journal of Biological Chemistry. 235, 1206-1210 (1960).
- Borle, A. B., Nichols, N., Nichols, G. Metabolic studies of bone in vitro: II. The metabolic patterns of accretion and resorption. Journal of Biological Chemistry. 235, 1211-1214 (1960).
- Adamek, G., Felix, R., Guenther, H. L., Fleisch, H. Fatty acid oxidation in bone tissue and bone cells in culture. Characterization and hormonal influences. The Biochemical Journal. 248 (1), 129-137 (1987).
- Frey, J. L., et al. Wnt-Lrp5 signaling regulates fatty acid metabolism in the osteoblast. Molecular and Cellular Biology. 35 (11), 1979-1991 (2015).
- Romero, N., Rogers, G., Neilson, A., Dranka, B. P. . Quantifying cellular ATP production rate using agilent seahorse XF technology. , (2018).
- vander Windt, G., Chang, C., Pearce, E. Measuring bioenergetics in T cells using a Seahorse Extracellular Flux Analyzer. Current Protocols in Immunology. 113, 1 (2016).
- Traba, J., Miozzo, P., Akkaya, B., Pierce, S. K., Akkaya, M. An optimized protocol to analyze glycolysis and mitochondrial respiration in lymphocytes. Journal of Visualized Experiments:JoVE. (117), e54918 (2016).
- Noel, P., et al. Preparation and metabolic assay of 3-dimensional spheroid co-cultures of pancreatic cancer cells and fibroblasts. Journal of Visualized Experiments:JoVE. (126), e56081 (2017).
- Nicholls, D., et al. Bioenergetic profile experiment using C2C12 myoblast cells. Journal of Visualized Experiments: JoVE. (46), e2511 (2010).
- Sakamuri, S. S. V. P., et al. Measurement of respiratory function in isolated cardiac mitochondria using Seahorse XFe24 Analyzer: applications for aging research. GeroScience. 40 (3), 347-356 (2018).
- . What are the advantages of using Seahorse XF technology Available from: https://wwwagilent.com/en/support/cell-analysis/advantages-of-using-xf-tech (2018)
- Horan, M. P., Pichaud, N., Ballard, J. W. O. Review: Quantifying mitochondrial dysfunction in complex diseases of aging. Journals of Gerontology – Series A Biological Sciences and Medical Sciences. 67 (10), 1022-1035 (2012).
- . XF cell energy phenotype test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740884 (2021)
- Leung, D. T. H., Chu, S. Measurement of oxidative stress: Mitochondrial function using the seahorse system. Methods in Molecular Biology. 1710, 285-293 (2018).
- . XF ATP rate assay Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740889 (2021)
- . XF cell mito stress test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740885 (2021)
- . XF cell mito fuel flex test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740888 (2021)
- Maridas, D. E., Rendina-Ruedy, E., Le, P. T., Rosen, C. J. Isolation, culture, and differentiation of bone marrow stromal cells and osteoclast progenitors from mice. Journal of Visualized Experiments: JoVE. (131), e56750 (2018).
- Wei, J., et al. Glucose uptake and Runx2 synergize to orchestrate osteoblast differentiation and bone formation. Cell. 161 (7), 1576-1591 (2015).
- Zoch, M. L., Abou, D. S., Clemens, T. L., Thorek, D. L. J., Riddle, R. C. In vivo radiometric analysis of glucose uptake and distribution in mouse bone. Bone Research. 4, 16004 (2016).
- Divakaruni, A. S., Paradyse, A., Ferrick, D. A., Murphy, A. N., Jastroch, M. Analysis and interpretation of microplate-based oxygen consumption and pH data. Methods in Enzymology. 547, 309-354 (2014).
- Kam, Y., Jastromb, N., Clayton, J., Held, P., Dranka, B. . Normalization of agilent seahorse XF data by in-situ cell counting using a BioTek cytation 5 application note. , (2017).

