Verwendung eines Echtzeit-Zellstoffwechselflussanalysators zur Überwachung der Bioenergetik des Osteoblast
Summary
Der Echtzeit-Zellstoffwechselfluss-Assay misst die Sauerstoffverbrauchsrate und die extrazelluläre Säuerungsrate, die der mitochondrialen und glykolytischen Adenosintriphosphatproduktion entspricht, unter Verwendung von pH- und Sauerstoffsensoren. Das Manuskript erklärt eine Methode zum Verständnis des Energiestatus von Osteoblasten und die Charakterisierung und Interpretation des zellulären bioenergetischen Status.
Abstract
Die Knochenbildung durch Osteoblasten ist ein wesentlicher Prozess für den richtigen Knochenerwerb und Knochenumsatz, um die Skeletthomöostase aufrechtzuerhalten und letztendlich Frakturen zu verhindern. In dem Interesse, sowohl die maximale Knochenmasse zu optimieren als auch verschiedene Muskel-Skelett-Erkrankungen (d.h. postmenopausale Osteoporose, Anorexia nervosa, Typ-1- und Typ-2-Diabetes mellitus) zu bekämpfen, wurden auf dem Gebiet der Knochenbiologie unglaubliche Anstrengungen unternommen, um Osteoblasten während ihres gesamten Differenzierungsprozesses vollständig zu charakterisieren. Angesichts der primären Rolle reifer Osteoblasten bei der Sekretion von Matrixproteinen und Mineralisierungsvesikeln wurde festgestellt, dass diese Prozesse eine unglaubliche Menge an zellulärer Energie oder Adenosintriphosphat (ATP) aufnehmen. Der gesamte zelluläre Energiestatus wird oft als zelluläre Bioenergetik bezeichnet und umfasst eine Reihe von Stoffwechselreaktionen, die die Substratverfügbarkeit erfassen, um ATP abzuleiten, um den zellulären Bedarf zu decken. Daher beschreibt die aktuelle Methode den Prozess der Isolierung primärer, muriner Knochenmarkstromazellen (BMSCs) und der Überwachung ihres bioenergetischen Status mit dem Echtzeit-Zellstoffwechselflussanalysator in verschiedenen Stadien der Osteoblastendifferenzierung. Wichtig ist, dass diese Daten gezeigt haben, dass sich das metabolische Profil während der Osteoblastendifferenzierung dramatisch ändert. Daher ist die Verwendung dieses physiologisch relevanten Zelltyps erforderlich, um vollständig zu verstehen, wie der bioenergetische Status einer Zelle die Gesamtfunktion regulieren kann.
Introduction
Die Knochenbildung durch den Osteoblasten geht mit einer koordinierten Zerstörung oder Resorption der Knochen durch Osteoklasten einher. Das Gleichgewicht zwischen osteoblastischer Knochenbildung und Osteoklastenresorption ist ein gekoppelter Prozess, der den Knochenumsatz oder -umbau beschreibt, der für die Skeletthomöostase unerlässlich ist. Osteoblast-Dysfunktion führt zu einer gestörten Knochenbildung und führt zu verschiedenen Krankheiten, einschließlich Osteoporose 1,2,3. Die Ex-vivo/In-vitro-Differenzierung von Knochenmark-Stroma-Stammzellen (BMSCs) zu Osteoblasten-Vorläufern und reifen Osteoblasten führt im Laufe der Zeitzur Bildung und Ablagerung der mineralisierten Knochenmatrix im Kulturgefäß 4,5,6. Diese Knochenbildung durch das Osteoblast erfordert eine erhebliche Menge an zellulärer Energie. Insbesondere wurde gezeigt, dass Kollagensynthese und -sekretion stark von zellulärem ATP abhängen: ADP-Verhältnisse, und vermutlich erfordern der Transport und die Sekretion von mineralisierten Vesikeln zusätzliches ATP 7,8,9,10,11. Viele Forscher haben gezeigt, dass der Prozess der Osteoblastogenese und der Osteoblastenfunktion eine ausreichende Energiezufuhr erfordert, um den metabolischen Bedarf an Knochenbildung zu decken 12,13,14,15,16. Daher ist es das Ziel dieser Methode, den bioenergetischen Status von primären, murinen Stromazellen während der Osteoblastendifferenzierung mit dem Echtzeit-Zellstoffwechselflussanalysator zu charakterisieren. Diese Techniken tragen dazu bei, ein besseres Verständnis der Skeletthomöostase zu entwickeln, was letztendlich zur Entwicklung neuartiger therapeutischer Optionen führen kann, die in der Lage sind, Skeletterkrankungen zu verbessern.
Der Echtzeit-Zellstoffwechselflussanalysator kann verwendet werden, um die Sauerstoffverbrauchsrate (OCR) und die extrazelluläre Versauerungsrate (ECAR) lebender Osteoblasten zu messen, was der mitochondrialen bzw. glykolytischen ATP-Produktion entspricht. Grundlegend für diese Methodik ist die Tatsache, dass ein H + -Ion pro Laktat während der Glykolyse bei der Umwandlung von Glukose in Laktat freigesetzt wird, was den in den ECAR-Werten widergespiegelten Medien-pH-Wert verändert. Umgekehrt erzeugt die oxidative Phosphorylierung über die Mitochondrien während des TCA-Zyklus (Tricarbonsäure) CO 2 durch die Verwendung oder den Verbrauch von Sauerstoff, und daher spiegelt die Überwachung der OCR diesen Stoffwechselprozess wider. Der Analysator misst sowohl OCR als auch ECAR in der extrazellulären Mikroumgebung gleichzeitig und in Echtzeit, was ein enormes Potenzial bei der Untersuchung der zellulären Bioenergetik ermöglicht 6,17. Darüber hinaus ist die Durchführung dieser Assays relativ einfach und je nach experimentellem Ziel leicht anpassbar. Ähnliche Techniken wurden angewendet, um die metabolische Regulation des Immunsystems durch T-Zellen18,19, die Krebsinitiation und -progression 20 sowie mehrere andere Zelltypen, die zu metabolischen Syndromen beitragen, besser zu verstehen 21,22.
Zu den Vorteilen des Echtzeit-metabolischen Flussanalysators gegenüber alternativen Techniken gehören (1) die Fähigkeit, die zelluläre Bioenergetik lebender Zellen in Echtzeit zu messen, (2) die Fähigkeit, Assays mit einer relativ kleinen Anzahl von Zellen durchzuführen (erfordert nur 5.000 Zellen), (3) Injektionsanschlüsse zur parallelen Manipulation mehrerer Behandlungen in einem Hochdurchsatz-96-Well-System, (4) Verwendung eines radioaktiven markierungsfreien automatisierten Zellbildgebungsgeräts zur Normalisierung18, 23,24 Die folgenden Methoden zielen darauf ab, eine verallgemeinerte, aber detaillierte Beschreibung der Überwachung der zellulären Bioenergetik in murinen BMSCs während der Osteoblastendifferenzierung mit dem Analysator zu liefern. Es wird routinemäßig durchgeführte Assays umfassen; Wie bei vielen Techniken und Methoden wird jedoch dringend empfohlen, dass einzelne Labore spezifische Details für ihre Experimente festlegen.
Auswahl an Assays und verschiedenen Arten von Assays verfügbar: Eine Vielzahl von Assay-Kits und Reagenzien steht zur Verfügung, um die Bioenergetik von Zellen zu untersuchen und gleichzeitig die Zuverlässigkeit und Konsistenz der experimentellen Ergebnisse zu gewährleisten. Darüber hinaus bietet die Desktop-Software auch Assay-Vorlagen, die leicht angepasst werden können. Der Assay kann basierend auf den Bedürfnissen des Benutzers definiert werden, um verschiedene metabolische Parameter zu messen. Diese Assays können auf verschiedene Weise modifiziert werden, basierend auf dem experimentellen Ziel und / oder der wissenschaftlichen Fragestellung. Zum Beispiel können mit vier Injektionsports mehrere Verbindungen in die Assay-Medien injiziert werden, um die zelluläre Reaktion zu analysieren, die für jeden Stoffwechselweg spezifisch ist.
Zellenergie-Phänotyp-Test: Dieser Assay misst den metabolischen Phänotyp und das metabolische Potenzial der lebenden Zellen. Dieser Assay wird auch als erster Schritt empfohlen, um eine verallgemeinerte Vorstellung vom pfadspezifischen Stoffwechsel zu erhalten. Eine Mischung aus Oligomycin-A-an-Inhibitor der ATP-Synthase und Carbonylcyanid 4-(Trifluormethoxy)-phenylhydrazon (FCCP)-einem mitochondrialen Entkopplungsmittel wird injiziert, um das Zellenergiepotential zu verstehen. Die Injektion von Oligomycin A hemmt die Synthese von ATP, was zu einer Erhöhung der Glykolyserate (ECAR) führt, damit die Zellen ihren Energiebedarf decken können; Auf der anderen Seite führt die Injektion von FCCP zu einer höheren OCR aufgrund der Depolarisation der mitochondrialen Membran. Im Wesentlichen zeigt dieser Assay die Grundstoffwechselatmung und nach den doppelten Injektionen, Pushes oder Stress die metabolische Reaktion. Basierend auf diesen Parametern zeichnet die Software dann OCR und ECAR der Zellen auf, indem sie die Zellen im Laufe der Zeit als aeroben, ruhenden, glykolytischen oder energetischen Zustand klassifiziert25,26.
ATP-Echtzeit-Analyse der Produktionsrate: Dieser misst die zelluläre ATP-Produktion gleichzeitig aus Glykolyse und mitochondrialer Atmung. Dieser Assay misst quantitativ die metabolischen Verschiebungen aus den beiden Energiebahnen und liefert Daten über die mitochondrialen und glykolytischen ATP-Produktionsraten im Laufe der Zeit. Der Assay erhält basale OCR- und ECAR-Daten, gefolgt von der Berechnung der mitochondrialen ATP-Produktionsrate durch Injektion von Oligomycin A und der glykolytischen ATP-Produktionsrate durch Injektion von Rotenon + Antimycin A-Mischung (totale Hemmung der mitochondrialen Funktion), was zu einer mitochondrialen Versauerung führt17,27.
Zellmitochondrien-Stresstest (oder Zell-Mito-Stresstest): Dies misst die mitochondriale Funktion durch ATP-verknüpfte Atmung, quantifiziert die zelluläre Bioenergetik, identifiziert mitochondriale Dysfunktion und misst die Reaktion der Zellen auf Stress. Verschiedene Parameter, einschließlich basale und freie Atemkapazität, ATP-gebundene Atmung, maximale Atmung und nicht-mitochondrialer Sauerstoffverbrauch, können in einem Assay erhalten werden. Dieser Assay beinhaltet sequentielle Injektionen von Oligomycin A, FCCP (mitochondriales Entkopplungsmittel), einer Mischung aus Rotenon/Antimycin-A-Hemmern, um deren Wirkung auf die mitochondriale Funktion effizient zu analysieren28.
Flexibilität mito fuel flex test: Dies misst die mitochondriale Atmungsrate durch die Oxidation der drei primären mitochondrialen Brennstoffe durch das Vorhandensein und Fehlen ihrer Inhibitoren. Die sequentielle Hemmung von Glukose, Glutamin und Fettsäuren hilft bei der Messung der Abhängigkeit, Kapazität und Flexibilität von Zellen und der Abhängigkeit der Zellen in verschiedenen zellulären Wegen, um den Energiebedarf zu decken. Wenn die Mitochondrien die Anforderungen des blockierten Weges von Interesse nicht durch Oxidation anderer Brennstoffe erfüllen können, treten die Zellen in einen Abhängigkeitszustand ein. Die Kapazität der Zellen wird durch Hemmung der beiden anderen alternativen Wege berechnet, gefolgt von der Hemmung des interessierenden Signalwegs. Die Flexibilität der Zellen hilft beim Verständnis der Fähigkeit der Mitochondrien, den Brennstoffbedarf des gehemmten Weges zu kompensieren und zu decken. Es wird berechnet, indem die Abhängigkeit von Zellen von der Kapazität der Zellen subtrahiert wird. Drei verschiedene Inhibitoren werden unabhängig voneinander oder als Mischung aus zwei verwendet, um die Assay-Parameter effektiv zu berechnen. 2-Cyano-3-(1-phenyl-1H-indol-3-yl)-2-propensäure (UK5099) hemmt die Oxidation von Glukose, indem sie den Pyruvatträger in der Glykolyse blockiert. Bis-2-(5-phenylacetamido-1,3,4-thiadiazol-2-yl) (BPTES)-ethylsulfid hemmt den Glutaminoxidationsweg und Etomoxir hemmt die Oxidation langkettiger Fettsäuren29.
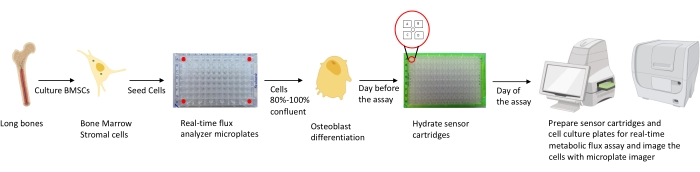
Abbildung 1: Schematische Darstellung der Methodik zur Kultivierung und Vorbereitung von Osteoblasten für die Analyse. Murine BMSCs werden aus langen Knochen isoliert, kultiviert und in 96-Well-Platten bei 25.000 Zellen / Well-Dichte ausgesät. Die Kultivierung dieser Zellen in Osteoblast-spezifischen Medien beginnt, wenn sie eine 80% -100% ige Konfluenz erreichen, um ihre Differenzierung zu beginnen. Die Assays werden in verschiedenen Stadien der Differenzierung durchgeführt. Die Kartuschenplatten werden einen Tag vor dem Assay mit Feuchtigkeit versorgt. Am Tag des Assays werden verschiedene Inhibitoren in die Ports der Sensorkartuschen injiziert, basierend auf den Assay-Anforderungen, und der 96-Well-Kalibrierplatte wird ein Kalibrierpuffer hinzugefügt. Nach der Kalibrierung wird der Echtzeit-Zellstoffwechselfluss-Assay durchgeführt, gefolgt von der Abbildung der Zellkultur-Mikroplatte mit dem Mikroplatten-Imager, um Echtzeit-Daten des Zellstoffwechselflussanalysators mit der Zellzahl zu normalisieren. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Protocol
Representative Results
Discussion
Der Echtzeit-Zellstoffwechselflussanalysator kann verwendet werden, um die zelluläre Energetik unter verschiedenen Bedingungen zu erforschen. Das Protokoll veranschaulicht die effiziente Isolierung von BMSCs, die Kultivierung von Zellen in geeigneten Zellkulturplatten und ihre Differenzierung zu reifen Osteoblasten, die für verschiedene Assays mit dem extrazellulären Flussanalysator verwendet werden können. Darüber hinaus werden die kritischen Schritte des Echtzeit-Zellstoffwechselflussassays, einschließlich der Hy…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Diese Arbeit wurde vom National Institute of Health (NIH) National Institute of Arthritis and Musculoskeletal and Skin Diseases (NIAMS) Grant AR072123 und dem National Institute on Aging (NIA) Grant AG069795 (zu ERR) unterstützt.
Materials
| 0.25% Trypsin EDTA | Sigma-Aldrich | T4049 | |
| 2-cyano-3-(1-phenyl-1H-indol-3-yl)-2-propenoic acid | Sigma – Aldrich | PZ0160 | UK5099 |
| Antimycin A | Sigma – Aldrich | A8674 | |
| Ascorbic acid | Sigma-Aldrich | A4544-100G | |
| Bis-2-(5-phenylacetamido-1,3,4-thiadiazol-2-yl)ethyl sulfide | Sigma – Aldrich | SML0601 | BPTES |
| Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone | Sigma – Aldrich | C2920 | FCCP |
| Cytation 5 imaging reader | BioTek | N/A | Microplate imager |
| Etomoxir sodium salt hydrate | Sigma – Aldrich | E1905 | |
| Hoechst 33342 Solution (20 mM) | Thermo Scientific | 62249 | |
| Insulin | Sigma – Aldrich | I6634 | |
| Oleic Acid-Albumin from bovine serum | Sigma – Aldrich | O3008 | |
| Oligomycin A – 5 mg | Sigma – Aldrich | 75351 | |
| Rotenone | Sigma – Aldrich | R8875-1G | |
| Seahorse XF 1.0 M Glucose Solution | Agilent Technologies | 103577-100 | |
| Seahorse XF 100mM Pyruvate Solution | Agilent Technologies | 103578-100 | |
| Seahorse XF 200mM Glutamine solution | Agilent Technologies | 103579-100 | |
| Seahorse XF DMEM media | Agilent Technologies | 103575-100 | DMEM assay media eith 5mM HEPES, pH 7.4, without phenol red, sodium bicarbonate, glucose, pyruvate, and L-glutamine |
| Seahorse XFe96 Analyzer | Agilent Technologies | S7800B | Real- Time Metabolic flux analyzer |
| Seahorse XFe96 FluxPak | Agilent Technologies | 102416-100 | Includes XFe96 Sensor cartridges, Cell culture microplates, and Seahorse XF Calibrant solution |
| The Cell imaging 1.1.0.11 software | Agilent Technologies – BioTek | ||
| Wave software 2.6.1 | Agilent Technologies | ||
| β-glycerol phosphate | Sigma-Aldrich | G9422-50G |
Riferimenti
- Rodan, G. A. Bone homeostasis. Proceedings of the National Academy of Sciences of the United States of America. 95 (23), 13361-13362 (1998).
- Nakahama, K. I. Cellular communications in bone homeostasis and repair. Cellular and Molecular Life Sciences. 67 (23), 4001-4009 (2010).
- Kim, J. M., Lin, C., Stavre, Z., Greenblatt, M. B., Shim, J. H. Osteoblast-osteoclast communication and bone homeostasis. Cells. 9 (9), 2073 (2020).
- Gao, J., et al. SIRT3/SOD2 maintains osteoblast differentiation and bone formation by regulating mitochondrial stress. Cell Death and Differentiation. 25 (2), 229-240 (2018).
- Baron, R. Molecular mechanisms of bone resorption by the osteoclast. The Anatomical Record. 224 (2), 317-324 (1989).
- Tian, L., Rosen, C. J., Guntur, A. R. Mitochondrial Function and Metabolism of Cultured Skeletal Cells. Methods in Molecular Biology. 2230, 437-447 (2021).
- Zanotelli, M. R., et al. Regulation of ATP utilization during metastatic cell migration by collagen architecture. Molecular Biology of the Cell. 29 (1), 1-9 (2018).
- Gonzales, S., Wang, C., Levene, H., Cheung, H. S., Huang, C. Y. C. ATP promotes extracellular matrix biosynthesis of intervertebral disc cells. Cell and Tissue Research. 359 (2), 635-642 (2015).
- Kruse, N. J., Bornstein, P. The metabolic requirements for transcellular movement and secretion of collagen. Journal of Biological Chemistry. 250 (13), 4841-4847 (1975).
- Rendina-Ruedy, E., Guntur, A. R., Rosen, C. J. Intracellular lipid droplets support osteoblast function. Adipocyte. 6 (3), 250-258 (2017).
- Sinnott-Armstrong, N., et al. A regulatory variant at 3q21.1 confers an increased pleiotropic risk for hyperglycemia and altered bone mineral density. Cell Metabolism. 33 (3), 615-628 (2021).
- Esen, E., Lee, S. Y., Wice, B. M., Long, F. PTH promotes bone anabolism by stimulating aerobic glycolysis via IGF signaling. Journal of Bone and Mineral Research. 30 (11), 1959-1968 (2015).
- Borle, A. B., Nichols, N., Nichols, G. Metabolic studies of bone in vitro: I. Normal bone. Journal of Biological Chemistry. 235, 1206-1210 (1960).
- Borle, A. B., Nichols, N., Nichols, G. Metabolic studies of bone in vitro: II. The metabolic patterns of accretion and resorption. Journal of Biological Chemistry. 235, 1211-1214 (1960).
- Adamek, G., Felix, R., Guenther, H. L., Fleisch, H. Fatty acid oxidation in bone tissue and bone cells in culture. Characterization and hormonal influences. The Biochemical Journal. 248 (1), 129-137 (1987).
- Frey, J. L., et al. Wnt-Lrp5 signaling regulates fatty acid metabolism in the osteoblast. Molecular and Cellular Biology. 35 (11), 1979-1991 (2015).
- Romero, N., Rogers, G., Neilson, A., Dranka, B. P. . Quantifying cellular ATP production rate using agilent seahorse XF technology. , (2018).
- vander Windt, G., Chang, C., Pearce, E. Measuring bioenergetics in T cells using a Seahorse Extracellular Flux Analyzer. Current Protocols in Immunology. 113, 1 (2016).
- Traba, J., Miozzo, P., Akkaya, B., Pierce, S. K., Akkaya, M. An optimized protocol to analyze glycolysis and mitochondrial respiration in lymphocytes. Journal of Visualized Experiments:JoVE. (117), e54918 (2016).
- Noel, P., et al. Preparation and metabolic assay of 3-dimensional spheroid co-cultures of pancreatic cancer cells and fibroblasts. Journal of Visualized Experiments:JoVE. (126), e56081 (2017).
- Nicholls, D., et al. Bioenergetic profile experiment using C2C12 myoblast cells. Journal of Visualized Experiments: JoVE. (46), e2511 (2010).
- Sakamuri, S. S. V. P., et al. Measurement of respiratory function in isolated cardiac mitochondria using Seahorse XFe24 Analyzer: applications for aging research. GeroScience. 40 (3), 347-356 (2018).
- . What are the advantages of using Seahorse XF technology Available from: https://wwwagilent.com/en/support/cell-analysis/advantages-of-using-xf-tech (2018)
- Horan, M. P., Pichaud, N., Ballard, J. W. O. Review: Quantifying mitochondrial dysfunction in complex diseases of aging. Journals of Gerontology – Series A Biological Sciences and Medical Sciences. 67 (10), 1022-1035 (2012).
- . XF cell energy phenotype test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740884 (2021)
- Leung, D. T. H., Chu, S. Measurement of oxidative stress: Mitochondrial function using the seahorse system. Methods in Molecular Biology. 1710, 285-293 (2018).
- . XF ATP rate assay Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740889 (2021)
- . XF cell mito stress test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740885 (2021)
- . XF cell mito fuel flex test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740888 (2021)
- Maridas, D. E., Rendina-Ruedy, E., Le, P. T., Rosen, C. J. Isolation, culture, and differentiation of bone marrow stromal cells and osteoclast progenitors from mice. Journal of Visualized Experiments: JoVE. (131), e56750 (2018).
- Wei, J., et al. Glucose uptake and Runx2 synergize to orchestrate osteoblast differentiation and bone formation. Cell. 161 (7), 1576-1591 (2015).
- Zoch, M. L., Abou, D. S., Clemens, T. L., Thorek, D. L. J., Riddle, R. C. In vivo radiometric analysis of glucose uptake and distribution in mouse bone. Bone Research. 4, 16004 (2016).
- Divakaruni, A. S., Paradyse, A., Ferrick, D. A., Murphy, A. N., Jastroch, M. Analysis and interpretation of microplate-based oxygen consumption and pH data. Methods in Enzymology. 547, 309-354 (2014).
- Kam, Y., Jastromb, N., Clayton, J., Held, P., Dranka, B. . Normalization of agilent seahorse XF data by in-situ cell counting using a BioTek cytation 5 application note. , (2017).

