Utilisation d’un analyseur de flux métabolique cellulaire en temps réel pour surveiller la bioénergétique des ostéoblastes
Summary
Le test de flux métabolique cellulaire en temps réel mesure le taux de consommation d’oxygène et le taux d’acidification extracellulaire, qui correspond à la production mitochondriale et glycolytique d’adénosine triphosphate, à l’aide de capteurs de pH et d’oxygène. Le manuscrit explique une méthode pour comprendre l’état énergétique des ostéoblastes et la caractérisation et l’interprétation de l’état bioénergétique cellulaire.
Abstract
La formation osseuse par les ostéoblastes est un processus essentiel pour une acquisition osseuse et un renouvellement osseux appropriés afin de maintenir l’homéostasie squelettique et, en fin de compte, de prévenir la fracture. Dans le but d’optimiser la masse osseuse maximale et de lutter contre diverses maladies musculo-squelettiques (c.-à-d. l’ostéoporose post-ménopausique, l’anorexie mentale, le diabète sucré de type 1 et 2), des efforts incroyables ont été déployés dans le domaine de la biologie osseuse pour caractériser pleinement les ostéoblastes tout au long de leur processus de différenciation. Compte tenu du rôle principal des ostéoblastes matures dans la sécrétion de protéines matricielles et de vésicules de minéralisation, il a été noté que ces processus prennent une quantité incroyable d’énergie cellulaire, ou adénosine triphosphate (ATP). L’état énergétique cellulaire global est souvent appelé bioénergétique cellulaire, et il comprend une série de réactions métaboliques qui détectent la disponibilité du substrat pour dériver l’ATP pour répondre aux besoins cellulaires. Par conséquent, la méthode actuelle détaille le processus d’isolement des cellules stromales primaires de la moelle osseuse murine (BMSC) et de surveillance de leur état bioénergétique à l’aide de l’analyseur de flux métabolique cellulaire en temps réel à différents stades de la différenciation des ostéoblastes. Il est important de noter que ces données ont démontré que le profil métabolique change radicalement tout au long de la différenciation des ostéoblastes. Ainsi, l’utilisation de ce type de cellule physiologiquement pertinent est nécessaire pour apprécier pleinement comment l’état bioénergétique d’une cellule peut réguler la fonction globale.
Introduction
La formation d’os par l’ostéoblaste s’accompagne d’une destruction ou d’une résorption coordonnée des os par les ostéoclastes. L’équilibre entre la formation osseuse ostéoblastique et la résorption des ostéoclastes est un processus couplé décrivant le renouvellement osseux ou le remodelage, ce qui est essentiel pour l’homéostasie squelettique. Le dysfonctionnement ostéoblastique entraîne une altération de la formation osseuse et entraîne diverses maladies, y compris l’ostéoporose 1,2,3. La différenciation ex vivo/in vitro des cellules souches stromales de la moelle osseuse (BMSC) en précurseurs d’ostéoblastes et en ostéoblastes matures entraîne la formation et le dépôt de la matrice osseuse minéralisée dans le récipient de culture au fil du temps 4,5,6. Cette formation osseuse par l’ostéoblaste nécessite une quantité importante d’énergie cellulaire. Plus précisément, il a été démontré que la synthèse et la sécrétion de collagène dépendent fortement des rapports cellulaires ATP: ADP, et vraisemblablement, le trafic et la sécrétion de vésicules minéralisées nécessitent de l’ATP supplémentaire 7,8,9,10,11. De nombreux chercheurs ont démontré que le processus d’ostéoblastogenèse et de fonction ostéoblastique nécessite un apport adéquat d’énergie pour répondre à la demande métabolique de la formation osseuse 12,13,14,15,16. Par conséquent, l’objectif de cette méthode est de caractériser l’état bioénergétique des cellules stromales murines primaires tout au long de la différenciation ostéoblastique à l’aide de l’analyseur de flux métabolique cellulaire en temps réel. Ces techniques aident à développer une meilleure compréhension de l’homéostasie squelettique, ce qui pourrait finalement conduire au développement de nouvelles options thérapeutiques capables d’améliorer les troubles squelettiques.
L’analyseur de flux métabolique cellulaire en temps réel peut être utilisé pour mesurer le taux de consommation d’oxygène (OCR) et le taux d’acidification extracellulaire (ECAR) des ostéoblastes vivants, ce qui correspond à la production mitochondriale et glycolytique d’ATP, respectivement. Le fait qu’un ion H+ par lactate soit libéré lors de la glycolyse lors de la conversion du glucose en lactate, ce qui modifie le pH du milieu reflété dans les valeurs ECAR est fondamental pour cette méthodologie. Inversement, au cours du cycle TCA (acide tricarboxylique), la phosphorylation oxydative via les mitochondries produit du CO2 en utilisant ou en consommant de l’oxygène, et donc la surveillance de l’OCR reflète ce processus métabolique. L’analyseur mesure à la fois l’OCR et l’ECAR dans le microenvironnement extracellulaire simultanément et en temps réel, ce qui permet un potentiel énorme lors de l’étude de la bioénergétique cellulaire 6,17. De plus, l’exécution de ces tests est relativement simple et facilement personnalisable en fonction de l’objectif expérimental. Des techniques similaires ont été utilisées pour mieux comprendre la régulation métabolique des lymphocytes T du système immunitaire18,19, l’initiation et la progression du cancer20, ainsi que de multiples autres types de cellules contribuant aux syndromes métaboliques21,22.
Les avantages de l’analyseur de flux métabolique en temps réel par rapport aux techniques alternatives comprennent (1) la capacité de mesurer la bioénergétique cellulaire de cellules vivantes en temps réel, (2) la capacité d’effectuer des essais avec un nombre relativement faible de cellules (nécessite aussi peu que 5 000 cellules), (3) des ports d’injection pour manipuler en parallèle plusieurs traitements dans un système à haut débit de 96 puits, (4) l’utilisation d’un imageur de cellules automatisé sans étiquette radioactive pour la normalisation18, 23,24. Les méthodes suivantes visent à fournir une description généralisée mais détaillée de la surveillance de la bioénergétique cellulaire dans les BMSC murins tout au long de la différenciation des ostéoblastes à l’aide de l’analyseur. Il comprendra des tests effectués régulièrement; cependant, comme pour de nombreuses techniques et méthodes, il est fortement encouragé que les laboratoires individuels déterminent des détails spécifiques pour leurs expériences.
Sélection de tests et différents types de tests disponibles: Une grande variété de kits de dosage et de réactifs sont disponibles pour étudier la bioénergétique des cellules tout en assurant la fiabilité et la cohérence des résultats expérimentaux. En outre, le logiciel de bureau propose également des modèles de test qui peuvent être facilement personnalisés. Le test peut être défini en fonction des besoins de l’utilisateur pour mesurer différents paramètres métaboliques. Ces essais peuvent être modifiés de différentes manières en fonction de l’objectif expérimental et/ou de la question scientifique. Par exemple, avec quatre ports d’injection, plusieurs composés peuvent être injectés dans le milieu d’essai pour analyser la réponse cellulaire spécifique à chaque voie métabolique.
Test de phénotype d’énergie cellulaire: Ce test mesure le phénotype métabolique et le potentiel métabolique des cellules vivantes. Ce test est également recommandé comme première étape pour avoir une idée généralisée du métabolisme spécifique à la voie. Un mélange d’oligomycine A-un inhibiteur de l’ATP synthase et de cyanure de carbonyle 4-(trifluorométhoxy)phénylhydrazone (FCCP)-un agent de découplage mitochondrial est injecté pour comprendre le potentiel énergétique cellulaire. L’injection d’oligomycine A inhibe la synthèse de l’ATP, entraînant une augmentation du taux de glycolyse (ECAR) pour permettre aux cellules de répondre à leurs besoins énergétiques; d’autre part, l’injection de FCCP entraîne une OCR plus élevée en raison de la dépolarisation de la membrane mitochondriale. Essentiellement, ce test décrit la respiration métabolique basale et, après les doubles injections, poussées ou stress, la réponse métabolique. Sur la base de ces paramètres, le logiciel trace ensuite l’OCR et l’ECAR des cellules en classant les cellules en état aérobie, quiescent, glycolytique ou énergétique au fil du temps25,26.
Test du taux de production atp en temps réel : Cela mesure la production cellulaire d’ATP simultanément à partir de la glycolyse et de la respiration mitochondriale. Ce test mesure quantitativement les changements métaboliques des deux voies énergétiques et fournit des données sur les taux de production d’ATP mitochondrial et glycolytique au fil du temps. Le test obtient des données OCR et ECAR basales suivies du calcul du taux de production mitochondrial d’ATP par injection d’oligomycine A et du taux de production d’ATP glycolytique par injection de mélange roténone + antimycine A (inhibition totale de la fonction mitochondriale), entraînant une acidification mitochondriale17,27.
Test de stress des mitochondries cellulaires (ou test d’effort mito cellulaire): Cela mesure la fonction mitochondriale par la respiration liée à l’ATP, quantifie la bioénergétique cellulaire, identifie le dysfonctionnement mitochondrial et mesure la réponse des cellules au stress. Divers paramètres, y compris la capacité respiratoire basale et de rechange, la respiration liée à l’ATP, la respiration maximale et la consommation d’oxygène non mitochondriale, peuvent être obtenus en un seul test. Ce test implique des injections séquentielles d’oligomycine A, fccP (agent de découplage mitochondrial), un mélange d’inhibiteurs de roténone / antimycine A pour analyser efficacement l’effet de ceux-ci sur la fonction mitochondriale28.
Flexibilité mito fuel flex test: Cela mesure le taux de respiration mitochondriale par l’oxydation des trois combustibles mitochondriaux primaires par la présence et l’absence de leurs inhibiteurs. L’inhibition séquentielle du glucose, de la glutamine et des acides gras aide à mesurer la dépendance, la capacité et la flexibilité des cellules et la dépendance des cellules dans diverses voies cellulaires pour répondre à la demande d’énergie. Lorsque les mitochondries ne peuvent pas répondre aux exigences de la voie d’intérêt bloquée en oxydant d’autres combustibles, les cellules entrent dans un état de dépendance. La capacité des cellules est calculée par inhibition des deux autres voies alternatives suivies de l’inhibition de la voie d’intérêt. La flexibilité des cellules aide à comprendre la capacité des mitochondries à compenser et à répondre aux besoins en carburant de la voie inhibée. Il est calculé en soustrayant la dépendance des cellules de la capacité des cellules. Trois inhibiteurs différents sont utilisés indépendamment ou sous forme de mélange de deux pour calculer efficacement les paramètres du test. L’acide 2-cyano-3-(1-phényl-1H-indol-3-yl)-2-propénoïque (UK5099) inhibe l’oxydation du glucose en bloquant le transporteur de pyruvate dans la glycolyse. Le sulfure d’éthyle bis-2-(5-phénylacétamido-1,3,4-thiadiazol-2-yl) (BPTES) inhibe la voie d’oxydation de la glutamine et l’étomoxir inhibe l’oxydation des acides gras à longue chaîne29.
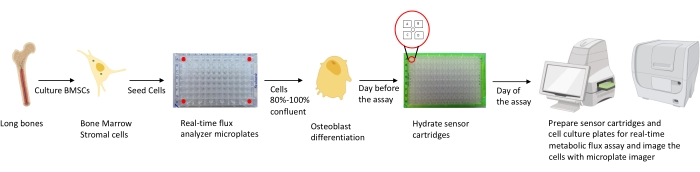
Figure 1 : Représentation schématique de la méthodologie de culture et de préparation des ostéoblastes pour analyse. Les BMSC murins sont isolés à partir d’os longs, cultivés et ensemencés dans des plaques de 96 puits à une densité de 25 000 cellules/puits. La culture de ces cellules dans des milieux spécifiques aux ostéoblastes commence lorsqu’elles atteignent une confluence de 80% à 100% pour commencer leur différenciation. Les tests sont effectués à différents stades de différenciation. Les plaques de cartouche sont hydratées un jour avant le test. Le jour du test, différents inhibiteurs sont injectés dans les orifices des cartouches de capteur en fonction des exigences du test, et un tampon d’étalonnage est ajouté à la plaque d’étalonnage de 96 puits. Après l’étalonnage, le test de flux métabolique cellulaire en temps réel est effectué, suivi de l’imagerie de la microplaque de culture cellulaire à l’aide de l’imageur de microplaques pour normaliser les données de l’analyseur de flux métabolique cellulaire en temps réel avec le nombre de cellules. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocol
Representative Results
Discussion
L’analyseur de flux métabolique cellulaire en temps réel peut être utilisé pour explorer l’énergie cellulaire dans différentes conditions. Le protocole illustre l’isolement efficace des BMSC, la culture des cellules dans des plaques de culture cellulaire appropriées et leur différenciation en ostéoblastes matures, qui peuvent être utilisés pour divers tests à l’aide de l’analyseur de flux extracellulaire. En outre, les étapes critiques du test du flux métabolique cellulaire en temps réel, y compr…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Ce travail a été soutenu par le National Institute of Health (NIH) National Institute of Arthritis and Musculoskeletal and Skin Diseases (NIAMS) Grant AR072123 et national Institute on Aging (NIA) Grant AG069795 (à ERR).
Materials
| 0.25% Trypsin EDTA | Sigma-Aldrich | T4049 | |
| 2-cyano-3-(1-phenyl-1H-indol-3-yl)-2-propenoic acid | Sigma – Aldrich | PZ0160 | UK5099 |
| Antimycin A | Sigma – Aldrich | A8674 | |
| Ascorbic acid | Sigma-Aldrich | A4544-100G | |
| Bis-2-(5-phenylacetamido-1,3,4-thiadiazol-2-yl)ethyl sulfide | Sigma – Aldrich | SML0601 | BPTES |
| Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone | Sigma – Aldrich | C2920 | FCCP |
| Cytation 5 imaging reader | BioTek | N/A | Microplate imager |
| Etomoxir sodium salt hydrate | Sigma – Aldrich | E1905 | |
| Hoechst 33342 Solution (20 mM) | Thermo Scientific | 62249 | |
| Insulin | Sigma – Aldrich | I6634 | |
| Oleic Acid-Albumin from bovine serum | Sigma – Aldrich | O3008 | |
| Oligomycin A – 5 mg | Sigma – Aldrich | 75351 | |
| Rotenone | Sigma – Aldrich | R8875-1G | |
| Seahorse XF 1.0 M Glucose Solution | Agilent Technologies | 103577-100 | |
| Seahorse XF 100mM Pyruvate Solution | Agilent Technologies | 103578-100 | |
| Seahorse XF 200mM Glutamine solution | Agilent Technologies | 103579-100 | |
| Seahorse XF DMEM media | Agilent Technologies | 103575-100 | DMEM assay media eith 5mM HEPES, pH 7.4, without phenol red, sodium bicarbonate, glucose, pyruvate, and L-glutamine |
| Seahorse XFe96 Analyzer | Agilent Technologies | S7800B | Real- Time Metabolic flux analyzer |
| Seahorse XFe96 FluxPak | Agilent Technologies | 102416-100 | Includes XFe96 Sensor cartridges, Cell culture microplates, and Seahorse XF Calibrant solution |
| The Cell imaging 1.1.0.11 software | Agilent Technologies – BioTek | ||
| Wave software 2.6.1 | Agilent Technologies | ||
| β-glycerol phosphate | Sigma-Aldrich | G9422-50G |
Riferimenti
- Rodan, G. A. Bone homeostasis. Proceedings of the National Academy of Sciences of the United States of America. 95 (23), 13361-13362 (1998).
- Nakahama, K. I. Cellular communications in bone homeostasis and repair. Cellular and Molecular Life Sciences. 67 (23), 4001-4009 (2010).
- Kim, J. M., Lin, C., Stavre, Z., Greenblatt, M. B., Shim, J. H. Osteoblast-osteoclast communication and bone homeostasis. Cells. 9 (9), 2073 (2020).
- Gao, J., et al. SIRT3/SOD2 maintains osteoblast differentiation and bone formation by regulating mitochondrial stress. Cell Death and Differentiation. 25 (2), 229-240 (2018).
- Baron, R. Molecular mechanisms of bone resorption by the osteoclast. The Anatomical Record. 224 (2), 317-324 (1989).
- Tian, L., Rosen, C. J., Guntur, A. R. Mitochondrial Function and Metabolism of Cultured Skeletal Cells. Methods in Molecular Biology. 2230, 437-447 (2021).
- Zanotelli, M. R., et al. Regulation of ATP utilization during metastatic cell migration by collagen architecture. Molecular Biology of the Cell. 29 (1), 1-9 (2018).
- Gonzales, S., Wang, C., Levene, H., Cheung, H. S., Huang, C. Y. C. ATP promotes extracellular matrix biosynthesis of intervertebral disc cells. Cell and Tissue Research. 359 (2), 635-642 (2015).
- Kruse, N. J., Bornstein, P. The metabolic requirements for transcellular movement and secretion of collagen. Journal of Biological Chemistry. 250 (13), 4841-4847 (1975).
- Rendina-Ruedy, E., Guntur, A. R., Rosen, C. J. Intracellular lipid droplets support osteoblast function. Adipocyte. 6 (3), 250-258 (2017).
- Sinnott-Armstrong, N., et al. A regulatory variant at 3q21.1 confers an increased pleiotropic risk for hyperglycemia and altered bone mineral density. Cell Metabolism. 33 (3), 615-628 (2021).
- Esen, E., Lee, S. Y., Wice, B. M., Long, F. PTH promotes bone anabolism by stimulating aerobic glycolysis via IGF signaling. Journal of Bone and Mineral Research. 30 (11), 1959-1968 (2015).
- Borle, A. B., Nichols, N., Nichols, G. Metabolic studies of bone in vitro: I. Normal bone. Journal of Biological Chemistry. 235, 1206-1210 (1960).
- Borle, A. B., Nichols, N., Nichols, G. Metabolic studies of bone in vitro: II. The metabolic patterns of accretion and resorption. Journal of Biological Chemistry. 235, 1211-1214 (1960).
- Adamek, G., Felix, R., Guenther, H. L., Fleisch, H. Fatty acid oxidation in bone tissue and bone cells in culture. Characterization and hormonal influences. The Biochemical Journal. 248 (1), 129-137 (1987).
- Frey, J. L., et al. Wnt-Lrp5 signaling regulates fatty acid metabolism in the osteoblast. Molecular and Cellular Biology. 35 (11), 1979-1991 (2015).
- Romero, N., Rogers, G., Neilson, A., Dranka, B. P. . Quantifying cellular ATP production rate using agilent seahorse XF technology. , (2018).
- vander Windt, G., Chang, C., Pearce, E. Measuring bioenergetics in T cells using a Seahorse Extracellular Flux Analyzer. Current Protocols in Immunology. 113, 1 (2016).
- Traba, J., Miozzo, P., Akkaya, B., Pierce, S. K., Akkaya, M. An optimized protocol to analyze glycolysis and mitochondrial respiration in lymphocytes. Journal of Visualized Experiments:JoVE. (117), e54918 (2016).
- Noel, P., et al. Preparation and metabolic assay of 3-dimensional spheroid co-cultures of pancreatic cancer cells and fibroblasts. Journal of Visualized Experiments:JoVE. (126), e56081 (2017).
- Nicholls, D., et al. Bioenergetic profile experiment using C2C12 myoblast cells. Journal of Visualized Experiments: JoVE. (46), e2511 (2010).
- Sakamuri, S. S. V. P., et al. Measurement of respiratory function in isolated cardiac mitochondria using Seahorse XFe24 Analyzer: applications for aging research. GeroScience. 40 (3), 347-356 (2018).
- . What are the advantages of using Seahorse XF technology Available from: https://wwwagilent.com/en/support/cell-analysis/advantages-of-using-xf-tech (2018)
- Horan, M. P., Pichaud, N., Ballard, J. W. O. Review: Quantifying mitochondrial dysfunction in complex diseases of aging. Journals of Gerontology – Series A Biological Sciences and Medical Sciences. 67 (10), 1022-1035 (2012).
- . XF cell energy phenotype test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740884 (2021)
- Leung, D. T. H., Chu, S. Measurement of oxidative stress: Mitochondrial function using the seahorse system. Methods in Molecular Biology. 1710, 285-293 (2018).
- . XF ATP rate assay Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740889 (2021)
- . XF cell mito stress test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740885 (2021)
- . XF cell mito fuel flex test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740888 (2021)
- Maridas, D. E., Rendina-Ruedy, E., Le, P. T., Rosen, C. J. Isolation, culture, and differentiation of bone marrow stromal cells and osteoclast progenitors from mice. Journal of Visualized Experiments: JoVE. (131), e56750 (2018).
- Wei, J., et al. Glucose uptake and Runx2 synergize to orchestrate osteoblast differentiation and bone formation. Cell. 161 (7), 1576-1591 (2015).
- Zoch, M. L., Abou, D. S., Clemens, T. L., Thorek, D. L. J., Riddle, R. C. In vivo radiometric analysis of glucose uptake and distribution in mouse bone. Bone Research. 4, 16004 (2016).
- Divakaruni, A. S., Paradyse, A., Ferrick, D. A., Murphy, A. N., Jastroch, M. Analysis and interpretation of microplate-based oxygen consumption and pH data. Methods in Enzymology. 547, 309-354 (2014).
- Kam, Y., Jastromb, N., Clayton, J., Held, P., Dranka, B. . Normalization of agilent seahorse XF data by in-situ cell counting using a BioTek cytation 5 application note. , (2017).

