Bioreator de perfusão multi-fluxo integrado com fracionamento de saída para cultura celular dinâmica
Summary
Este artigo apresenta um método de construção e operação de um sistema de cultura celular de perfusão multicanal de baixo custo para medir a dinâmica das taxas de secreção e absorção de solutos em processos celulares. O sistema também pode expor as células a perfis dinâmicos de estímulo.
Abstract
Certas funções celulares e teciduais operam dentro da escala de tempo dinâmica de minutos a horas que são mal resolvidas pelos sistemas de cultura convencionais. Este trabalho desenvolveu um sistema bioreator de perfusão de baixo custo que permite que o meio da cultura seja continuamente perfundido em um módulo de cultura celular e fracionado em um módulo a jusante para medir a dinâmica nesta escala. O sistema é construído quase inteiramente a partir de peças comercialmente disponíveis e pode ser paralelo à realização de experimentos independentes em placas convencionais de cultura celular multi-poço simultaneamente. Este artigo de vídeo demonstra como montar a configuração base, que requer apenas uma única bomba de seringa multicanal e um coletor de frações modificado para perfundir até seis culturas em paralelo. Variantes úteis no design modular também são apresentadas que permitem dinâmicas de estimulação controlada, como pulsos solutos ou perfis farmacocinéticos. É importante ressaltar que, à medida que os sinais solutos viajam pelo sistema, eles são distorcidos devido à dispersão de soluto. Além disso, é descrito um método para medir as distribuições de tempo de residência (RTDs) dos componentes da configuração de perfusão com um rastreador usando o MATLAB. Os RTDs são úteis para calcular como os sinais soluto são distorcidos pelo fluxo no sistema multipartidário. Este sistema é altamente robusto e reprodutível, de modo que pesquisadores básicos podem facilmente adotá-lo sem a necessidade de instalações especializadas de fabricação.
Introduction
Muitos processos biológicos importantes ocorrem nas culturas celular e tecidual na escala de tempo de minutos parahoras 1,2,3. Embora alguns desses fenômenos possam ser observados e registrados de forma automatizada usando microscopia de lapso de tempo4, bioluminescência1 ou outros métodos, experimentos envolvendo a coleta de amostras supernantes culturais para análise química são frequentemente realizados manualmente em culturas celulares estáticas. A amostragem manual limita a viabilidade de certos estudos devido à inconveniência de pontos de tempo de amostragem frequentes ou pós-horas. Outras deficiências dos métodos de cultura estática incluem experimentos envolvendo exposições controladas e transitórias a estímulos químicos. Em culturas estáticas, os estímulos devem ser adicionados e removidos manualmente, e os perfis de estímulo são limitados a mudanças de passo ao longo do tempo, enquanto as alterações médias também adicionam e removem outros componentes médios, o que pode afetar as células de forma descontrolada5. Sistemas fluidos podem superar esses desafios, mas os dispositivos existentes representam outros desafios. Os dispositivos microfluidos vêm com os custos proibitivos de equipamentos especializados e treinamento para produzir e usar, exigem métodos microanalíticos para processar amostras, e as células são difíceis de recuperar dos dispositivos após a perfusão6. Poucos sistemas macrofluidos foram criados para os tipos de experimentos descritos aqui 7,8,9,10, e eles são construídos de múltiplas peças personalizadas feitas internamente e requerem várias bombas ou coletores de frações. Além disso, os autores não estão cientes de quaisquer sistemas de cultura celular de perfusão macrofluida disponíveis comercialmente além de bioreatores de tanques agitados para cultura de suspensão, que são úteis para a biomagrafação, embora não sejam projetados para modelagem e estudo da fisiologia.
Os autores relataram anteriormente sobre o projeto de um sistema bioreator de perfusão de baixo custo composto quase inteiramente de peças disponíveis comercialmente11. A versão base do sistema permite que várias culturas em uma placa de poço sejam mantidas em uma incubadora de CO2 e continuamente perfundidas com meio de uma bomba de seringa, enquanto os fluxos médios de efluentes das culturas são automaticamente fracionados em amostras ao longo do tempo usando um coletor de frações com uma modificação personalizada. Assim, este sistema permite a amostragem automatizada de cultura média supernaciante e entrada soluto contínua para as culturas ao longo do tempo. O sistema é macrofluido e modular e pode ser facilmente modificado para atender às necessidades de novos projetos de experimentos.
O objetivo geral do método aqui apresentado é construir, caracterizar e usar um sistema de cultura celular de perfusão que permita experimentos nos quais as taxas de secreção ou absorção de substâncias por células ao longo do tempo são medidas, e/ou células são expostas a sinais de soluto precisos e transitórios. Este artigo de vídeo explica como montar a configuração base, que é capaz de perfundar até seis culturas celulares simultaneamente usando uma única bomba de seringa e coletor de frações modificada. Duas variantes úteis no sistema base que fazem uso de bombas e peças adicionais para permitir experimentos que expõem células a sinais transitórios de concentração de soluto, incluindo pulsos breves e perfis farmacocinéticos12, também são apresentadas, mostradas na Figura 1.
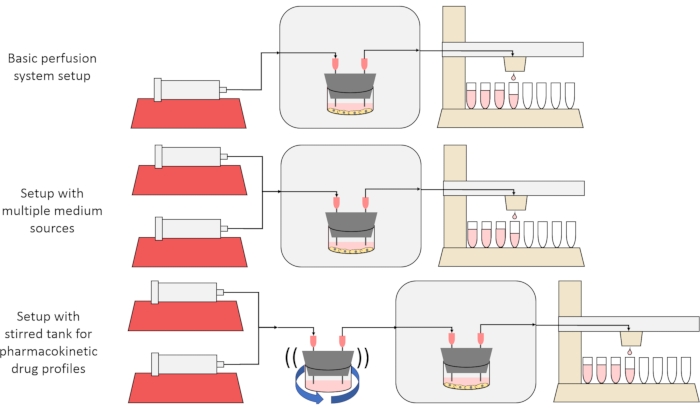
Figura 1: Três variações no desenho do sistema de perfusão. (Topo) O sistema básico de perfusão. (Meio) O sistema de perfusão com uma torneira para múltiplas fontes médias. (Inferior) O sistema de perfusão com um tanque mexido para imitar um volume bem misturado de distribuição. Clique aqui para ver uma versão maior desta figura.
Devido à dispersão e difusão dentro do fluxo, os sinais de solute ficam distorcidos ou “manchados” à medida que viajam pelo sistema de fluxo. Essa distorção pode ser quantificada através do uso de distribuições de tempo de residência (RTDs)13. Este artigo explica como realizar experimentos rastreadores em componentes do sistema de perfusão (Figura 2) e fornece scripts MATLAB para gerar RTDs a partir de dados medidos. Uma explicação detalhada desta análise pode ser encontrada no artigo anterior11 dos autores. Scripts MATLAB adicionais se encaixam em funções apropriadas aos RTDs e extraem parâmetros físicos e executam a convolução de sinais usando RTDs para prever como a entrada de sinal soluto pelo usuário irá propagar e distorcer através do sistema de perfusão14.
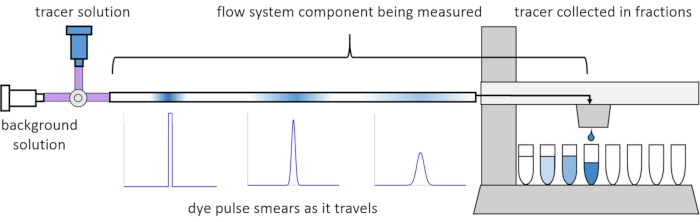
Figura 2: Distribuição de tempo de residência. Os RTDs dos componentes do sistema de fluxo, como este comprimento da tubulação, são medidos inserindo um pulso de rastreador no sistema e medindo como ele “mancha” no momento em que ele sai para as frações coletadas. Este número foi modificado de Erickson et al.11. Clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
Este trabalho descreve a montagem e o funcionamento de um sistema de cultura celular de perfusão com múltiplas fontes médias demonstradas com um exemplo específico no qual a dinâmica da expressão genética orientada pelo NF-κB em resposta a um pulso transitório de TNF-α foram medidas. Os RTDs dos componentes do sistema de perfusão foram medidos e modelados, e a convolução de sinal foi usada para prever tanto a exposição das células ao pulso TNF-α quanto a distribuição de α TNF nas frações médias col…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Esta pesquisa foi conduzida com apoio sob Grant Nos. R01EB012521, R01EB028782 e T32 GM008339 dos Institutos Nacionais de Saúde.
Materials
| 18 Gauge 1 1/2- in Disposable Probe Needle For Use With Syringes and Dispensing Machines | Grainger | 5FVK2 | |
| 293T Cells | ATCC | CRL-3216 | HEK 293T cells used in the Representative Results experiment. |
| 96-Well Clear Bottom Plates, Corning | VWR | 89091-010 | Plates for measuring dye concentrations in RTD experiments and GLuc in representative results experiment. |
| BD Disposable Syringes with Luer-Lok Tips, 5 mL | Fisher Scientific | 14-829-45 | |
| BioFrac Fraction Collector | Bio-Rad | 7410002 | Fraction collector that can be used for a single stream, or modified using our method to enable collection from multiple streams. |
| Clear High-Strength UV-Resistant Acrylic 12" x 12" x 1/8" | McMaster-Carr | 4615T93 | This sheet is cut using a laser cutter according to the DXF file in the supplemental materials to produce the multi-head dispenser that can be attached to the BioFrac fraction collector. |
| Coelenterazine native | NanoLight Technology | 303 | Substrate used in Gaussia luciferase bioluminescence assay in representative results. |
| Corning Costar TC-Treated Multiple Well Plates, size 48 wells, polystyrene plate, flat bottom wells | Millipore Sigma | CLS3548 | Used to grow and perfuse 293T cells in representative results. |
| Corning Costar Flat Bottom Cell Culture Plates, size 12 wells | Fisher Scientific | 720081 | Can be plugged and used as a stirred tank to produce pharmacokinetic profiles in perfusion. Can also contain cells for perfusion. |
| DMEM, high glucose | ThermoFisher Scientific | 11965126 | |
| Epilog Zing 24 Laser | Cutting Edge Systems | Epilog Zing 24 | Laser cutter used to produce multi-head dispenser from acrylic sheet. Other laser cutters may be used. |
| Fisherbrand Sterile Syringes for Single Use, Luer-Lock, 20 mL | Fisher Scientific | 14-955-460 | |
| Fisherbrand Sterile Syringes for Single Use, Luer-Lock, 60 mL | Fisher Scientific | 14-955-461 | |
| Fisherbrand Premium Microcentrifuge Tubes: 1.5mL | Fisher Scientific | 05-408-129 | Microcentrifuge tubes for collecting fractions. |
| Fisherbrand Round Bottom Disposable Borosilicate Glass Tubes with Plain End | Fisher Scientific | 14-961-26 | Glass tubes for collecting fractions. |
| Fisherbrand SureOne Micropoint Pipette Tips, Universal Fit, Non-Filtered | Fisher Scientific | 2707410 | 300 ul pipette tips that best fit the multi-head dispenser and tubing to act as dispensing tips. |
| Gibco DPBS, powder, no calcium, no magnesium | Fisher Scientific | 21600010 | Phosphate buffered saline. |
| Labline 4625 Titer Shaker | Marshall Scientific | Labline 4625 Titer Shaker | Orbital shaker used to keep stirred tanks mixed. |
| Masterflex Fitting, Polycarbonate, Four-Way Stopcock, Male Luer Lock, Non-Sterile; 10/PK | Cole-Parmer | EW-30600-04 | Used to join multiple inlet streams for RTD experiments and cell culture experiments. |
| Masterflex Fitting, Polycarbonate, Straight, Female Luer x Cap; 25/PK | Masterflex | UX-45501-28 | |
| Masterflex Fitting, Polypropylene, Straight, Female Luer to Hosebarb Adapters, 1/16" | Cole-Parmer | EW-45508-00 | |
| Masterflex Fitting, Polypropylene, Straight, Male Luer Lock to Hosebarb Adapter, 1/16" ID | Cole-Parmer | EW-45518-00 | |
| Masterflex Fitting, Polypropylene, Straight, Male Luer Lock to Plug Adapter; 25/PK | Masterflex | EW-30800-30 | |
| Masterflex L/S Precision Pump Tubing, Platinum-Cured Silicone, L/S 14; 25 ft | Masterflex | EW-96410-14 | |
| MATLAB | MathWorks | R2019b | Version R2019b. Newer versions may also be used. Some older versions may work. |
| NE-1600 Six Channel Programmable Syringe Pump | New Era Pump Systems | NE-1600 | |
| Rack Set F1 | Bio-Rad | 7410010 | Racks to hold collecting tubes in the fraction collector. |
| Recombinant Human TNF-alpha (HEK293-expressed) Protein, CF | Bio-Techne | 10291-TA-020 | Cytokine used to stimulate 293T cells in representative results. |
| Saint Gobain Solid Stoppers, Versilic Silicone, Size: 00, Bottom 10.5mm | Saint Gobain | DX263015-50 | Fits 48-well plates. |
| Saint Gobain Solid Stoppers, Versilic Silicone, Size: 4 Bottom 21mm | Saint Gobain | DX263027-10 | Fits 12-well plates. |
| Sodium Hydroxide, 10.0 N Aqueous Solution APHA; 1 L | Spectrum Chemicals | S-395-1LT | |
| SolidWorks | Dassault Systems | SolidWorks | CAD software used to create the multi-head dispenser DXF file. |
| Varioskan LUX multimode microplate reader | ThermoFisher Scientific | VL0000D0 | Plate reader. |
| Wilton Color Right Performance Color System Base Refill, Blue | Michaels | 10404779 | Blue food dye containing Brilliant Blue FCF, used as a tracer in RTD experiments. Absorbance spectrum peaks at 628 nm. |
Riferimenti
- Welsh, D. K., Yoo, S. H., Liu, A. C., Takahashi, J. S., Kay, S. A. Bioluminescence imaging of individual fibroblasts reveals persistent, independently phased circadian rhythms of clock gene expression. Current Biology. 14 (24), 2289-2295 (2004).
- Talaei, K., et al. A mathematical model of the dynamics of cytokine expression and human immune cell activation in response to the pathogen Staphylococcus aureus. Frontiers in Cellular and Infection Microbiology. 11, 711153 (2021).
- Kemas, A. M., Youhanna, S., Zandi Shafagh, R., Lauschke, V. M. Insulin-dependent glucose consumption dynamics in 3D primary human liver cultures measured by a sensitive and specific glucose sensor with nanoliter input volume. FASEB Journal. 35 (3), 21305 (2021).
- Muzzey, D., van Oudenaarden, A. Quantitative time-lapse fluorescence microscopy in single cells. Annual Review of Cell and Developmental Biology. 25, 301-327 (2009).
- Calligaro, H., Kinane, C., Bennis, M., Coutanson, C., Dkhissi-Benyahya, O. A standardized method to assess the endogenous activity and the light-response of the retinal clock in mammals. Molecular Vision. 26, 106-116 (2020).
- Battat, S., Weitz, D. A., Whitesides, G. M. An outlook on microfluidics: the promise and the challenge. Lab on a Chip. 22 (3), 530-536 (2022).
- Petrenko, V., Saini, C., Perrin, L., Dibner, C. Parallel measurement of circadian clock gene expression and hormone secretion in human primary cell cultures. Journal of Visualized Experiments. (117), e54673 (2016).
- Yamagishi, K., Enomoto, T., Ohmiya, Y. Perfusion-culture-based secreted bioluminescence reporter assay in living cells. Analytical Biochemistry. 354 (1), 15-21 (2006).
- Watanabe, T., et al. Multichannel perfusion culture bioluminescence reporter system for long-term detection in living cells. Analytical Biochemistry. 402 (1), 107-109 (2010).
- Murakami, N., Nakamura, H., Nishi, R., Marumoto, N., Nasu, T. Comparison of circadian oscillation of melatonin release in pineal cells of house sparrow, pigeon and Japanese quail, using cell perfusion systems. Brain Research. 651 (1-2), 209-214 (1994).
- Erickson, P., Houwayek, T., Burr, A., Teryek, M., Parekkadan, B. A continuous flow cell culture system for precision cell stimulation and time-resolved profiling of cell secretion. Analytical Biochemistry. 625, 114213 (2021).
- Saltzman, W. M. . Drug Delivery: Engineering Principles for Drug Therapy. , (2001).
- Fogler, H. S. . Elements of Chemical Reaction Engineering. 4th edn. , (2006).
- Conesa, J. A. . Chemical Reactor Design: Mathematical Modeling and Applications. , (2019).
- Toson, P., Doshi, P., Jajcevic, D. Explicit residence time distribution of a generalised cascade of continuous stirred tank reactors for a description of short recirculation time (bypassing). Processes. 7 (9), 615 (2019).
- Tamayo, A. G., Shukor, S., Burr, A., Erickson, P., Parekkadan, B. Tracking leukemic T-cell transcriptional dynamics in vivo with a blood-based reporter assay. FEBS Open Biology. 10 (9), 1868-1879 (2020).
- Newell, B., Bailey, J., Islam, A., Hopkins, L., Lant, P. Characterising bioreactor mixing with residence time distribution (RTD) tests. Water Science and Technology. 37 (12), 43-47 (1998).
- Dubois, J., Tremblay, L., Lepage, M., Vermette, P. Flow dynamics within a bioreactor for tissue engineering by residence time distribution analysis combined with fluorescence and magnetic resonance imaging to investigate forced permeability and apparent diffusion coefficient in a perfusion cell culture chamber. Biotechnology and Bioengineering. 108 (10), 2488-2498 (2011).
- Gaida, L. B., et al. Liquid and gas residence time distribution in a two-stage bioreactor with cell recycle. HAL Open Science. , (2008).
- Rodrigues, M. E., Costa, A. R., Henriques, M., Azeredo, J., Oliveira, R. Wave characterization for mammalian cell culture: residence time distribution. New Biotechnology. 29 (3), 402-408 (2012).
- Olivet, D., Valls, J., Gordillo, M. A., Freixó, A., Sánchez, A. Application of residence time distribution technique to the study of the hydrodynamic behaviour of a full-scale wastewater treatment plant plug-flow bioreactor. Journal of Chemical Technology and Biotechnology. 80 (4), 425-432 (2005).

