Dinamik Hücre Kültürü için Çıkış Fraksiyonasyonu ile Entegre Çok Akışlı Perfüzyon Biyoreaktörü
Summary
Bu yazıda, hücresel proseslerde çözünenlerin sekresyon dinamiklerini ve absorpsiyon oranlarını ölçmek için düşük maliyetli, çok kanallı bir perfüzyon hücre kültürü sistemi kurmak ve çalıştırmak için bir yöntem sunulmaktadır. Sistem ayrıca hücreleri dinamik uyaran profillerine maruz bırakabilir.
Abstract
Bazı hücre ve doku fonksiyonları, geleneksel kültür sistemleri tarafından zayıf bir şekilde çözülen dakikalar ila saatler arasındaki dinamik zaman ölçeği içinde çalışır. Bu çalışma, kültür ortamının sürekli olarak bir hücre kültürü modülüne perfüze edilmesini ve bu ölçekteki dinamikleri ölçmek için bir aşağı akış modülünde fraksiyone edilmesini sağlayan düşük maliyetli bir perfüzyon biyoreaktör sistemi geliştirmiştir. Sistem neredeyse tamamen ticari olarak temin edilebilen parçalardan inşa edilmiştir ve aynı anda geleneksel çok kuyulu hücre kültürü plakalarında bağımsız deneyler yapmak için paralelleştirilebilir. Bu video makalesinde, yalnızca tek bir çok kanallı şırınga pompası ve paralel olarak altı kültüre kadar perfüze etmek için modifiye edilmiş bir fraksiyon kolektörü gerektiren taban kurulumunun nasıl monte edileceği gösterilmektedir. Modüler tasarımdaki yararlı varyantlar, çözünen darbeler veya farmakokinetik benzeri profiller gibi kontrollü stimülasyon dinamiklerine izin veren de sunulmaktadır. Daha da önemlisi, çözünen sinyaller sistemden geçerken, çözünmüş dağılım nedeniyle bozulurlar. Ayrıca, perfüzyon kurulumunun bileşenlerinin ikamet süresi dağılımlarını (RTD’ler) MATLAB kullanarak bir izleyici ile ölçmek için bir yöntem açıklanmaktadır. RTD’ler, çözünen sinyallerin çok bölmeli sistemdeki akış tarafından nasıl bozulduğunu hesaplamak için kullanışlıdır. Bu sistem son derece sağlam ve tekrarlanabilir, bu nedenle temel araştırmacılar özel üretim tesislerine ihtiyaç duymadan kolayca benimseyebilirler.
Introduction
Birçok önemli biyolojik süreç, hücre ve doku kültürlerinde dakikalar ila saatlerarasında 1,2,3 zaman ölçeğinde gerçekleşir. Bu fenomenlerin bazıları hızlandırılmış mikroskopi4, biyolüminesans1 veya diğer yöntemler kullanılarak otomatik bir şekilde gözlemlenebilir ve kaydedilebilirken, kimyasal analiz için kültür süpernatant örneklerinin toplanmasını içeren deneyler genellikle statik hücre kültürlerinde manuel olarak gerçekleştirilir. Manuel örnekleme, sık veya mesai saatleri dışında örnekleme zaman noktalarının rahatsızlığı nedeniyle belirli çalışmaların fizibilitesini sınırlar. Statik kültür yöntemlerinin diğer eksiklikleri, kimyasal uyaranlara kontrollü, geçici maruziyetleri içeren deneyleri içerir. Statik kültürlerde, uyaranlar manuel olarak eklenmeli ve çıkarılmalıdır ve uyaran profilleri zaman içindeki adım değişiklikleriyle sınırlıdır, orta değişiklikler de hücreleri kontrolsüz bir şekilde etkileyebilecek diğer ortam bileşenlerini ekler ve kaldırır5. Akışkan sistemler bu zorlukların üstesinden gelebilir, ancak mevcut cihazlar başka zorluklar da doğurur. Mikroakışkan cihazlar, özel ekipmanın ve üretim ve kullanım eğitiminin engelleyici maliyetleri ile birlikte gelir, numuneleri işlemek için mikroanalitik yöntemler gerektirir ve perfüzyon6’dan sonra hücrelerin cihazlardan kurtarılması zordur. Burada açıklanandeney türleri için birkaç makroakışkan sistem oluşturulmuştur 7,8,9,10 ve bunlar şirket içinde yapılan birden fazla özel parçadan yapılmıştır ve birden fazla pompa veya fraksiyon toplayıcı gerektirir. Ayrıca, yazarlar, biyoüretim için yararlı olan, ancak fizyolojiyi modellemek ve incelemek için tasarlanmamış, süspansiyon kültürü için karıştırılmış tank biyoreaktörleri dışında, ticari olarak temin edilebilen herhangi bir makroakışkan perfüzyon hücre kültürü sisteminin farkında değildir.
Yazarlar daha önce neredeyse tamamen ticari olarak temin edilebilen parçalardan oluşan düşük maliyetli bir perfüzyon biyoreaktör sisteminin tasarımı hakkında rapor vermişlerdi11. Sistemin baz versiyonu, bir kuyu plakasındaki birden fazla kültürün bir CO2 inkübatöründe tutulmasını ve bir şırınga pompasından gelen ortamla sürekli olarak perfüze edilmesini sağlarken, kültürlerden gelen atık su ortam akışları, özel bir modifikasyona sahip bir fraksiyon toplayıcı kullanılarak zaman içinde otomatik olarak numunelere bölünür. Böylece, bu sistem kültür ortamı süpernatantının otomatik örneklemesini ve zaman içinde kültürlere sürekli çözünen girdiyi mümkün kılar. Sistem makroakışkan ve modülerdir ve yeni deney tasarımlarının ihtiyaçlarını karşılamak için kolayca değiştirilebilir.
Burada sunulan yöntemin genel amacı, maddelerin zaman içinde hücreler tarafından salgılanma veya emilim oranlarının ölçüldüğü ve / veya hücrelerin hassas, geçici çözünen sinyallere maruz kaldığı deneylere olanak tanıyan bir perfüzyon hücre kültürü sistemi oluşturmak, karakterize etmek ve kullanmaktır. Bu video makalesinde, tek bir şırınga pompası ve modifiye fraksiyon toplayıcı kullanarak aynı anda altı adede kadar hücre kültürünü perfüze edebilen baz kurulumunun nasıl monte edileceği açıklanmaktadır. Baz sistemde, hücreleri kısa darbeler ve farmakokinetik benzeri profiller12 dahil olmak üzere geçici çözünen konsantrasyon sinyallerine maruz bırakan deneylere izin vermek için ek pompalar ve parçalardan yararlanan iki yararlı varyant da Şekil 1’de gösterilmiştir.
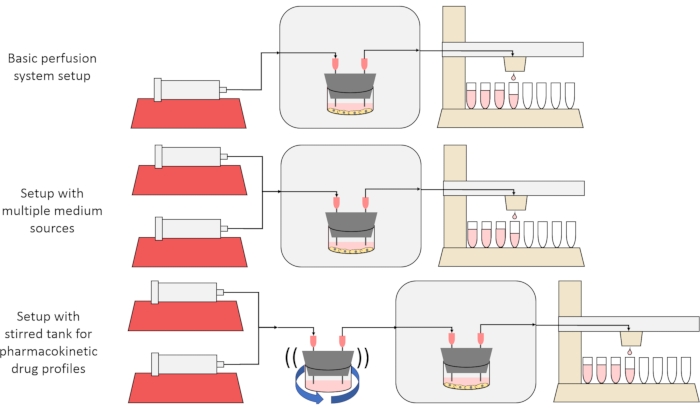
Resim 1: Perfüzyon sistemi tasarımı üzerinde üç varyasyon . (Top) Temel perfüzyon sistemi. (Orta) Birden fazla orta kaynak için bir stopcock ile perfüzyon sistemi. (Altta) İyi karıştırılmış bir dağılım hacmini taklit etmek için karıştırılmış bir tanka sahip perfüzyon sistemi. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Akış içindeki dağılım ve difüzyon nedeniyle, çözünen sinyaller akış sisteminden geçerken bozulur veya “bulaşır”. Bu bozulma, ikamet süresi dağılımları (RTD’ler) kullanılarak ölçülebilir13. Bu makalede, perfüzyon sisteminin bileşenleri üzerinde izleyici deneylerinin nasıl gerçekleştirileceği açıklanmaktadır (Şekil 2) ve ölçülen verilerden RTD’ler oluşturmak için MATLAB komut dosyaları sağlanmaktadır. Bu analizin ayrıntılı bir açıklaması, yazarların önceki makalesi11’de bulunabilir. Ek MATLAB komut dosyaları, RTD’lere uygun işlevler sığdırır ve fiziksel parametreleri çıkarır ve kullanıcı tarafından çözünen sinyal girişinin perfüzyon sistemi14 aracılığıyla nasıl yayılacağını ve bozulacağını tahmin etmek için RTD’leri kullanarak sinyal evrişimi gerçekleştirir.
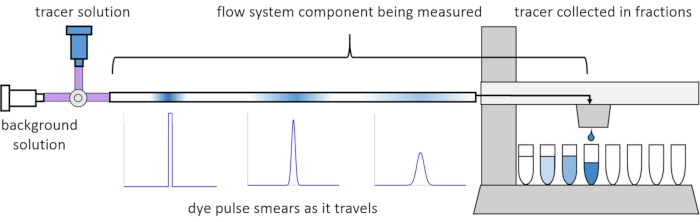
Şekil 2: İkamet süresi dağılımları. Bu boru uzunluğu gibi akış sistemi bileşenlerinin RTD’leri, sisteme bir izleyici darbesi girerek ve toplanan fraksiyonlara çıktığı zamana kadar nasıl “bulaştığını” ölçerek ölçülür. Bu rakam Erickson ve ark.11’den değiştirilmiştir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Protocol
Representative Results
Discussion
Bu çalışma, TNF-α geçici bir darbesine yanıt olarak NF-κB güdümlü gen ekspresyonunun dinamiklerinin ölçüldüğü spesifik bir örnekle gösterilen çoklu ortam kaynaklarına sahip bir perfüzyon hücre kültürü sisteminin montajını ve çalışmasını açıklamaktadır. Perfüzyon sistemi bileşenlerinin RTD’leri ölçüldü ve modellendi ve hem hücrelerin TNF-α darbesine maruz kalmasını hem de toplanan atık su orta fraksiyonlarındaki TNF-α dağılımını tahmin etmek için sinyal evrişimi kulla…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Bu araştırma Hibe No’lu destek ile yürütülmüştür. Ulusal Sağlık Enstitüleri’nden R01EB012521, R01EB028782 ve T32 GM008339.
Materials
| 18 Gauge 1 1/2- in Disposable Probe Needle For Use With Syringes and Dispensing Machines | Grainger | 5FVK2 | |
| 293T Cells | ATCC | CRL-3216 | HEK 293T cells used in the Representative Results experiment. |
| 96-Well Clear Bottom Plates, Corning | VWR | 89091-010 | Plates for measuring dye concentrations in RTD experiments and GLuc in representative results experiment. |
| BD Disposable Syringes with Luer-Lok Tips, 5 mL | Fisher Scientific | 14-829-45 | |
| BioFrac Fraction Collector | Bio-Rad | 7410002 | Fraction collector that can be used for a single stream, or modified using our method to enable collection from multiple streams. |
| Clear High-Strength UV-Resistant Acrylic 12" x 12" x 1/8" | McMaster-Carr | 4615T93 | This sheet is cut using a laser cutter according to the DXF file in the supplemental materials to produce the multi-head dispenser that can be attached to the BioFrac fraction collector. |
| Coelenterazine native | NanoLight Technology | 303 | Substrate used in Gaussia luciferase bioluminescence assay in representative results. |
| Corning Costar TC-Treated Multiple Well Plates, size 48 wells, polystyrene plate, flat bottom wells | Millipore Sigma | CLS3548 | Used to grow and perfuse 293T cells in representative results. |
| Corning Costar Flat Bottom Cell Culture Plates, size 12 wells | Fisher Scientific | 720081 | Can be plugged and used as a stirred tank to produce pharmacokinetic profiles in perfusion. Can also contain cells for perfusion. |
| DMEM, high glucose | ThermoFisher Scientific | 11965126 | |
| Epilog Zing 24 Laser | Cutting Edge Systems | Epilog Zing 24 | Laser cutter used to produce multi-head dispenser from acrylic sheet. Other laser cutters may be used. |
| Fisherbrand Sterile Syringes for Single Use, Luer-Lock, 20 mL | Fisher Scientific | 14-955-460 | |
| Fisherbrand Sterile Syringes for Single Use, Luer-Lock, 60 mL | Fisher Scientific | 14-955-461 | |
| Fisherbrand Premium Microcentrifuge Tubes: 1.5mL | Fisher Scientific | 05-408-129 | Microcentrifuge tubes for collecting fractions. |
| Fisherbrand Round Bottom Disposable Borosilicate Glass Tubes with Plain End | Fisher Scientific | 14-961-26 | Glass tubes for collecting fractions. |
| Fisherbrand SureOne Micropoint Pipette Tips, Universal Fit, Non-Filtered | Fisher Scientific | 2707410 | 300 ul pipette tips that best fit the multi-head dispenser and tubing to act as dispensing tips. |
| Gibco DPBS, powder, no calcium, no magnesium | Fisher Scientific | 21600010 | Phosphate buffered saline. |
| Labline 4625 Titer Shaker | Marshall Scientific | Labline 4625 Titer Shaker | Orbital shaker used to keep stirred tanks mixed. |
| Masterflex Fitting, Polycarbonate, Four-Way Stopcock, Male Luer Lock, Non-Sterile; 10/PK | Cole-Parmer | EW-30600-04 | Used to join multiple inlet streams for RTD experiments and cell culture experiments. |
| Masterflex Fitting, Polycarbonate, Straight, Female Luer x Cap; 25/PK | Masterflex | UX-45501-28 | |
| Masterflex Fitting, Polypropylene, Straight, Female Luer to Hosebarb Adapters, 1/16" | Cole-Parmer | EW-45508-00 | |
| Masterflex Fitting, Polypropylene, Straight, Male Luer Lock to Hosebarb Adapter, 1/16" ID | Cole-Parmer | EW-45518-00 | |
| Masterflex Fitting, Polypropylene, Straight, Male Luer Lock to Plug Adapter; 25/PK | Masterflex | EW-30800-30 | |
| Masterflex L/S Precision Pump Tubing, Platinum-Cured Silicone, L/S 14; 25 ft | Masterflex | EW-96410-14 | |
| MATLAB | MathWorks | R2019b | Version R2019b. Newer versions may also be used. Some older versions may work. |
| NE-1600 Six Channel Programmable Syringe Pump | New Era Pump Systems | NE-1600 | |
| Rack Set F1 | Bio-Rad | 7410010 | Racks to hold collecting tubes in the fraction collector. |
| Recombinant Human TNF-alpha (HEK293-expressed) Protein, CF | Bio-Techne | 10291-TA-020 | Cytokine used to stimulate 293T cells in representative results. |
| Saint Gobain Solid Stoppers, Versilic Silicone, Size: 00, Bottom 10.5mm | Saint Gobain | DX263015-50 | Fits 48-well plates. |
| Saint Gobain Solid Stoppers, Versilic Silicone, Size: 4 Bottom 21mm | Saint Gobain | DX263027-10 | Fits 12-well plates. |
| Sodium Hydroxide, 10.0 N Aqueous Solution APHA; 1 L | Spectrum Chemicals | S-395-1LT | |
| SolidWorks | Dassault Systems | SolidWorks | CAD software used to create the multi-head dispenser DXF file. |
| Varioskan LUX multimode microplate reader | ThermoFisher Scientific | VL0000D0 | Plate reader. |
| Wilton Color Right Performance Color System Base Refill, Blue | Michaels | 10404779 | Blue food dye containing Brilliant Blue FCF, used as a tracer in RTD experiments. Absorbance spectrum peaks at 628 nm. |
Riferimenti
- Welsh, D. K., Yoo, S. H., Liu, A. C., Takahashi, J. S., Kay, S. A. Bioluminescence imaging of individual fibroblasts reveals persistent, independently phased circadian rhythms of clock gene expression. Current Biology. 14 (24), 2289-2295 (2004).
- Talaei, K., et al. A mathematical model of the dynamics of cytokine expression and human immune cell activation in response to the pathogen Staphylococcus aureus. Frontiers in Cellular and Infection Microbiology. 11, 711153 (2021).
- Kemas, A. M., Youhanna, S., Zandi Shafagh, R., Lauschke, V. M. Insulin-dependent glucose consumption dynamics in 3D primary human liver cultures measured by a sensitive and specific glucose sensor with nanoliter input volume. FASEB Journal. 35 (3), 21305 (2021).
- Muzzey, D., van Oudenaarden, A. Quantitative time-lapse fluorescence microscopy in single cells. Annual Review of Cell and Developmental Biology. 25, 301-327 (2009).
- Calligaro, H., Kinane, C., Bennis, M., Coutanson, C., Dkhissi-Benyahya, O. A standardized method to assess the endogenous activity and the light-response of the retinal clock in mammals. Molecular Vision. 26, 106-116 (2020).
- Battat, S., Weitz, D. A., Whitesides, G. M. An outlook on microfluidics: the promise and the challenge. Lab on a Chip. 22 (3), 530-536 (2022).
- Petrenko, V., Saini, C., Perrin, L., Dibner, C. Parallel measurement of circadian clock gene expression and hormone secretion in human primary cell cultures. Journal of Visualized Experiments. (117), e54673 (2016).
- Yamagishi, K., Enomoto, T., Ohmiya, Y. Perfusion-culture-based secreted bioluminescence reporter assay in living cells. Analytical Biochemistry. 354 (1), 15-21 (2006).
- Watanabe, T., et al. Multichannel perfusion culture bioluminescence reporter system for long-term detection in living cells. Analytical Biochemistry. 402 (1), 107-109 (2010).
- Murakami, N., Nakamura, H., Nishi, R., Marumoto, N., Nasu, T. Comparison of circadian oscillation of melatonin release in pineal cells of house sparrow, pigeon and Japanese quail, using cell perfusion systems. Brain Research. 651 (1-2), 209-214 (1994).
- Erickson, P., Houwayek, T., Burr, A., Teryek, M., Parekkadan, B. A continuous flow cell culture system for precision cell stimulation and time-resolved profiling of cell secretion. Analytical Biochemistry. 625, 114213 (2021).
- Saltzman, W. M. . Drug Delivery: Engineering Principles for Drug Therapy. , (2001).
- Fogler, H. S. . Elements of Chemical Reaction Engineering. 4th edn. , (2006).
- Conesa, J. A. . Chemical Reactor Design: Mathematical Modeling and Applications. , (2019).
- Toson, P., Doshi, P., Jajcevic, D. Explicit residence time distribution of a generalised cascade of continuous stirred tank reactors for a description of short recirculation time (bypassing). Processes. 7 (9), 615 (2019).
- Tamayo, A. G., Shukor, S., Burr, A., Erickson, P., Parekkadan, B. Tracking leukemic T-cell transcriptional dynamics in vivo with a blood-based reporter assay. FEBS Open Biology. 10 (9), 1868-1879 (2020).
- Newell, B., Bailey, J., Islam, A., Hopkins, L., Lant, P. Characterising bioreactor mixing with residence time distribution (RTD) tests. Water Science and Technology. 37 (12), 43-47 (1998).
- Dubois, J., Tremblay, L., Lepage, M., Vermette, P. Flow dynamics within a bioreactor for tissue engineering by residence time distribution analysis combined with fluorescence and magnetic resonance imaging to investigate forced permeability and apparent diffusion coefficient in a perfusion cell culture chamber. Biotechnology and Bioengineering. 108 (10), 2488-2498 (2011).
- Gaida, L. B., et al. Liquid and gas residence time distribution in a two-stage bioreactor with cell recycle. HAL Open Science. , (2008).
- Rodrigues, M. E., Costa, A. R., Henriques, M., Azeredo, J., Oliveira, R. Wave characterization for mammalian cell culture: residence time distribution. New Biotechnology. 29 (3), 402-408 (2012).
- Olivet, D., Valls, J., Gordillo, M. A., Freixó, A., Sánchez, A. Application of residence time distribution technique to the study of the hydrodynamic behaviour of a full-scale wastewater treatment plant plug-flow bioreactor. Journal of Chemical Technology and Biotechnology. 80 (4), 425-432 (2005).

