Microdissection and Whole Mount Scanning Electron Microscopy Visualization of Mouse Choroid Plexus
Summary
맥락막 신경총(CP)은 신경과학에서 충분히 연구되지 않은 조직으로 중추신경계의 건강과 질병에 중요한 역할을 합니다. 이 프로토콜은 CP를 분리하기 위한 미세 해부 기술과 세포 구조의 전체 보기를 얻기 위한 주사 전자 현미경의 사용을 설명합니다.
Abstract
맥락막 신경총(CP)은 뇌의 심실로 돌출된 고도로 혈관화된 구조로 신경과학에서 가장 잘 연구되지 않은 조직 중 하나입니다. 이 작은 구조가 중추신경계(CNS)의 건강과 질병에 중요한 역할을 한다는 것이 점점 더 분명해짐에 따라 기능적 분석에서 구조적 분석에 이르기까지 다운스트림 처리가 가능한 방식으로 뇌실에서 CP를 적절하게 해부하는 것이 가장 중요합니다. 여기서, 특수 도구 또는 장비를 필요로 하지 않는 외측 및 제4 뇌실 마우스 CP의 분리가 설명된다. 이 분리 기술은 CP 내에서 세포의 생존력, 기능 및 구조를 보존합니다. 높은 혈관 형성으로 인해 CP는 쌍안경 현미경을 사용하여 뇌의 심실 구멍 내부에 떠 있는 것을 시각화할 수 있습니다. 그러나, 다운스트림 분석에 필요한 경심 관류는 CP 조직의 식별을 복잡하게 할 수 있다. 추가 처리 단계(예: RNA 및 단백질 분석)에 따라 브로모페놀 블루를 사용한 경심 관류를 통해 CP를 시각화하여 해결할 수 있습니다. 분리 후 RNA, 단백질 또는 단일 세포 분석을 포함한 여러 기술을 사용하여 CP를 처리하여 이 특별한 뇌 구조의 기능에 대한 추가 이해를 얻을 수 있습니다. 여기서, 전체 마운트 CP의 주사 전자 현미경 (SEM)은 구조의 전체보기를 얻는 데 사용됩니다.
Introduction
단단한 장벽은 혈액-뇌 장벽(BBB)과 혈액-뇌척수액(CSF) 장벽을 포함하여 중추신경계(CNS)를 말초와 분리합니다. 이러한 장벽은 CNS를 외부 손상으로부터 보호하고 균형 잡히고 통제 된 미세 환경 1,2,3을 보장합니다. BBB는 시간이 지남에 따라 광범위하게 연구되었지만 맥락막 신경총(CP)에 위치한 혈액-CSF 장벽은 지난 10년 동안 연구 관심이 증가했습니다. 이 후자의 장벽은 뇌의 4 심실에서 발견 될 수 있으며 (그림 1A, B) 중심 간질, 새는 모세 혈관, 섬유 아세포, 림프 및 골수 세포 집단 (그림 1C)을 둘러싼 맥락막 신경총 상피 (CPE) 세포의 단일 층을 특징으로합니다 (그림 1C) 4,5,6. CPE 세포는 긴밀한 접합부로 단단히 연결되어 있어 밑에 있는 천공 혈액 모세혈관에서 뇌척수액과 뇌로 누출되는 것을 방지합니다. 또한, CPE 세포를 통한 수송은 혈액에서 CSF로의 유익한 화합물 (예 : 영양소 및 호르몬)의 유입과 다른 방향으로의 유해 분자 (예 : 대사 폐기물, 과도한 신경 전달 물질)의 유출을 관리하는 여러 내부 및 외부 수송 시스템에 의해 조절됩니다 1,6. 능동적 수송 기능을 발휘하기 위해 CPE 세포는 세포질에 수많은 미토콘드리아를 함유하고 있다7. 또한, CP는 뇌척수액의 주요 공급원이며 상주하는 염증 세포의 존재에 의해 뇌의 문지기 역할을 한다1. 혈액과 뇌 사이의 독특한 위치 때문에 CP는 면역 감시를 수행하기에 완벽한 위치에 있습니다8.
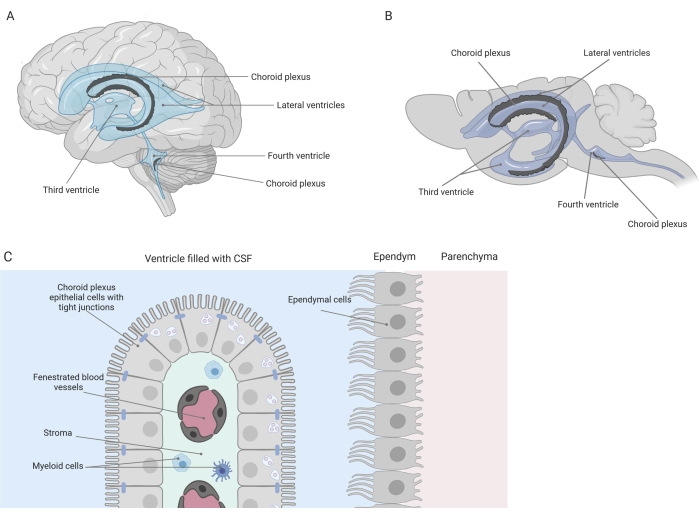
그림 1: 맥락막 신경총(CP)의 위치와 구성에 대한 개략도. (A,B) CP 조직은 (A) 인간 및 (B) 마우스 뇌의 두 측면, 제3 및 제4 뇌실 내에서 발견됩니다. (C) CP 조직은 천공된 모세혈관, 느슨한 결합 조직, 림프 및 골수 세포를 둘러싸고 있는 밀접하게 연결된 입방체 CP 상피(CPE) 세포의 단일 층으로 구성되며 혈액-뇌척수액 장벽을 형성합니다(참고문헌 23에서 적응 및 변형됨). Biorender.com 로 만든 그림입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
지난 10 년 동안 우리 연구 그룹의 여러 보고서를 포함하여 CP가 건강과 질병 9,10,11,12,13,14,15,16,17,18에서 중심적인 역할을한다는 증거가 증가하고 있습니다. 예를 들어, 노화된 혈액-CSF 장벽은 다른 것들 중에서도 핵, 미세융모 및 기저막에서 형태학적 변화를 나타내는 것으로 알려져 있다 1,19. 또한, 알츠하이머 병의 맥락에서, 전반적인 장벽 무결성이 손상되고 이러한 모든 연령 관련 변화는 훨씬 더 두드러지는 것으로 보인다 1,8,20. 형태학적 변화 이외에도, CP의 전사체, 프로테옴 및 세크레톰은 질병 12,21,22,23 동안 변경된다. 따라서 CP에 대한 고급 지식은 신경계 질환에서의 역할을 더 잘 이해하고 잠재적으로 새로운 치료 전략을 개발하는 데 필수적입니다.
뇌실에서 CP를 정확하게 미세 해부하는 효율적인 방법은 이 작은 뇌 구조를 적절하게 조사할 수 있는 첫 번째 귀중한 단계입니다. 혈관이 많이 발달된 특성(그림 2B)으로 인해 뇌의 심실 구멍 내부에 떠 있는 CP는 양안 현미경을 사용하여 식별할 수 있습니다. 그러나 다운스트림 분석에는 종종 경심 관류가 필요하므로 CP 조직의 적절한 식별 및 분리가 복잡해집니다(그림 2C). 추가 처리 단계가 허용하는 경우(예: RNA 및 단백질 분석의 경우) 브로모페놀 블루를 사용한 경심 관류를 통해 CP를 시각화할 수 있습니다(그림 2A). 몇몇 출판물은 이미 쥐24 와 쥐 강아지 뇌25에서 CP의 분리를 설명합니다. 여기서, 성체 마우스로부터 CP를 단리하기 위한 미세해부 분리 기술이 기재되어 있다. 중요하게도, 이 분리 기술은 CP 내에서 세포의 생존력, 기능 및 구조를 보존합니다. 제 4 심실과 외측 심실에 떠있는 CP의 격리가 여기에 설명되어 있습니다. 요컨대, 마우스는 말기 마취되고, 필요하다면 경심으로 관류된다. 그러나, 관류는 CP 내의 세포의 구조를 손상시킬 수 있다는 것에 유의해야 한다. 따라서 투과 전자 현미경(TEM), 직렬 블록 면 주사 전자 현미경(SBF-SEM) 또는 집속 이온 빔 SEM(FIB-SEM)을 사용하여 샘플을 분석해야 하는 경우 관류를 수행해서는 안 됩니다. 다음으로, 전체 뇌가 분리되고, 겸자는 뇌를 시상으로 반분해하는 데 사용됩니다. 여기에서 측심실에 떠 있는 CP를 식별하고 해부할 수 있으며, 제4뇌실의 CP는 뇌의 소뇌 쪽에서 분리할 수 있습니다.
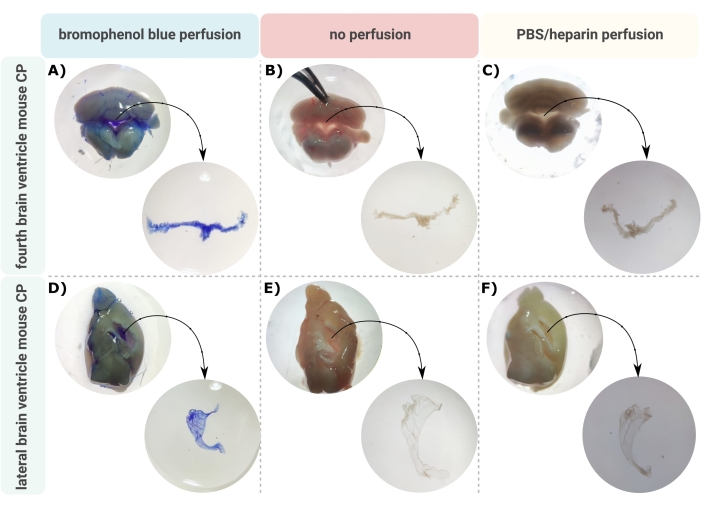
그림 2: (A,D) 브로모페놀 블루 관류, (B,E) 무관류 및 (C,F) PBS/헤파린 관류 후 (A-C) 네 번째 및 (D-F) 외측 심실 맥락막 신경총(CP)의 시각화. 이미지는 실체 현미경(8x-32x 배율)으로 촬영됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
CP가 뇌실에서 적절하게 해부되면 이 구조의 기능에 대한 더 깊은 이해를 얻기 위해 전체 기술 레퍼토리를 적용할 수 있습니다. 예를 들어, 유세포 분석 또는 단일 세포 RNA 시퀀싱은 특정 질병 조건 하에서 침윤성 염증 세포를 정량화하고 표현형적으로 분석하기 위해 수행될 수 있다26,27. 세포 조성 이외에도, CP의 분자 조성은 효소 결합 면역흡착 분석법(ELISA), 면역블롯을 통해 사이토카인 및 케모카인의 존재를 평가하거나, 사이토카인 비드 어레이(28)를 이용한 다중 사이토카인의 동시 분석을 통해 분석될 수 있다. 또한, 전사체, 혈관, 면역 세포 조직학 및 세크레톰 분석은 미세해부된 CP 외식편29에 대해 수행될 수 있다. 여기서, CP 구조의 전체적인 모습을 얻기 위해 전체 마운트 CP에 대한 주사전자현미경(SEM)을 사용한다. SEM은 집중된 전자 빔을 사용하여 표면을 스캔하고 표면의 지형과 구성에 대한 이미지를 만듭니다. 전자의 파장이 빛의 파장보다 훨씬 작기 때문에 SEM의 해상도는 나노미터 범위이며 광학 현미경의 해상도보다 우수합니다. 결과적으로, 세포 내 수준에 대한 형태학적 연구는 SEM을 통해 수행될 수 있습니다. 간단히 말해서, 해부된 CP는 하룻밤 고정을 위해 글루타르알데히드 함유 고정액으로 즉시 옮겨진 다음, 삼투화 및 우라닐 아세테이트 염색이 뒤따릅니다. 그런 다음 샘플을 납 아스파르테이트 염색으로 처리하고 탈수한 다음 궁극적으로 이미징을 위해 매립합니다.
따라서 이 프로토콜은 마우스 뇌실에서 CP의 효율적인 분리를 용이하게 하며, 이는 다양한 다운스트림 기술을 사용하여 추가로 분석하여 구조와 기능을 조사할 수 있습니다.
Protocol
Representative Results
Discussion
여기서는 마우스 뇌의 외측 뇌실과 제4뇌실에서 맥락막 신경총(CP)을 분리하는 방법을 설명합니다. CP의 이러한 전체 장착 방법은 CP 형태, 세포 구성, 전사체, 프로테옴 및 세크레톰의 완전한 보기를 얻기 위해 기술 레퍼토리를 사용하여 추가 분석을 용이하게 합니다. 이러한 분석은 뇌의 심실에서 돌출된 이 놀라운 구조를 더 잘 이해하는 데 중요합니다. CP가 건강과 질병 9,10,11,12,13,14,15,16,17,18에서 …
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
이 연구는 벨기에 알츠하이머 연구 재단 (SAO, 프로젝트 번호 : 20200032), 플랑드르 연구 재단 (FWO Vlaanderen, 프로젝트 번호 : 1268823N, 11D0520N, 1195021N) 및 Baillet Latour Fund의 지원을 받았습니다. 교육, 지원 및 계기 공원에 대한 액세스를 제공한 VIB BioImaging Core에 감사드립니다.
Materials
| 26G x 1/2 needle | Henke Sass Wolf | 4710004512 | |
| Aluminium specimen mounts | EM Sciences | 75220 | |
| Cacodylate buffer | EM Sciences | 11652 | |
| Carbon steel surgial blades | Swann-Morton | 0210 | size: 0.45 mm x 12 mm |
| Carbon adhesive tabs -12 mm | EM Sciences | 77825-12 | |
| Critical point dryer | Bal-Tec | CPD030 | |
| Crossbeam 540 | Zeiss | SEM system | |
| Forceps | Fine Science Tools GmbH | 91197-00 | |
| Glutaraldehyde | EM Sciences | 16220 | |
| Heparin | Sigma-Aldrich | H-3125 | |
| Ismatec Reglo ICC Digital Peristaltic pump 2-channel | Metrohm Belgium N.V | CPA-7800160 | |
| Osmium Tetroxide | EM Sciences | 19170 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Phosphate buffered saline (PBS) | Lonza | BE17-516F | |
| Platinum | Quorum | Q150T ES | PBS without Ca++ Mg++ or phenol red; sterile filtered |
| Sodium pentobarbital | Kela NV | 514 | |
| Specimen Basket Stainless Steel | EM Sciences | 70190-01 | |
| Stemi DV4 Stereo microscope | Zeiss | ||
| Surgical scissors | Fine Science Tools GmbH | 91460-11 |
Riferimenti
- Vandenbroucke, R. E. A hidden epithelial barrier in the brain with a central role in regulating brain homeostasis. Implications for aging. Annals of the American Thoracic Society. 13, 407-410 (2016).
- Engelhardt, B., Sorokin, L. The blood-brain and the blood-cerebrospinal fluid barriers: function and dysfunction. Seminars in Immunopathology. 31 (4), 497-511 (2009).
- Engelhardt, B., Wolburg-Buchholz, K., Wolburg, H. Involvement of the choroid plexus in central nervous system inflammation. Microscopy Research and Technique. 52 (1), 112-129 (2001).
- Engelhardt, B., Vajkoczy, P., Weller, R. O. The movers and shapers in immune privilege of the CNS. Nature Immunology. 18 (2), 123-131 (2017).
- De Bock, M., et al. A new angle on blood-CNS interfaces: a role for connexins. FEBS Letters. 588 (8), 1259-1270 (2014).
- Strazielle, N., Ghersi-Egea, J. F. Physiology of blood-brain interfaces in relation to brain disposition of small compounds and macromolecules. Molecular Pharmaceutics. 10 (5), 1473-1491 (2013).
- Redzic, Z. B., Segal, M. B. The structure of the choroid plexus and the physiology of the choroid plexus epithelium. Advanced Drug Delivery Reviews. 56 (12), 1695-1716 (2004).
- Kratzer, I., Ek, J., Stolp, H. The molecular anatomy and functions of the choroid plexus in healthy and diseased brain. Biochimica et Biophysica Acta-Biomembranes. 1862 (11), 183430 (2020).
- Demeestere, D., Libert, C., Vandenbroucke, R. E. Clinical implications of leukocyte infiltration at the choroid plexus in (neuro)inflammatory disorders. Drug Discovery Today. 20 (8), 928-941 (2015).
- Brkic, M., et al. Amyloid βoligomers disrupt blood-CSF barrier integrity by activating matrix metalloproteinases. Journal of Neuroscience. 35 (37), 12766-12778 (2015).
- Vandenbroucke, R. E., et al. Matrix metalloprotease 8-dependent extracellular matrix cleavage at the blood-CSF barrier contributes to lethality during systemic inflammatory diseases. Journal of Neuroscience. 32 (29), 9805-9816 (2012).
- Marques, F., et al. The choroid plexus response to a repeated peripheral inflammatory stimulus. BMC Neuroscience. 10, 135 (2009).
- Marques, F., et al. The choroid plexus in health and in disease: dialogues into and out of the brain. Neurobiology of Disease. 107, 32-40 (2017).
- Lun, M. P., Monuki, E. S., Lehtinen, M. K. Development and functions of the choroid plexus-cerebrospinal fluid system. Nature Reviews Neuroscience. 16 (8), 445-457 (2015).
- Spector, R., Keep, R. F., Snodgrass, S. R., Smith, Q. R., Johanson, C. E. A balanced view of choroid plexus structure and function: Focus on adult humans. Experimental Neurology. 267, 78-86 (2015).
- Lehtinen, M. K., et al. The choroid plexus and cerebrospinal fluid: emerging roles in development, disease, and therapy. Journal of Neuroscience. 33 (45), 17553-17559 (2013).
- Balusu, S., Brkic, M., Libert, C., Vandenbroucke, R. E. The choroid plexus-cerebrospinal fluid interface in Alzheimer’s disease: more than just a barrier. Neural Regeneration Research. 11 (4), 534-537 (2016).
- Demeestere, D., Libert, C., Vandenbroucke, R. E. Therapeutic implications of the choroid plexus-cerebrospinal fluid interface in neuropsychiatric disorders. Brain, Behavior, and Immunity. 50, 1-13 (2015).
- Simon, M. J., Iliff, J. J. Regulation of cerebrospinal fluid (CSF) flow in neurodegenerative, neurovascular and neuroinflammatory disease. Biochimica et Biophysica Acta-Molecular Basis of Disease. 1862 (3), 442-451 (2016).
- Serot, J. M., Zmudka, J., Jouanny, P. A possible role for CSF turnover and choroid plexus in the pathogenesis of late onset Alzheimer’s disease. Journal of Alzheimer’s Disease. 30 (1), 17-26 (2012).
- Marques, F., et al. Altered iron metabolism is part of the choroid plexus response to peripheral inflammation. Endocrinology. 150 (6), 2822-2828 (2009).
- Thouvenot, E., et al. The proteomic analysis of mouse choroid plexus secretome reveals a high protein secretion capacity of choroidal epithelial cells. Proteomics. 6 (22), 5941-5952 (2006).
- Vandendriessche, C., et al. Importance of extracellular vesicle secretion at the blood-cerebrospinal fluid interface in the pathogenesis of Alzheimer’s disease. Acta Neuropathologica Communications. 9 (1), 143 (2021).
- Bowyer, J. F., et al. A visual description of the dissection of the cerebral surface vasculature and associated meninges and the choroid plexus from rat brain. Journal of Visualized Experiments. (69), e4285 (2012).
- Inoue, T., Narita, K., Nonami, Y., Nakamura, H., Takeda, S. Observation of the ciliary movement of choroid plexus epithelial cells ex vivo. Journal of Visualized Experiments. (101), e52991 (2015).
- Dani, N., et al. A cellular and spatial map of the choroid plexus across brain ventricles and ages. Cell. 184 (11), 3056-3074 (2021).
- Carloni, S., et al. Identification of a choroid plexus vascular barrier closing during intestinal inflammation. Science. 374 (6566), 439-448 (2021).
- Van Hoecke, L., et al. Involvement of the choroid plexus in the pathogenesis of Niemann-Pick disease type. C. Frontiers in Cell Neuroscience. 15, 757482 (2021).
- Shipley, F. B., et al. Tracking calcium dynamics and immune surveillance at the choroid plexus blood-cerebrospinal fluid interface. Neuron. 108 (4), 623-639 (2020).
- Guerin, C. J., Kremer, A., Borghgraef, P., Lippens, S. Targeted studies using serial block face and focused ion beam scan electron microscopy. Journal of Visualized Experiments. (150), e59480 (2019).
- JoVE. Scanning Electron Microscopy (SEM). JoVE Science Education Database. , (2022).
- Pauwels, M., et al. Choroid plexus derived extracelular vesicles exhibit brain targeting characteristics). Biomaterials. 290, 121830 (2022).

